Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По анализу фазовых превращений в двойных сплавах С неограниченной растворимостью компонентов в жидком и твердом состояниях
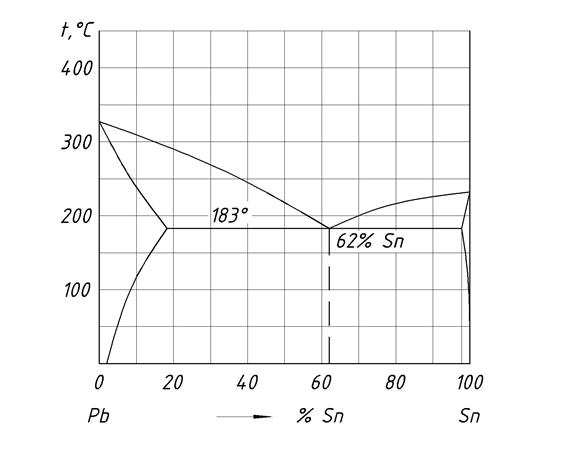
Диаграмма фазового равновесия для рассматриваемого случая представлена на рисунке 1.
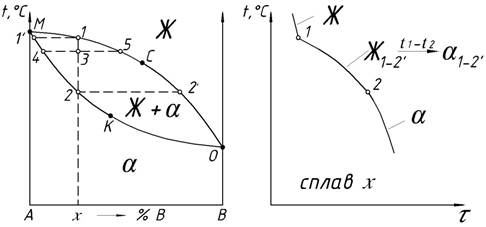
Рисунок 1 - Диаграмма фазового равновесия и кривая охлаждения
Как видно, в диаграмме фазового равновесия наблюдается три области состояний: область гомогенного жидкого раствора Ж выше линии МСО, область гомогенного твердого раствора, обозначенного греческой буквой α ниже линии МКО и область двухфазного равновесия жидкого и твердого раствора Ж + α между линиями МСО и МКО. Линия МСО представляет собой геометрическое место точек температур начала кристаллизации (или конца плавления) твердой фазы α и называется линией ликвидус. Геометрическое место точек температур конца кристаллизации (или начала плавления) твердой фазы есть линия МКО, называемая линией солидус. Выше линии ликвидус жидкий раствор является ненасыщенным, т.е. в нем еще может раствориться добавочное количество компонентов. На линии ликвидуса жидкий раствор становится насыщенным, т.е. таким, в котором компоненты при данной температуре уже в большем количестве не растворяются. Ниже линии ликвидус сплавы переходят в двухфазную область «жидкий раствор + твердый раствор». Следовательно, линия ликвидус представляет собой геометрическое место точек концентраций жидкого раствора, находящегося в равновесии с твердым раствором. Аналогично линия солидус характеризует концентрацию твердого раствора, находящегося в равновесии с жидким раствором. Ниже линии солидус МКО находится область ненасыщенного твердого раствора. Рассмотрим фазовые превращения, происходящие в рассматриваемой системе, на примере охлаждения сплава состава x. В соответствии с правилом фаз кристаллизация твердого раствора происходит в некотором интервале температур t1 – t2, называемом интервалом кристаллизации (C = 1), и на кривой охлаждения будут две критические точки 1 и 2 (рисунок 1). Выше температуры ликвидуса t1 сплав находится в области однофазного ненасыщенного жидкого раствора. При t1 жидкий раствор становится насыщенным. Ниже t1 начинается фазовый переход жидкой фазы в твердую (твердый раствор), который заканчивается при температуре солидуса t2. Концентрация жидкой и твердой фазы изменяется при этом по сопряженным кривым 1-2´ и 1´-2, соответственно. Следовательно, концентрация жидкой фазы меняется по отрезку 1-2´ кривой ликвидуса, а твердой фазы - по отрезку 1´-2 кривой солидуса.
Процесс фазового перехода записывают следующим образом:
В левой части записывается исходная фаза, а в правой - конечная. Стрелка означает фазовый переход, а t1 и t2 над стрелкой - температуры начала и конца фазового перехода. Индексы 1-2´ фазы в левой части показывают изменение концентрации исходной фазы в интервале температур t1 – t2 фазового перехода, а индексы 1´-2 фазы α в правой части - соответственно изменение концентрации конечной фазы. Представленная запись читается так: жидкая фаза в интервале температур t1 – t2 переходит в твердую фазу α, причем концентрация жидкой фазы изменяется по линии 1-2´, а твердой фазы - по линии 1´-2. В интервале температур t1 – t2 массу каждой отдельно взятой фазы в соответствии с правилом отрезков можно определить из следующих соотношений:
т.е. для определения количества жидкой фазы при температуре t3 необходимо взять отношение длины отрезка 4-3, примыкающего к области твердой фазы, к длине отрезка 4-5; для подсчета количества твердой фазы берется отношение длины отрезка 3-5, примыкающего к области жидкой фазы, к длине отрезка 4-5. Ниже температуры солидуса t2 происходит охлаждение однофазного ненасыщенного твердого раствора. Микроструктура сплава состоит из зерен твердого раствора α (рисунок 2).
Рисунок 2 - Схема микроструктуры сплава x. Приложение 2 ПРИМЕР АНАЛИЗА КРИВОЙ ОХЛАЖДЕНИЯ ЖЕЛЕЗОУГЛЕРОСТЫХ СПЛАВОВ
Диаграмма фазового равновесия системы железо-углерод (рисунок 3) относится к типу диаграмм с ограниченной растворимостью углерода в железе, имеющем полиморфные модификации с наличием эвтектического, перитектического и эвтектоидного превращений.
Рисунок 3 - Диаграмма состояния железо-углерод
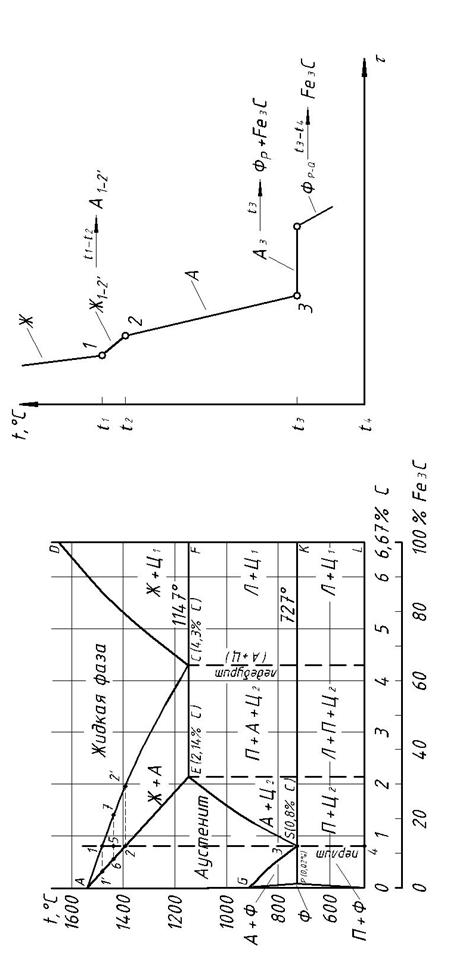
Метастабильная диаграмма состояния железо-карбид железа[1] с обозначением структурных областей по данным микроструктурного анализа представлена на рисунке 4. Рассмотрим фазовые превращения при охлаждении сплава x 1 и вычертим для него кривую охлаждения (рисунок 4). Выше температуры ликвидуса сплав находится в области однофазного ненасыщенного жидкого раствора.
При температуре t1 сплав становится ненасыщенным. Ниже температуры t1 начнется процесс кристаллизации сплава, который закончится при температуре солидуса t2. В интервале температур t1 – t2 сплав находится в двухфазной области (Ж+А). Процесс перехода жидкой фазы в твердую (аустенит) записывают следующим образом:
Количество каждой отдельно взятой фазы при t5 определяется по правилу отрезка следующими соотношениями:
Концентрация твердой фазы (аустенита) при t5 будет выражаться точкой 6, а равновесной с ней жидкой фазы – точкой 7. В интервале температур t2-t3 происходит охлаждение однофазного твердого раствора (аустенита). При температуре t3 (на диаграмме состояния железо – карбид железа точка S) происходит эвтектоидное превращение:
По правилу фаз при трехфазном равновесии (C =0) температура и концентрация фаз в течение всего превращения остаются постоянными (температурная остановка на кривой охлаждения). В интервале температур t3–t4 происходит охлаждение сплава. Образовавшаяся микроструктура сплава перлит (эвтектоид) представляет собой смесь двух фаз (феррита и цементита) (рисунок 5). Количество каждой отдельно взятой фазы (в структуре перлита) при комнатной температуре можно определить из следующих соотношений:
Концентрация фазы феррит будет выражаться точкой Q, а равновесной с ней фазы цементит – точкой L.
Рисунок 5 - Схема микроструктуры сплава x.
Приложение 3
Приложение 4
ЛАБОРАТОРНАЯ РАБОТА № 1
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 112; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.39.23 (0.008 с.) |
||||||||||||||||||||||||||||
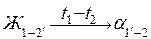 .
.
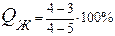 ;
; 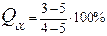 ,
,


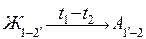 .
.
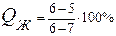 ;
; 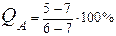 .
.
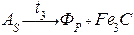
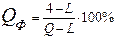 ;
; 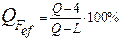 .
.