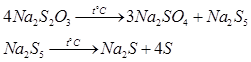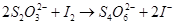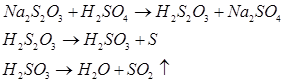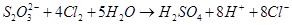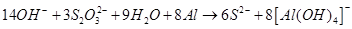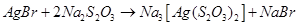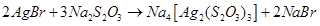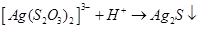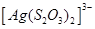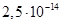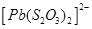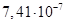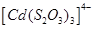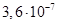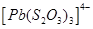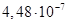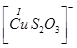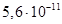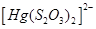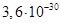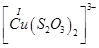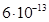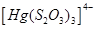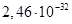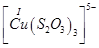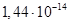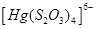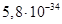Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічні властивості тіосульфату натріюСодержание книги Поиск на нашем сайте
а) загальні хімічні властивості тіосульфату натрію Тіосульфат натрію можна віднести до досить нестійких речовин. При нагріванні до 2200С розпадається відповідно до схеми:
В реакції термічного розкладу тіосульфату натрію отримують полісульфід натрію, котрий також далі розкладається на сульфід натрію та елементарну сірку. Розчини тіосульфату натрію нестабільні через взаємодію з вуглекислим газом, що міститься в повітрі та розчинений у воді: S2O32- + CO2 + H2O →HSO3- +S↓ + HCO3- А також через окислення киснем повітря: S2O32- + O2 →2SO42- +S↓ Тому готувати розчин тіосульфату натрію з наважки недоцільно, зазвичай готують розчин приблизної концентрації та встановлюють точну концентрацію титруванням розчином біхромату калію або розчином йоду. При йодометричному титруванні застосовують метод зворотного титрування, так як додають надлишок розчину йодиду калію точної концентрації, а потім титрують йод, що утворився, розчином тіосульфату натрію, наприклад, при визначенні Fe3+: 2Fe3+ + 2I- →I2 + 2Fe2+
Оскільки йод навіть в слабкокислих розчинах містить гіпойодид-іони, що утворюються в результаті його гідролізу, які є більш сильними окисниками, ніж йод, і окислюють тіосульфати до сульфатів, помітно може проходити побічна реакція: S2O32- + 4I2 +10OH- →2SO42- + 8I- + 5H2O При збільшенні концентрації гідроксил-іонів збільшується кількість тіосульфату, який окислюється до сульфату. В сильно лужному середовищі ця реакція проходить кількісно, йодат-іони в ході реакції не утворюються. Хоча реакція між йодом та тіосульфатом проходить швидко і якась кількість тетратіонату утворюється одразу після змішування, було доведено утворення безбарвної проміжної сполуки S2O3І- в результаті швидкої зворотної реакції S2O32- + I3- ↔ S2O3І- + 2I- Проміжна сполука вза’ємодіє з йодидом: S2O3І- + I- → S4O62- + 2I3-, Чим і пояснюється повторна поява йоду поблизу кінцевої точки при титруванні дуже розбавлених розчинів йоду. Виділити тіосірчану кислоту Н2S2O3 реакцією тіосульфату натрію з сильною кислотою неможливо, так як вона нестійка і одразу розкладається:
В таку ж реакцію буде вступати соляна та азотна кислоти. Розкладання супроводжується виділенням SO2, який має неприємний запах и подразнює слизові оболонки дихальних шляхів, що потребує обережності при роботі з ним. б) Окисно-відновні властивості тіосульфату натрію У зв’язку з наявністю атомів сірки зі ступенем окиснення 0 іон тіосульфату S2O32- має відновні властивості. Наприклад, слабкими окисниками (І2, Fe3+) тіосульфат окиснюється до іона тетратіоната:
Наведена реакція дуже важлива, так як є основою йодометрії. Більш сильні окисники окислюють його до іона сульфату:
Слід також відмітити, що в лужному середовищі окиснення тіосульфату натрію йодом теж може проходити до сульфату. Сильними відновниками іон S2O32- відновлюється до похідних S2-:
Як видно з наведених реакцій, в залежності від умов, тіосульфат натрію може проявляти як окисні, так і відновні властивості. в) комплексоутворюючі властивості тіосульфатів Тіосульфат-іон – сильний комплексоутворювач, що використовується в фотографії для видалення з фотоплівки невідновленого броміду срібла:
Слід відмітити, що металами S2O32- іон координується через атом сірки, тому тіосульфатні комплекси легко перетворюються у відповідні сульфіди, наприклад:
Існують тіосульфатні комплекси багатьох металів. В літературі [3,6] описано наявність близько 40 комплексних сполук з багатьма важкими металами. В [11] наведені константи нестійкості комплексних іонів, де комплексоутворюючим іоном виступають атоми срібла, барію, кальцію, кадмію, кобальту, міді, заліза, ртуті, марганцю, магнію, натрію, нікелю, свинцю, стронцію та цинку. Для багатьох важких металів такі комплексні сполуки є надзвичайно стійкими і з їх допомогою можна виводити важкі метали з організму при отруєннях. У випадках, коли важкі метали не утворюють стійких комплексів, взаємодія з тіосульфат-іонами призводить спочатку до утворення відповідних тіосульфатів, які миттєво або при кип’ятінні виділяють сульфіди. В таблиці 1.1. наведені значення деяких констант нестійкості комплексних іонів, які містять в своєму складі іон тіосульфату:
Таблиця 1.1 - Значення констант нестійкості комплексних іонів
Виходячи зі значень констант нестійкості комплексів можна зробити висновок, що найбільш стійкими будуть комплекси, які включають іони двовалентної ртуті, що можна використовувати при отруєннях нею.
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 113; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.93.183 (0.007 с.) |