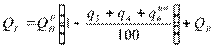Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тепловой баланс камеры сжигания топливаСодержание книги
Поиск на нашем сайте
QpH + Qв + QT = Q1 + Q2 + Q3 + Q4 + Q5 + Q6 где Qв – тепло, необходимое для очистки воздуха; QТ – тепло, приносимое топливом. Qв V× a= t (Ct)×в В× QT C×= B T t×T Тепловыделение в камере сгорания – то тепло, которое выделяется в камере сгорания и не учитывает потери топлива под химическим и механическим недожогом.
По тепловыделению в топке определяется теоретическая температура горения топлива. Методика определения тепловыделения в топке 1.Определяем энтальпию дымовых газов для температур 500, 1000, 2000оС. 2.Строится графическая зависимость, причём по вертикали откладывается энтальпия дымовых газов. 3.Определяем тепловыделение в топке. 4.На графической зависимости откладываем тепловыделение топки и по нему определяем адиабатную или теоретическую температуру. ^ Процессы горения топлива
-Подготовка топлива к процессу горения – подсушка топлива, подогрев, выделение летучих веществ. -Смесеобразование – перемешивание летучих веществ с окислителями, воспламенение, гомогенное выгорание и горение летучих веществ. -Образование кокса и его гетерогенное горение. При этом осуществляются следующие реакции горения: С + О2 = СО2 + Q1 2C +O2 = 2CO +Q2 2CO2 + O2 = 2CO2 + Q3 Q1 > Q2 > Q3 СО2 + С = 2СО (-Q4) CO + H2O = CO2 + H2 (-Q5) Основу этих ракциях составляют гетерогенные процессы, наиболее длительные по времени. При сравнительно низких температурах до 800оС скорость химических реакций мала. Поэтому скорость поглощения кислорода во много раз меньше скорости, с которой кислород поставляется к поверхности горения. Скорость процесса горения лимитируется скоростью химической реакции, которая подчиняется закону Аррениуса и может быть определена в виде произведения постоянной скорости горения на концентрацию кислорода у поверхности или в потоке. Период горения, в котором скорость реакции определяется скоростью окисления вещества называется кинетическим периодом горения. При увеличении температуры в пределах 800 - 900оС скорость химической реакции становится соизмеримой и равна скорости доставки кислорода к окисляемой поверхности:
v д = aд × (Со – Сs), где aд – коэффициент массообмена, характеризующий скорость переноса кислорода из потока за счёт молекулярной или турбулентной диффузии. В области горения 800 - 900оС происходит как кинетическое, так и диффузионное горение. Ближе к 800оС k > aд и скорость горения определяется скоростью реакции окисления. Ближе к 900оС наблюдается обратный процесс, т. е. скорость горения определяется диффузией поступающей к поверхности частицы окислителя (вторая область процесса горения). При высоких температурах (900 - 1500оС) происходит процесс выхода СО с поверхности частиц, т. е. процесс диссоциации. В результате скорость реакции замедляется из-за развития вторичных реакций. Кроме того, поверхность частицы уменьшается из-за поступления СО через их поры (III период горения). При температурах более 1500оС изменяется характер химической реакции, и начинают преобладать вторичные (восстановительные) реакции. В этом периоде углеродные частицы газифицируются, т. к. кислород не достигает их поверхности, а химическая реакция перемещается в газовый поток. Перемещение процесса горения в газовый поток несколько повышает скорость реакции по сравнению с III периодом горения (IV период горения). С дальнейшим ростом температуры (>2000оС) начинает сказываться нехватка кислорода в зоне вторичных реакций, т. е. происходит торможение горения (V период горения). В натуральном топливе стадия подготовки происходит при 1000С. Водяной пар, выделяющийся при этом, поднимает объём продуктов сгорания и снижает температуру горения. Образование летучих веществ зависит от состава топлива и его возраста. Для торфа выделение летучих веществ начинается при 1000С, бурого угля – 150 – 1700С, газового угля – 2100С, тощего угля и антрацита – 300 – 4000С. Наибольшее количество летучих веществ образуется при температуре 200 – 4000С и продолжается до 1000 – 11000С. Летучие вещества оказывают большое влияние на горение кокса. Зольность топлива снижает Qрн, что требует затрат тепла на его подогрев. Также зашлаковываются поверхности нагрева котлоагрегата. В существующих топочных устройствах температура горения находится в диапазоне до 16000С из-за неравномерного распределения процесса горения.
При расчёте топочных устройств эти отклонения учитываются с помощью специальных коэффициентов и эмпирических зависимостей.
|
||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 76; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.178.220 (0.01 с.) |