Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сформулируйте вывод по работе. ⇐ ПредыдущаяСтр 3 из 3
Химические свойства амфотерных оснований: Амфотерные гидроксиды проявляют свойства оснований и кислот, поэтому взаимодействуют как с кислотами, так и с основаниями. 1. Взаимодействие с кислотами с образованием соли и воды: Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O. 2. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды: AI(OH)3 + NaOH AI(OH)3 + NaOH 3. Взаимодействие с кислотными и основными оксидами: 2Fe(OH)3 + 3SO3 2Fe(OH)3 + Na2O Способы получения оснований 1. Щелочи получают взаимодействием активных металлов с водой, а также их оксидов с водой: 2Na + 2Н2O = 2NaОН + H2↑ ВаО + Н2O = Ва(OH)2 2. Нерастворимые в воде основания получают в результате реакции обмена между солью и щелочью: Сu(NO3)2 + KOH = KNO3 + Сu(OH)2 ДОМАШНЕЕ ЗАДАНИЕ. Задание: 1. Однажды на складе при побелке потолка гашеной известью были испорчены алюминиевые детали, т. к. они не были надёжно защищены от попадания брызг извести. Порча изделия объясняется тем, что: а) детали были загрязнены побелочным раствором; б) произошло химическое взаимодействие изделий с раствором гашёной извести; в) произошло химическое взаимодействие изделий с водой. 2. Металлы А и Б принадлежат одному и тому периоду и одной и той же группе. Металл А активно взаимодействует с водой, а металл Б не вытесняет водород из кислот. Металл А образует только один оксид, а Б – два, в одном из которых его валентность численно больше, чем номер группы. Назовите эти элементы. 2. Задание для самостоятельного выполнения. Закончить уравнения реакций в молекулярном и ионном виде: 1. NaOH + H2SO4 = 2. Al(OH)3 + HCl = 3. Al(OH)3 + NaOH = 4. KOH + CuSO4 = . УРОК № 38-40 Тема: Соли и их свойства Смотреть по ссылке: https://www.youtube.com/watch?v=7_4eo0FKbjk
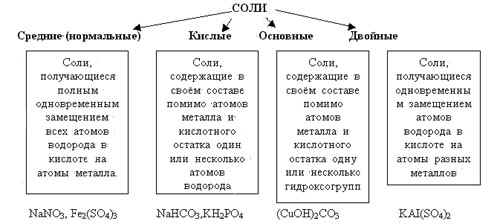
Названия кислых солей. Например, KHCO3 – гидрокарбонат калия КH2PO4 – дигидроортофосфат калия Нужно помнить, что кислые соли могут образовывать двух и более основные кислоты, как кислородсодержащие, так и бескислородные кислоты. Чтобы назвать основную соль необходимо к названию нормальной соли прибавить приставку гидроксо- или дигидроксо- в зависимости от числа ОН - групп, входящих в состав соли. Например, (CuOH)2CO3 - гидроксокарбонат меди (II)
Нужно помнить, что основные соли способны образовывать лишь основания, содержащие в своём составе две и более гидроксогрупп. Однако, следует понимать, что многие из кислых и основных солей могут существовать лишь только теоретически, реально же в растворах такие соли, как правило, нестабильны. Лабораторная работа № 5 Тема: Взаимодействие солей с металлами, с солями. Смотреть по ссылке: https://www.youtube.com/watch?v=bsUVuMNRfkY
|
|||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 193; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.47.253 (0.006 с.) |
 Na[AI(OH)4],
Na[AI(OH)4],
 Fe2(SO4)3 + 3H2O,
Fe2(SO4)3 + 3H2O,