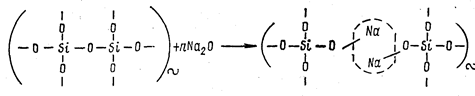Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Бинарные щелочно-силикатные стекла
Бинарные щелочно-силикатные стекла систем Ме2О—SiО2 (где Me—Li, Na, К, Rb, Cs, Tl). Введение в состав стекла оксидов щелочных металлов приводит к разрыву структурной сетки и выстраиванию атомов щелочных металлов по месту разрыва по схеме:
В том месте, где выстроились ионы щелочного металла, отсутствует химическая связь между элементами структуры (место разрыва на схеме обозначено пунктирным овалом). Ионы щелочных металлов являются модификаторами. По мере увеличения концентрации Me2О в составе стекла растет число разрывов в структурной сетке и число не мостиковых атомов кислорода, приходящихся на один тетраэдр SiО4. При концентрациях Ме2О более 60 мол. в % создаются условия для образования изолированных тетраэдров SiО4. Кристаллизуются подобные расплавы чрезвычайно быстро, так как облегчаются условия переориентации структурных единиц, в то время как застывание расплава в виде стекла при этом затруднено. Области стеклообразования в бинарных щелочно-силикатных системах непрерывны. В системе с Li2O содержание предельных концентраций SiO2 составляет 100—64 мол.%, с Na2О 100—48 мол.%, с К2О 100-46 мол. %, с TI2O 50—33 мол. %. Фосфатные стекла Фосфатные стекла построены из тетраэдров [PО4]3. Один из атомов кислорода тетраэдра не может участвовать в образовании связи с другими компонентами структуры из-за наличия двойной связи фосфор — кислород. В структуре фосфатных стекол мостиковыми могут быть только три атома кислорода фосфор кислородного тетраэдра.
Рис. 2.1. Область стеклообразования и область ликвации в системе Na2O—B2O5— SiO2 А— область ликвации; Б—линия, по которой наиболее полно проявляется борная аномалия; В— граница стеклообразования; М— граница опалесцирующих стекол по О. С. Молчановой; / — стекло пирекс; 2 — стекло викор Рис. 2.2. Схемы кристаллитного строения кварцевого (а) и натриево-силикатного (б) стекол (по Порай-Кошицу) 1 —кристаллы кварца; 2— кристаллы силиката натрия; 3— ионы натрия; 4—тетраэдры Si0. По данным рентгеноструктурного анализа расстояние Р—О в стеклах равно 0,157 нм, угол Р—О—Р—1400. В этом отношении структура Р203 отличается от структур других стеклообразователей, у которых все атомы кислорода мостиковые. Пространственная структура фосфатных стекол может состоять из колец различного размера, образованных чередующимися атомами фосфора и кислорода, лент или цепочек из тетраэдров РО4.
Результаты рентгеноструктурного анализа показывают, что структура двойных фосфатных стекол подобна структуре двойных силикатных стекол по следующим двум параметрам: структурной основной единицей являются тетраэдрические элементокислородные группировки; с добавлением модифицирующих оксидов растет число не мостиковых атомов кислорода.
|
|||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 133; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.9.115 (0.005 с.) |