
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа № 1. Свойства элементов I А группыСтр 1 из 2Следующая ⇒
Лабораторная работа № 1. Свойства элементов I А группы Водород Опыт 1. Окислительные свойства катиона водорода. А. В три пробирки налить по нескольку капель раствор соляной кислоты концентрацией 15 % и поместить кусочки металлических цинка, железа, меди. Наблюдать выделение газа. В каком случае водород не выделяется и реакция не идет. Почему? В каком случае реакция протекает наиболее интенсивно? Щелочные металлы Опыт 1. Окрашивание пламени. В пламя горелки последовательно внести по капле солей щелочных металлов (Li, Na, K). Отметить цвет пламени. Опыт 2. Получение труднорастворимых соединений щелочных металлов. А. Получение осадка дигидроантимоната натрия:
В пробирку внести 2–3 капли раствора соли натрия и прибавить равный объем дигидроантимоната калия. Для улучшения выпадения осадка можно потереть внутренние стенки пробирки стеклянной палочкой, охладить реакционную смесь. Белый осадок Б. Образование малорастворимых соединений лития. В 3 пробирки налить по 3–4 каплям соли лития и прибавить гидроксид натрия и гидрофосфат натрия (при нагревании); фторид натрия; карбонат натрия. Белый осадок и увранение
Лабораторная работа № 2. Свойства элементов II А группы Опыт 1. Окрашивание пламени горелки. В пламя горелки последовательно вести по капле солей кальция, стронция, бария. Опыт 2. Образование карбонатов. В 3 пробирки налить по 3-4 капли сульфата магния, хлоридов кальция, стронция и бария. В 4-ю пробирку налить 3–4 капли сульфата магния Во все пробирки прибавить раствор соды. К осадкам карбонатов добавить немного соляной кислоты. Почему происходит растворение осадков? уравнения Опыт 3. Осаждение гидроксида магния. К 3–4 каплям 5 %-ного раствора сульфата магния прилить 5–7 капель 5 %-ного раствора аммиака. Если осадка не образуется – то добавить несколько капель 5 %-ного раствора щелочи. Почему одного гидроксида аммония бывает недостаточно для образования осадка гидроокиси магния? Провести эту же реакцию в присутствии избытка хлористого аммония. Будет ли образовываться осадок гидроксида магния? Если нет, то почему? Опыт 4. Различия в растворимости сульфатов щелочно-земельных металлов. К растворам солей магния, кальция, стронция и бария прилить раствор сульфата натрия. Отметить изменения в растворах. Сульфат какого металла наименее растворим? Как меняется растворимость сульфатов от магния к барию?
Выпадают белые осадки кроме магния,растворимость понижается
Лабораторная работа № 3. Свойства бора и алюминия Опыт 1. Окрашивание пламени солями бора. В пламя спиртовки внести каплю борной кислоты. Как окрашивается пламя? Опыт 2. Кислотные свойства борной кислоты. В трех пробирках с 5–8 каплями дистиллированной воды растворить при нагревании по нескольку кристалликов борной кислоты. В одну из пробирок прибавить 3–5 капель нейтрального раствора лакмуса. Отметить изменение его окраски. В другую пробирку внести кусочек магниевой ленты. Отметить выделение газа. В третью пробирку опустить полоску универсальной индикаторной бумажки и сравнить ее окраску с окраской эталонной шкалы. Сделать вывод о рН борной кислоты в полученном растворе. Написать уравнения реакций: а) взаимодействия борной кислоты с магнием; б) диссоциации борной кислоты; Сильным или слабым электролитом является борная кислота? Опыт 10. Сульфид олова (IV) и его свойства Получение сульфидов. В 2 пробирки налить по 3–4 капли хлорида олова (II) и хлорида олова (IV). К каждой пробирке добавить подкисленный раствор сульфида натрия. Лабораторная работа № 5. Свойства элементов V А группы Опыт 10. Образование и свойства сульфида висмута. В пробирку налить несколько капель нитрата висмута. И добавить раствор сульфида натрия. Отметить цвет осадка. Жидкость над осадком слить и прилить сульфид натрия и нагреть и отметить растворяется ли осадок. Опыт 11. Окислительные свойства соединений висмута (V). К 2-м каплям раствора соли марганца (II) прибавить 2 мл 6 н. раствора азотной кислоты и немного твердого висмутата натрия (на кончике шпателя). Смесь перемешать. При этом образуется раствор марганцевой кислоты розового цвета.
Опыт 5. Образование малорастворимых соединений. А. Налейте в одну пробирку 3–4 капли раствора сульфата железа (II), в другую – столько же раствора сульфата марганца и прибавьте к ним сульфид натрия. Напишите молекулярно-ионные и молекулярные уравнения реакции.
Б. К 3–4 каплям сульфата цинка, подкисленного 1–2 каплями соляной кислотой, прибавьте сульфид натрия. Напишите уравнения реакций. Реакции сульфит-иона. Опыт 7. Свойства фторидов А. Кислотно-основные реакции фторид-иона. Растворить немного фторида натрия в воде и определить рН раствора при помощи индикаторной бумаги. Раствор сохранить для других опытов. Б. Осаждение фторид-иона. В две пробирки налить немного раствора фторида натрия. В одну пробирку прилить раствор хлорида кальция, в другую – хлорид бария. Образовавшиеся осадки фторидов кальция и бария растворить в соляной или разбавленной азотной кислотах. Лабораторная работа № 1. Свойства элементов I А группы Водород
|
||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 194; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.161.77 (0.005 с.) |
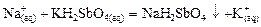 .
.


