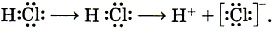Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема программы: Стоение вещества.Содержание книги
Поиск на нашем сайте
Группа№21, химия,урок№95. Тема программы: Стоение вещества. Тема урока: Зависимость геометрического строения молекулы от гибридизации центрального атома на примерах: sp 3- гибридизации – молекулы метана,аммиака, воды. Цель урока: Рассмотреть зависимость геометрического строения молекулы от гибридизации центрального атома на примерах: sp 3- гибридизации – молекулы метана,аммиака, воды. План. Ковалентная связь - насыщаемость, поляризуемость и направленность в пространстве. Модель молекулы метана. 3. Формы молекул аммиака, воды. Взаимосвязь числа неподеленных электронных пар и угла связи в молекулах Содержание темы. Ковалентная связь наиболее распространена в мире органических веществ, она характеризуется насыщаемостью, поляризуемостью и направленностью в пространстве. Насыщаемость ковалентной связи состоит в том, что число общих электронных пар, которые способен образовать тот или иной атом, ограничено. Благодаря этому ковалентные соединения имеют строго определенный состав. Поэтому, например, существуют молекулы Н 2, N 2, СН 4, но нет молекул Н 3, N 4, СН 5. Поляризуемость ковалентной связи заключается в способности молекул (и отдельных связей в них) изменять свою полярность под действием внешнего электрического поля — поляризоваться. В результате поляризации неполярные молекулы могут стать полярными, а полярные — превратиться в еще более полярные вплоть до полного разрыва отдельных связей с образованием ионов:
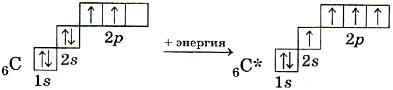
Направленность ковалентной связи обусловлена тем, что р-, d- и f-облака определенным образом ориентированы в пространстве. Направленность ковалентной связи влияет на форму молекул веществ, их размеры, межатомные расстояния, валентный угол, т. е. на геометрию молекул. Более полное представление о форме молекул органических и неорганических веществ можно составить на основе гипотезы о гибридизации атомных орбиталей. Она была предложена Л. Полингом (США) для объяснения установленного с помощью физических методов исследования веществ факта равноценности всех химических связей и симметричного расположения их относительно центра молекул СН 4, BF 3, ВеСl 2. В образовании σ-связей в каждом случае от центрального атома (С, В, Be) должны были участвовать электроны, находящиеся в разных состояниях (s и р), поэтому они не могли быть равноценными. Теория оказалась неспособной объяснить факты, возникло противоречие, которое было разрешено с помощью новой гипотезы. Это один из примеров, показывающих путь развития познания человеком окружающего мира, возможность все более глубокого проникновения в сущность явлений. С гипотезой гибридизации атомных орбиталей вы знакомились в курсе органической химии на примере атома углерода. Напомним об этом еще раз. При образовании молекулы метана СН 4 атом углерода из основного состояния переходит в возбужденное:
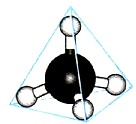
Внешний электронный слой возбужденного атома углерода содержит один s- и три неспаренных р-электрона, которые и образуют четыре σ-связи с четырьмя s-электронами атомов водорода. При этом следует ожидать, что три связи С--Н, образованные за счет спаривания трех р-электронов атома углерода с тремя s-электронами трех атомов водорода (s—р σ-связь), должны бы отличаться от четвертой(s—s) связи прочностью, длиной, направленностью. Изучение электронной плотности в молекулах метана показывает, что все связи в его молекуле равноценны и направлены к вершинам тетраэдра (рис. 10). Согласно гипотезе о гибридизации атомных орбиталей четыре ковалентные связи молекулы метана образуются с участием не «чистых» s- и р-облаков атома углерода, а с участием так называемых гибридных, т. е. усредненных, равноценных электронных облаков.
Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г. 2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г. 3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г. 4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005 Перечень цифровых образовательных ресурсов и Web-сайтов Интернет 1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов: Группа№21, химия,урок№95. Тема программы: Стоение вещества. Тема урока: Зависимость геометрического строения молекулы от гибридизации центрального атома на примерах: sp 3- гибридизации – молекулы метана,аммиака, воды. Цель урока: Рассмотреть зависимость геометрического строения молекулы от гибридизации центрального атома на примерах: sp 3- гибридизации – молекулы метана,аммиака, воды. План.
|
||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 84; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.212.203 (0.006 с.) |