
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коэффициент теплоотдачи от рабочего тела к стенке. ⇐ ПредыдущаяСтр 7 из 7
α1 и α2 – коэффициенты теплообмена; λ – к-т теплопроводности стенки; σ – толщина стенки. Коэффициент зависит от рода материала стенки, от толщены стенки и от температуры окружающей среды. 47 Коофф теплоотдачи вход в формулу 3-на Ньютона – Рихмана зависит от большого числа факторов: 1 конструктивные особенности теплообменного аппарата. 2 направление движен теплоносителей. 3 физическо- химических свойств теплоносителей. 4 от сост поверхности и тд. Для определ α необх знать величину критерию Нуссельта: q=αΔt. 3-н Фурье: 48. Парообразование, переход вещества из конденсированной фазы (жидкой или твёрдой) в газовую (фазовый переход I рода). Различают следующие виды парообразования: испарение (парообразование со свободной поверхности конденсированной фазы, в случае твёрдого тела — сублимация или возгонка) кипение (парообразование, характеризующееся возникновением пузырьков насыщенного пара на поверхностях нагрева и ростом пузырьков в объёме жидкости). Диаграммы T,S,i,s для пара. Энтальпия. H=U+pV если m не равна 1кг. h=u+pv если m = 1кг. U-внутр.энергия. р-абсолютное давление, V-объем. V-удельный объем. Энтальпия является функцией внутренней энергии и термических параметров состояния и поэтому сама является функцией состояния. Δq=du+Δe; Δq=du+pdv; v=const; du=0; Δq=du; Cv*dT=du. Не смотря на то что формула изменения внутр.энергии выведена для изохорного процесса она справедлива для любого другого, т.к. внутр.энергия является функцией состояния. H=u+pv; dh=du+pdv+vdp; Δq=dh-vdp-вторая форма записи 1 з-на термодинамики. -vdp=ΔL0-располагаемая работа. р=const; dp=0; Δq=dh; Δq=CpdT; dh=CpdT. Не смотря на то что зависимость выведена для изобарного процесса она справедлива и для других процессов. 50.Термодинамические основы получения холода. Согласно второму началу термодинамики, указанный выше перенос теплоты самопроизвольно не происходит, требуя затрат работы. В термодинамич. процессах подвод или отвод теплоты q описывается через изменение энтропии dS системы: dq = TdS, где Т - т-ра. Отсюда следует, что при подводе к телу теплоты его энтропия возрастает, а при отводе теплоты -уменьшается. В непрерывных холодильных процессах хладагент должен принять теплоту от охлаждаемого тела на ниж. температурном уровне, отдать теплоту на верх. уровне к.-л. теплоприемнику и вернуться в исходное состояние. Поэтому в установившемся процессе суммарная энтропия хладагента не изменяется (dS=0).
В учебнике стр 213-214.
52. Энтропия рабочего тела. Одним из функций состояния термодинамической системы является энтропия. Энтропией называется величина определяемая выражением:dS = dq / T. [Дж/К] или для удельной энтропии:ds = dq / T. [кДж/(кг·К)] Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только его изменение в данном процессе, которые можно найти по следующим уравнениям: Ds = cv·ln(T2/T1) + R·ln(υ 2/υ 1); Если энтропия системы возрастает (Ds > 0), то системе подводится тепло.
|
||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 114; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.239.195 (0.006 с.) |

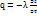 ; [αΔt]=[
; [αΔt]=[  ]; λ/
]; λ/  = α.
= α. 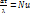 - критерий Нульсона. Коофицент теплоотдачи -
- критерий Нульсона. Коофицент теплоотдачи - 
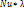 - кооф теплопровод,
- кооф теплопровод,  - время.
- время.


