Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел II. Основы теории теплообмена
Теплотехника Теплотехника — общетехническая дисциплина, изучающая методы получения, преобразования, передачи и использования теплоты, а также принцип действия и конструктивные особенности тепло- и парогенераторов тепловых машин, агрегатов и устройств. Теоретическими разделами теплотехники, в которых исследуются законы превращения и свойства тепловой энергии, а также процессы распространения теплоты являются техническая термодинамика и теория теплообмена. В развитии теплотехники и её теоретических основ большая заслуга принадлежит российским учёным. Д. И. Менделеев провёл фундаментальные работы по общей теории теплоёмкостей и установил существование для каждого вещества критической температуры. М. В. Ломоносов создал основы молекулярно-кинетической теории вещества и установил взаимосвязь между тепловой и механической энергией. Литература
· ОГЛАВЛЕНИЕ · Раздел I. Основы технической термодинамики Глава 1. Общие понятия и определения
Курс лекций по теплотехнике Автор курса: Скрябин В.И. Введение Теплотехника – наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы действия и конструктивные особенности тепловых машин, аппаратов и устройств. Теплота используется во всех областях деятельности человека. Для установления наиболее рациональных способов его использования, анализа экономичности рабочих процессов тепловых установок и создания новых, наиболее совершенных типов тепловых агрегатов необходима разработка теоретических основ теплотехники. Различают два принципиально различных направления использования теплоты – энергетическое и технологическое. При энергетическом использовании, теплота преобразуется в механическую работу, с помощью которой в генераторах создается электрическая энергия, удобная для передачи на расстояние. Теплоту при этом получают сжиганием топлива в котельных установках или непосредственно в двигателях внутреннего сгорания. При технологическом - теплота используется для направленного изменения свойств различных тел (расплавления, затвердевания, изменения структуры, механических, физических, химических свойств).
Количество производимых и потребляемых энергоресурсов огромно. По данным Минтопэнерго РФ и фирмы "Shell" [3] динамика производства первичных энергоресурсов даны в таблице 1.1. Таблица 1.1.
* тут – тонна условного топлива. Такими теоретическими разделами являются техническая термодинамика и основы теории теплообмена, в которых исследуются законы превращения и свойства тепловой энергии и процессы распространения теплоты. Данный курс является общетехнической дисциплиной при подготовке специалистов технической специальности. Техническая термодинамика (т/д) рассматривает закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми, механическими и химическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях. Термодинамика базируется на двух основных законах (началах) термодинамики: I закон термодинамики - закон превращения и сохранения энергии; II закон термодинамики – устанавливает условия протекания и направленность макроскопических процессов в системах, состоящих из большого количества частиц. Техническая т/д, применяя основные законы к процессам превращения теплоты в механическую работу и обратно, дает возможность разрабатывать теории тепловых двигателей, исследовать процессы, протекающие в них и т.п. Объектом исследования является термодинамическая система, которой могут быть группа тел, тело или часть тела. То что находится вне системы называется окружающей средой. Т/д система это совокупность макроскопических тел, обменивающиеся энергией друг с другом и окружающей средой. Например: т/д система – газ, находящейся в цилиндре с поршнем, а окружающая среда – цилиндр, поршень, воздух, стены помещения. Изолированная система - т/д система не взаимодействующая с окружающей средой. Адиабатная (теплоизолированная) система – система имеет адиабатную оболочку, которая исключает обмен теплотой (теплообмен) с окружающей средой. Однородная система – система, имеющая во всех своих частях одинаковый состав и физические свойства.
Гомогенная система – однородная система по составу и физическому строению, внутри которой нет поверхностей раздела (лед, вода, газы). Гетерогенная система – система, состоящая из нескольких гомогенных частей (фаз) с различными физическими свойствами, отделенных одна от другой видимыми поверхностями раздела (лед и вода, вода и пар). В тепловых машинах (двигателях) механическая работа совершается с помощью рабочих тел – газ, пар. Величины, которые характеризуют физическое состояние тела называются термодинамическими параметрами состояния. Такими параметрами являются удельный объем, абсолютное давление, абсолютная температура, внутренняя энергия, энтальпия, энтропия, концентрация, теплоемкость и т.д. При отсутствии внешних силовых полей (гравитационного, электромагнитного и др.) термодинамическое состояние однофазного тела можно однозначно определить 3-мя параметрами – уд. объемом (υ), температурой (Т), давлением (Р). Удельный объем – величина, определяемая отношением объема вещества к его массе.υ = V / m, [м3/кг], (1.1) Плотность вещества – величина, определяемая отношением массы к объему вещества.ρ = m / V, [кг/м3], (1.2) υ = 1 / ρ; ρ = 1 / υ; υ • ρ = 1. (1.3)Давление– с точки зрения молекулярно-кинетической теории есть средний результат ударов молекул газа, находящихся в непрерывном хаотическом движении, о стенку сосуда, в котором заключен газ.Р = F / S; [Па] = [Н/м2] (1.4) Внесистемные единицы давления : 1 кгс/м2 = 9,81 Па = 1 мм.водн.ст. 1 ат. (техн.атмосфера) = 1 кгс/см2 = 98,1 кПа. 1 атм. (физическая атмосфера) = 101,325 кПа = 760 мм.рт.ст. 1 ат. = 0,968 атм. 1 мм.рт.ст. = 133,32 Па. 1 бар = 0,1 МПа = 100 кПа = 105 Па. Различают избыточное и абсолютное давление. Избыточное давление (Ри)– разность между давлением жидкости или газа и давлением окружающей среды. Абсолютное давление (Р)– давление отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. Это давление является т/д параметром состояния. Абсолютное давление определяется: 1). При давлении сосуда больше атмосферного:Р = Ри + Ро ; (1.5)2). При давлении сосуда меньше атмосферного:Р = Ро + Рв ; (1.6)где Ро – атмосферное давление; Рв – давление вакуума. Температура – характеризует степень нагретости тел, представляет собой меру средней кинетической энергии поступательного движения его молекул. Чем больше средняя скорость движения, тем вышетемпература тела. За т/д параметр состояния системы принимают термодинамическую температуру (Т), т.е. абсолютную температуру. Она всегда положительна, При температуре абсолютного нуля (Т=0) тепловые движения прекращаются и эта температура является началом отсчета абсолютной температуры.
Основные т/д параметры состояния Р, υ, Т однородного тела зависят друг от друга и взаимно связаня между собой определенным математическим уравнением, который называется уравнением состояния: f (Р, υ, Т) = 0. (1.7) Равновесным состоянием называется состояние тела, при котором во всех его точках объема Р, υ и Т и все другие физические свойства одинаковы. Совокупность изменений состояния т/д системы при переходе из одного состояния в другое называется т/д процессом. Т/д процессы бывают равновесные и неравновесные. Если процес проходит через равновесные состояния, то он называется равновесным. В реальных случаях все процессы являются неравновесными. Если при любом т/д процессе изменение параметра состояния не зависит от вида процесса, а определяется начальным и конечным состоянием, то параметры состояния называются функцией состояния. Такими параметрами являются внутренняя энергия, энтальпия, энтропия и т.д. Интенсивные параметры– это параметры не зависящие от массы системы (давление, температура). Аддитивные (экстенсивные) параметры – параметры, значения которых пропорциональны массе системы (Объем, энергия, энтропия и т.д.). Теплота и работа Тела, участвующие при протекании т/д процесса обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами. 1-й способ реализуется при непосредственном контакте тел, имеющих различную температуру, путем обмена кинетической энергией между молекулами соприкасающихся тел либо лучистым переносом внутренней энергии излучающих тел путем э/м волн. При этом энергия передается от более нагретого к менее нагретому. Количество энергии, переданной 1-м способом от одного тела к другому, называется количеством теплоты – Q [Дж], а способ – передача энергии в форме теплоты. 2-й способ связан с наличием силовых полей или внешнего давления. Для передачи энергии этим способом тело должно либо передвигаться в силовом поле, либо изменять свой объем под действием внешнего давления, То есть передачи энергии происходит при условии перемещения всего тела или его части в пространстве. При этом количество переданной энергии называется работой – L [Дж], а способ передача энергии в форме работы. Количество энергии, полученное телом в форме работы называется работой совершенной над телом, а отданную энергию – затраченной телом работой. Количество теплоты, полученное (отданное) телом и работа, совершенная (затраченная) над телом, зависят от условий перехода тела из начального состояния в конечное, т.е. зависят от характера т/д процесса. Внутренняя энергия Яндекс.ДиректЕсли кредит, то в МТС банке! Кредит на любые цели от 17,9%. Акция «Кредитные каникулы». Узнай подробнее.app.mtsbank.ru В общем случае внутренней энергией называется совокупность всех видов энергий, заключенной в теле или системе тел. Эту энергию можно представить как сумму отдельных видов энергий: кинетической энергии молекул (поступательного и вращательного движения молекул); колебательного движения атомов в самой молекуле; энергии электронов; внутриядерной энергии; энергии взаимодействия между ядром молекулы и электронами; потенциальной энергии молекул.
В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. При этом знание абсолютных значений внутренней энергии не требуется. Поэтому внутренней энергией для идеальных газов называют кинетическую энергию движения молекул и энергию колебательных движений атомов в молекуле, а для реальных газов дополнительно включают потенциальную энергию молекул. Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (P,T), U = f (υ,T) U= f (P,υ). Κаждому состоянию рабочего тела (системы) соответствует вполне определенное значение параметров состояния, то для каждого состояния газа будет характерна своя однозначная, вполне определенная величина внутренней энергии U. То есть U является функцией состояния газа. И разность внутренних энергий для двух каких-либо состояний рабочего тела или системы тел не будет зависет от пути перехода от первого состояния во второе. Первый закон термодинамики является основой термодинамической теории и имеет огромное прикладное значение при исследовании термодинамических процессов. Этот закон является законом сохранения и превращения энергии: ¦"Энергия не исчезает и не возникает вновь, она лишь переходит ¦из одного вида в другой в различных физических процессах". Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии т/д системы: ¦"Теплота, подведенная к системе, расходутся на изменение энергии ¦системы и совершение работы". Уравнение первого закона термодинамики имеет следующий вид: Q = (U2 – U1) + L, (2.1)где Q - количества теплоты подведенная (отведенная) к системе; L - работа, совершенная системой (над системой); (U2 – U1) - изменение внутренней энергии в данном процессе. Если: Q > 0 – теплота подводится к системе; Q < 0 – теплота отводится от системы; L > 0 –работа совершается системой; L < 0 – работа совершается над системой. Для единицы массы вещества уравнение первого закона термодинамики имеет вид:q = Q /m = (u2 – u1) + l. (2.2) В дальнейшем все формулы и уравнения будут даны в основном для единицы массы вещества. Теплоемкость газа Яндекс.ДиректЕсли кредит, то в МТС банке! Кредит на любые цели от 17,9%. Акция «Кредитные каникулы». Узнай подробнее.app.mtsbank.ru Истинная теплоемкость рабочего тела определяется отношением количества подведенной (отведенной) к рабочему телу теплоты в данном т/д процессе к вызванному этим изменениям температуры тела.С = dQ / dT, [Дж /К]; (2.3)Теплоемкость зависит от внешних условий или характера процесса, при котором происходит подвот или отвод теплоты. Различают следующие удельные теплоемкости:массовую – с = С / m, [Дж/кг]; (2.4) молярную - сμ = С / ν, [Дж/моль], (2.5) где ν - количества вещества [моль]; объемную - с/ = С / V = с·ρ, [Дж/м3], (2.6)где - ρ = m / V - плотность вещества. Связь между этими теплоемкостями:с = с/ · υ = сμ / μ, где - υ = V/m - удельный объем вещества, [м3/кг]; μ = m /ν – молярная (молекулярная) масса, [кг/моль]. Теплоемкость газов в большой степени зависит от тех условий, при которых происходит процесс их нагревания или охлаждения. Различают теплоемкости при постоянном давлении (изобарный) и при постоянном объеме (изохорный). Таким образом различают следующие удельные теплоемкости: ср, сv – массовые изобарные и изохорные теплоемкости; сpμ, сvμ – молярные изобарные и изохорные теплоемкости; с/p, с/v – объемные изобарные и изохорные теплоемкости. Между изобарными и изохорными теплоемкостями существует следующая зависимость:ср - сv = R - уравнение Майера; (2.7) сpμ - сvμ = Rμ. (2.8)Теплоемкость зависит от температуры, которые даются в справочных литературах в виде таблицы как средние теплоемкости в интервале температур от 0 до tх. Для определения средней теплоемкости в интервале температур от t1 до t2 можно использовать следующую формулу: с|t2t1 = (с|t20 t2 - с|t10 t1) / (t2 - t1). (2.9)
Энтропия Яндекс.Директ
Одним из функций состояния термодинамической системы является энтропия. Энтропией называется величина определяемая выражением:dS = dQ / T. [Дж/К] (3.1)или для удельной энтропии:ds = dq / T. [Дж/(кг·К)] (3.2) Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только его изменение в данном процессе, которые можно найти по следующим уравнениям: Ds = cv·ln(T2/T1) + R·ln(υ 2/υ 1); (3.5) Если энтропия системы возрастает (Ds > 0), то системе подводится тепло. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Цикл и теоремы Карно Яндекс.Директ
Циклом Карно называется круговой цикл, состоящий из 2-х изотермических и из 2-х адиабатных процессов. Обратимый цикл Карно в p,υ- и T,s- диаграммах показан на рис.3.1.
ht = Lц / Qц, (3.8) или ht = (Q1 – Q2) / Q1. Для обратимого цикла Карно т.к.п.д. определяется по формуле: htк = (Т1 – Т2) / Т1. (3.9) Отсюда следует 1-я теорема Карно: Тема 4. Термодинамические процессы Яндекс.Директ
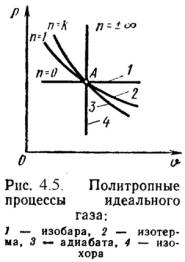
Изопроцессы идеального газа Яндекс.ДиректЕсли кредит, то в МТС банке! Кредит на любые цели от 17,9%. Акция «Кредитные каникулы». Узнай подробнее.app.mtsbank.ru 1). Изохорный процесс (Рис.4.1). n = Const, n 2 = n 1. (4.10) Уравнение состояния процесса: P2 / P1 = T2 / T1. (4.11) Так как υ 2 = υ 1, то l = 0 и уравнение 1-го закона т/д имеет вид: q = Du = = сv·(t2 - t1); (4.12)
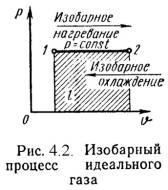
2). Изобарный процесс (Рис.4.2). n 2 /n 1 = T2 / T1, (4.13) Работа этого процесса: l = P·(n 2 - n 1). (4.14) Уравнение 1-го закона т/д имеет вид: q = Du + l = ср·(t2 - t1); (4.15)
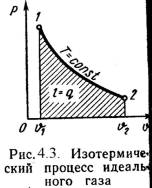
3). Изотермический процесс (Рис.4.3). Т = Const, Т2 = Т1 Уравнение состояния: P1 / P2 = n 2 / n 1, (4.16) Так как Т2 = Т1, то Du = 0 и уравнение 1-го закона т/д будет иметь вид: q = l = R·T·ln(n 2/n 1), (4.17) или q = l = R·T·ln(P1/P2), (4.18)
P· nl = Const, (4.19) где l = cp / cv – показатель адиабаты. l = -Du = = -сv·(t2 – t1) = сv·(t1 – t2), (4.20) или l = R·(T1 – T2) / (l -1); (4.21)
Предыдущая страница | Следующая страница | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Политропный процесс Яндекс.ДиректЕсли кредит, то в МТС банке! Кредит на любые цели от 17,9%. Акция «Кредитные каникулы». Узнай подробнее.app.mtsbank.ru Политропным процессом называется процесс, все состояния которого удовлетворяются условию: P· nn = Const, (4.24) где n – показатель политропы, постоянная для данного процесса. l = R·(T1 – T2) / (n – 1); (4.25) Теплота процесса: q = cn ·(T2 – T1), (4.28) где cn = cv ·(n - l)/(n – 1) – массовая теплоемкость (4.29)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Поделиться: |

Дросселирование
Яндекс.Директ  Заявка на карту ТИНЬКОФФ! Кредитная карта Тинькофф с лимитом до 300 т.р! До 55 дней без % + доставка!tinkoff.credit-a.ru
Заявка на карту ТИНЬКОФФ! Кредитная карта Тинькофф с лимитом до 300 т.р! До 55 дней без % + доставка!tinkoff.credit-a.ru
Дросселированием называется явление, при котором пар или газ переходит с высого давления на низкое без совершения внешней работы и без подвода или отвода теплоты. Такое явление происходит в трубопроводе, где имеется место сужения проходного канала (Рис.5.2). При таком сужении, вследствие сопротивлений, давление за местом сужения - Р2, всегда меньше давления перед ним – Р1.
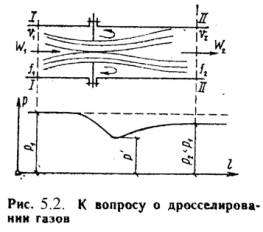
Любой кран, вентиль, задвижка, клапан и прочие местные сопротивления, уменьшающие проходное сечение трубопровода, вызывают дросселирования газа или пара, следовательно падения давления. В большинстве случаев это явление приносит безусловный вред. Но иногда оно является необходим и создается искусственно (регулирование паровых двигателей, в холодильных установках, в приборах для измерения расхода газа и т.д.).
При прохождении газа через отверстие, кинетическая энергия газа и его скорость в узком сечении возрастают, что сопровождается падением температуры и давления.
Газ, протекая через отверстие, приходит в вихревое движение. Часть его кинетической энергии затрачивается на образование этих вихрей и превращается в теплоту. Кроме того, в теплоту превращается и работа, затраченная на преодоление сопротивлений (трение). Вся эта теплота воспринимается газом, в результате чего температура его изменяется (уменьшается или увеличивается).
В отверстие скорость газа увеличивается. За отверстием газ опять течет по полному сечению и скорость его вновь понижается. А давление увеличивается, но до начального значения оно не поднимается; некоторое изменение скорости произойдет в связи с увеличением удельного объема газа от уменьшения давления.
Дросселирование является необратимым процессом, при которм происходит увеличение энтропии и уменьшение работоспособности рабочего тела.
Уравнением процесса дросселирования является следующее уравнение:i1 = i2. (5.14)
Это равенство показывает, что энтальпия в результате дросселирования не изменяется и справедливо только для сечений, достаточно удаленных от сужения.
Для идеальных газов энтальпия газа является однозначной функцией температуры. Отсюда следует, что при дросселировании идеального газа его температура не изменяется (Т1 = Т2).
При дросселировании реальных газов энтальпия газа остается постоянной, энтропия и объем увеличиваются, давление падает, а температура изменяется (увеличивается, уменьшается или остется неизменной).
Изменение температуры жидкостей и реальных газов при дросселировании называется эффектом Джоуля-Томсона. Для идеального газа эффект Джоуля-Томсона равен нулю. Различают дифференциальный температурный эффект, когда давление и температура изменяются на бесконечно малую величину, и интегральный температурный эффект, при котором давление и температура изменяются на конечную величину.
Дифференциальный температурный эффект обозначается - б:
a = (¶T/¶P)i. (5.15)
Интегральный температурный эффект определяется из следующего уравнения:
DT = T2 – T1 = ò [T·(¶n/¶T)p – n] / cp dP. (5.16)
Для реальных газов DT¹0 и может иметь положительный или отрицательный знак.
Состояние газа, при котором температурный эффект меняет свой знак, называется точкой инверсии, а температура, соответствующая этой точке, называется температуройинверсии- Тинв.
Тинв = n·(¶Т/j¶ n)p. (5.17)
Предыдущая страница | Следующая страница
| Поделиться: |

Свойства реальных газов
Реальные газы отличаются от идеальных газов тем, что молекулы этих газов имеют объемы и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между молекулами. При практических расчетах различных свойств реальных газов наряду с уравнением состояния применяется отношение P·n/(R·T)=c, которая называется коэффициентом сжимаемости.
Так как для идеальных газов при любых условиях P·n = R·T, то для этих газов с = 1. Тогда величина коэффициента сжимаемости выражает отклонение свойств реального газа от свойств идеального. Величина с для реальных газов в зависимости от давления и температуры может принимать значения больше или меньше единицы и только при малых давлениях и высоких температурах она практически равна единице. Тогда реальные газы можно рассматривать как идеальные.
В связи с отличием свойств реального газа от свойств идеального газа нужно иметь новые уравнения состояния, которые связывали бы значения P, х, T и давали бы возможность рассчитывать некоторые свойства газов для разных условий. Были предложены многочисленное число различных уравнений состояния реальных газов, но ни одно из них не решает проблему для общего случая. Развитие кинетической теории газов, позволило установит точное уравнение состояния реальных газов в виде:
P·n = R·[1 - Sn /(n + 1)·Bn / nn]. (6.1)
Bn – вириальные коэффициенты, выражаются через потенциальные энергию взаимодействия молекул данного газа и температуру Т.
Однако это уравнение в общем виде не может быть использовано для непосредственных расчетов реальных газов. Для отдельных частных случаях получены расчетные уравнения того или иного реального газа. Из-за сложности вычисления вириальных коэффициентов обычно ограничиваются расчетом первых двух коэффициентов. Тогда расчетное уравнение имеет вид:
P·n = R·(1 – А/n - B/ n2), (6.2)
где А и В - первый и второй вириальные коэффициенты, являющиеся функцией только температуры.
При расчете свойств многих реальных газов уравнения такого типа получили большое распространение.
Предыдущая страница | Следующая страница
| Поделиться: |

Понятия о водяном паре
Яндекс.Директ  Заявка на карту ТИНЬКОФФ! Кредитная карта Тинькофф с лимитом до 300 т.р! До 55 дней без % + доставка!tinkoff.credit-a.ru
Заявка на карту ТИНЬКОФФ! Кредитная карта Тинькофф с лимитом до 300 т.р! До 55 дней без % + доставка!tinkoff.credit-a.ru
Одним из распространенным рабочим телом в паровых турбинах, паровых машинах, в атомных установках, теплоносителем в различных теплообменниках является водяной пар.
Пар - газообразное тело в состоянии, близкое к кипящей жидкости.
Парообразование – процесс превращения вещества из жидкого состояния в парообразное.
Испарение– парообразование, происходящее всегда при любой температуре с поверхности жидкости.
При некоторой определенной температуре, зависящей от природы жидкости и давления, под которым она находится, начинается парообразование во всей массе жидкости. Этот процесс называется кипением.
Обратный процесс парообразования называется конденсацией. Она также протекает при постоянной температуре.
Процесс перехода твердого вещества непосредственно в пар называется сублимацией. Обратный процесс перехода пара в твердое состояние называется десублимацией.
При испарении жидкости в ограниченном пространстве (в паровых котлах) одновременно происходит обратное явление – конденсация пара. Если скорость конденсации станет равной скорости испарения, то наступает динамическое равновесие. Пар в этом случае имеет максимальную плотность и называется насыщенным паром.
Если температура пара выше температуры насыщенного пара того же давления, то такой пар называется перегретым. Разность между температурой перегретого пара и температурой насыщенного пара того же давления называется степенью перегрева. Так как удельный объем перегретого пара больше удельного объема насыщенного пара, то плотность перегретого пара меньше плотности насыщенного пара. Поэтому перегретый пар является ненасыщенным паром.
В момент испарения последней капли жидкости в ограниченном пространстве без изменения температуры и давления образуется сухой насыщенный пар. Состояние такого пара определяется одним параметром - давлением.
Механическая смесь сухого и мельчайших капелек жидкости называется влажным паром.
Массовая доля сухого пара во влажном паре называется степенью сухости – х.х = mсп / mвп, (6.7)mсп - масса сухого пара во влажном;
mвп - масса влажного пара.
Массовая доля жидкости во влажном паре нызвается степенью влажности – у.у = 1 – n. (6.8)
Для кипящей жидкости при температуре насыщения n = 0, для сухого пара – n = 1.
| Поделиться: |

Тема 9.Теплопроводность
Яндекс.Директ  Заявка на карту ТИНЬКОФФ! Кредитная карта Тинькофф с лимитом до 300 т.р! До 55 дней без % + доставка!tinkoff.credit-a.ru
Заявка на карту ТИНЬКОФФ! Кредитная карта Тинькофф с лимитом до 300 т.р! До 55 дней без % + доставка!tinkoff.credit-a.ru
Закон Ньютона-Рихмана
Яндекс.ДиректЕсли кредит, то в МТС банке! Кредит на любые цели от 17,9%. Акция «Кредитные каникулы». Узнай подробнее.app.mtsbank.ru
|
| Поделиться: |
Последнее изменение этой страницы: 2020-10-24; просмотров: 70; Нарушение авторского права страницы; Мы поможем в написании вашей работы!
infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.240.21 (0.138 с.)