Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приказ МЗ рб №165 от 25. 11. 2002г. МЗ Республики Беларусь
«О проведении дезинфекции и стерилизации учреждениями здравоохранения» 1.Дезинфекция ИМН: определение, методы. Дезинфекция – уничтожение патогенных и условно-патогенных микроорганизмов, вирусов (в т.ч.возбудителей парентеральных вирусных гепатитов, ВИЧ-инфекция), вегетативных бактерий (включая микобактерии туберкулёза), грибов. Дезинфекции подлежат все изделия после применения их у пациентов. После дезинфекции изделия промывают водопроводной водой, высушивают и применяют по назначению или подвергают предстерилизационной очистке (ПСО) и стерилизации. Физический метод дезинфекции: - способом кипячения в дистиллированной воде (30 мин) или в воде с добавлением натрия двууглекислого (сода пищевая) (15 мин.) - изделия из стекла, металлов, термостойких полимерных материалов и резин. Требуется предварительная очистка. Отсчёт времени дезинфекционной выдержки начинают с момента закипания воды. - паровым методом в паровом стерилизатороре (автоклаве) (110 оС, МПа 0,5 кгс/см2), 20 мин - изделия из стекла, металлов, резин, латекса, термостойких полимерных материалов. Предварительная очистка изделий не требуется. Дезинфекция осуществляется воздействием водяного насыщенного пара под избыточным давлением. - воздушным методом – осуществляют изделия из стекла, металлов, силиконовой резины и проводят в открытом виде на полках воздушного стерилизатора. Этим методом можно дезинфицировать только изделия, не загрязненные органическим и веществами (ввиду их пригорания к поверхности изделий). Химический метод дезинфекции является более распространенным и общепринятым методом обеззараживания изделий медназначения в ЛПУ. Дезинфекцию с использованием химических средств проводят способом погружения изделий в раствор сразу после применения, не допуская их подсушивания. Разъёмные изделия дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором. При видимом загрязнении изделий медназначения биологическим субстратами и во избежание снижения эффективности действия рабочих растворов дезсредства рекомендуется проведение предварительного промывания водопроводной водой или раствором дезсредства в специально выделенной ёмкости. Промывные воды дезинфицируются в последующим одним из методов по режиму для вирусных гепатитов. Рекомендуется использовать специальные ёмкости (полимерные контейнеры с крышками, в которых изделия размещают на специальных перфорированных решетках) для удобства дальнейшей обработки.
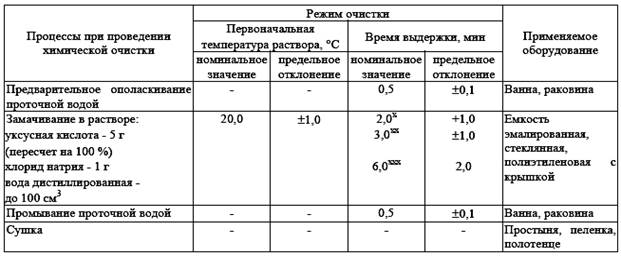
По окончании дезинфекционной выдержки изделия промывают проточной водой. 2. Химическая очистка мединструментария. Химическая очистка хирургических инструментов из нержавеющей стали
х Для скальпелей из нержавеющей стали. хх Для инструментов с наличием оксидной пленки. ххх Для инструментов с сильными коррозионными поражениями, места поражений рекомендуется дополнительно очищать ершом или ватно-марлевым тампоном.
3. Особенности дезинфекции мединструментария, имеющего каналы, полости, оптику.
Каналы и полости изделий заполняют дезинфицирующим раствором. При выборе средств очистки, дезинфекции медицинских изделий с оптикой следует учитывать рекомендации изготовителей, касающиеся воздействия конкретных средств на материалы этих изделий. 4. Режимы дезинфекции при применении различных дезсредств. Для дезинфекции используются средства разрешенные Министерством Здравоохранения Республики Беларусь по прилагаемой инструкции. 5. Предстерилизационная обработка мединструментария: методика приготовления и постановки пробы, контроль качества ПСО. Предстерилизационная очистка проходит поэтапно. 1 этап – замачивание в моющем растворе при полном погружении (температура не менее 20 оС, время – согласно инструкции раствора). 2 этап – мойка в том же растворе, в котором проводили замачивание, при помощи ерша, ватно-марлевого тампона не менее 30 сек. 3 этап – ополаскивание питьевой проточной водой не менее 1 мин. 4 этап – ополаскивание дистиллированной водой – время не нормируется. 5 этап – сушка горячим воздухом (t 85 градусов) до полного исчезновения влаги. Контроль качества ПСО – азопирамовая проба. Перед проверкой качества ПСО обработки материалов раствор Азопирам смешивают с равным количеством 3% перекиси водорода (1:1). Этим раствором обрабатывают исследуемые материалы: протирают тампонами, заполняют шприцы, иглы.
В присутствии следов крови немедленно или не позже, чем через 1 мин., появляется окрашивание, вначале фиолетово-синее, быстро переходящее в сиренево-пурпурное или буроватое. Окрашивание, наступившее позже, чем через 1 мин., не учитывается. Рабочий раствор годен в течение 1-2 часов. Методика приготовления реактивов для постановки пробы Азопирамовая проба. Приготовление исходного раствора. Для приготовления 1 л (куб.дм) исходного раствора азопирама отвешивают 100 г амидопирина и 1,0 - 1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (куб.дм) 95-процентным этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов. Исходный раствор азопирама следует хранить в плотно закрытом флаконе в темноте. Допустимый срок хранения исходного раствора азопирама составляет: при температуре 4 град. C (в холодильнике) - 2 месяца; при комнатной температуре (20 +/- 2 град. C) - не более 1 месяца. Умеренное пожелтение исходного раствора без выпадения осадка в процессе хранения не снижает рабочих свойств раствора. Реактив азопирам можно хранить не более 2 часов. При более длительном стоянии может появиться спонтанное розовое окрашивание реактива. При температуре выше +25 град. C раствор розовеет быстрее, поэтому его необходимо использовать в течение 30 - 40 мин. Не следует подвергать проверке горячие инструменты, а также хранить реактив азопирам на ярком свету и вблизи нагревательных приборов. В случае необходимости пригодность реактива азопирам проверяют следующим образом: 2 - 3 капли реактива наносят на пятно крови. Если не позже чем через 1 мин появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению, если окрашивание в течение 1 мин не появляется, реактивом пользоваться не следует. Методика постановки пробы Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом, или наносят 2 - 3 капли реактива на изделие с помощью пипетки. В шприцы вносят 3 - 4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить реактивом внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь, реактив оставляют в шприце на 1 мин, а затем вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый, не имеющий следов коррозии шприц. Последовательно меняя иглы, через них пропускают реактив, вытесняя 3 - 4 капли на марлевую салфетку. Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделия на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от его величины. Учет результатов постановки пробы При положительной азопирамовой пробе в присутствии следов крови немедленно или не позднее чем через 1 мин появляется вначале фиолетовое, затем быстро, в течение нескольких секунд, переходящее в розово-сиреневое или буроватое окрашивание реактива. Азопирам, кроме гемоглобина, выявляет наличие на изделиях остаточных количеств:
- пероксидаз растительного происхождения (растительных остатков); - окислителей (хлорамина, хлорной извести, стирального порошка с отбеливателем, хромовой смеси для обработки посуды и др.); - ржавчины (окислов и солей железа); - кислот. При наличии на исследуемых изделиях ржавчины и указанных окислителей наблюдается бурое окрашивание реактива, в остальных случаях происходит окрашивание в розово-сиреневый цвет. При постановке азопирамовой пробы окрашивание реактива, наступившее позже чем через 1 мин после постановки пробы, не учитывается. Результаты контроля отражают в журнале по форме N 366/у (табл. 9). Контроль качества предстерилизационной очистки проводят специалисты территориальных санитарно-эпидемиологических учреждений в зависимости от эпидзначимости медучреждения и конкретной эпидситуации. Самоконтроль в ЛПУ проводят: в централизованных стерилизационных (ЦС) ежедневно, в отделениях - не реже 1 раза в неделю; организует и контролирует его старшая медицинская сестра (акушерка) отделения, главная медсестра - 1 раз в месяц. Контролю подлежит: в ЦС - 1% от каждого наименования изделий, обработанных за смену, в отделениях - 1% одновременно обработанных изделий каждого наименования, но не менее 3 единиц. Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой пробы (на наличие остаточных количеств крови).
6. Стерилизация. Методы, режимы стерилизации. Выбор режима стерилизации для различных видов мединструментария. Стерилизация – умерщвление всех патогенных и непатогенных микроорганизмов, в том числе и их споровых форм. Стерилизацию осуществляют физическими (паровой, воздушный, в среде нагретых шариков) и химическими (применение растворов химических средств, газовый) методами. Выбор адекватного метода стерилизации зависит от особенностей стерилизуемых изделий. Стерилизация паровым методом (водяной насыщенный пар под избыточным давлением) 130-134°С. 2,0 20 мин. Изделия из коррозионно-стойких металлов, стекла изделия из текстильных материалов резин, лигатурный шовный материал 120—122°С. 1,1 45 мин. Изделия из резин, отдельных видов пластмасс (полиэтилен высокой плотности, ПВХ-пластикаты), лигатурный шовный материал Стерилизация воздушным методом (сухой горячий воздух) При воздушном методе стерилизации стерилизующим средством является сухой горячий воздух температурой 160°С – 150 мин и 180°С – 60 мин; стерилизацию осуществляют в воздушных стерилизаторах стерилизуют изделия из металла, стекла и резины на основе силиконового каучука.
Стерилизация растворами химических средств. Стерилизация изделий растворами химических средств является вспомогательным методом, поскольку не позволяет простерилизовать их в упаковке, а по окончании стерилизации необходимо промыть изделия стерильной жидкостью (питьевая вода, 0,9% раствор натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению (контаминации) простерилизованных изделий микроорганизмами. Данный метод следует применять для стерилизации изделий, в конструкцию которых входят термолабильные материалы, то есть когда особенности материалов изделий не позволяют использовать другие рекомендуемые методы стерилизации (физические). Конструкция изделия должна позволять стерилизовать его растворами химических средств. При этом необходим хороший доступ стерилизующего средства и промывной жидкости ко всем стерилизуемым поверхностям изделия. Для стерилизации изделий растворами химических средств используют средства, разрешенные к применению для данной цели по режимам согласно инструктивно-методическим документам, утвержденным в установленном порядке Минздравом Республики Беларусь, При стерилизации растворами химических средств используют стерильные емкости из стекла, металлов, термостойких пластмасс, выдерживающих стерилизацию паровым методом, или покрытые эмалью (эмаль без повреждений). Стерилизация газовым методом Для газового метода стерилизации используют смесь ОБ (смесь окиси этилена и бромистого метила в весовом соотношении 1:2,5 соответственно), окись этилена, пары раствора формальдегида в этиловом спирте.
Вопрос 14. Постановление Министерства здравоохранения Республики Беларусь29 декабря 2012 № 217. Требования к проведению санитарно-противоэпидемических мероприятий в межэпидемический и предэпидемический периоды заболеваемости. В межэпидемический период заболеваемости гриппом проводятся следующие мероприятия: 13. 19.1. в организациях здравоохранения: 14. формирование резерва коечного фонда, медицинских работников, необходимых изделий медицинского назначения, составление плана перепрофилирования коек с возможным развертыванием палат интенсивной терапии в перепрофилированных отделениях; 15. проведение расчета необходимого количества лекарственных средств, рентгеновской пленки, средств индивидуальной защиты для медицинских работников, дезинфицирующих средств, диагностических средств; 16. планирование профилактических прививок против гриппа и потребности в противогриппозной вакцине; 17. обучение медицинских работников всех специальностей по вопросам профилактики, диагностики и лечения гриппа, порядку информирования населения в случае возникновения эпидемии; 18. Профилактические прививки против сезонного гриппа проводятся ежегодно в сентябре – ноябре в первую очередь группам высокого риска неблагоприятных последствий заболевания гриппом и группам высокого риска заражения гриппом.
19. Проведение профилактических прививок организовывается на базе прививочных кабинетов организаций здравоохранения. Допускается проведение профилактических прививок в помещениях, организованных как временные прививочные кабинеты и отвечающих всем требованиям, предъявляемым нормативными и техническими нормативными правовыми актами к прививочным кабинетам, а также при наличии возможности соблюдения «холодовой цепи». 20. Организации здравоохранения проводят в установленном порядке информирование населения через средства массовой информации, а также используя иные доступные способы (плакаты, брошюры, листовки, буклеты, видеоматериалы) по вопросам профилактики гриппа. Требования к проведению санитарно-противоэпидемических мероприятий в период эпидемического подъема заболеваемости гриппом. 15 В период эпидемического подъема заболеваемости гриппом проводятся следующие санитарно-противоэпидемические мероприятия: 16 25.1. в организациях здравоохранения: 17 25.1.1. обеспечение эффективной работы вентиляционных систем, соблюдение параметров микроклимата, регулярное проветривание, обеззараживание воздушной среды, проведение влажной уборки помещений с использованием средств дезинфекции, разрешенных в установленном законодательством Республики Беларусь порядке к применению Министерством здравоохранения Республики Беларусь; 18 25.1.2. обеспечение медицинских работников средствами индивидуальной защиты органов дыхания и лекарственными средствами для профилактики гриппа; 19 25.1.3. использование медицинскими работниками противоаэрозольного респиратора (N95, FFP2 или их эквивалент), средств защиты глаз, халата и перчаток при проведении любых процедур, связанных с высоким риском выброса аэрозолей (бронхоскопия, процедуры, связанные с аспирацией дыхательных путей) и работой с пациентами с подозрением на заболевание гриппом, вызванным вирусом с пандемическим потенциалом; 20 25.1.4. использование медицинскими работниками средств индивидуальной защиты органов дыхания (хирургическая маска, респиратор) при оказании медицинской помощи пациентам с симптомами ОРИ (ГПЗ, ТОРИ); 21 25.1.5. проведение анализа заболеваемости ОРИ среди различных возрастных групп населения; 22 25.1.6. поэтапное перепрофилирование организаций здравоохранения для оказания медицинской помощи пациентам в зависимости от интенсивности развития эпидемического процесса гриппа с оперативным информированием ЦГЭ; 23 25.1.7. обеспечение в установленном порядке изоляции выявленных в соматических отделениях пациентов с ОРИ в выделенные для этого палаты, а также выполнения следующих требований: 24 соблюдение пациентами и медицинскими работниками правил личной гигиены, в том числе гигиены рук (мытье водой с мылом или использование антисептика для рук); 25 обязательное наличие у пациентов хирургических или одноразовых масок при нахождении вне палат; 26 проведение чистки и дезинфекции посуды пациентов, оборудования и инвентаря организаций здравоохранения в порядке, установленном законодательством Республики Беларусь; 27 использование медицинскими работниками стандартных мер предосторожности, а также мер, обеспечивающих снижение риска передачи инфекционных агентов при проведении всех действий по оказанию медицинской помощи пациенту, в течение 7 календарных дней после начала заболевания или до тех пор, пока не разрешатся симптомы заболевания; 28 наличие у медицинских работников, обеспечивающих медицинский уход или собирающих клинические образцы от подозрительных или подтвержденных случаев заболевания гриппом, одноразовых нестерильных перчаток, халатов и средств защиты для глаз (защитные очки) с целью предотвращения контакта инфекционного агента со слизистой оболочкой глаз; 29 применение медицинскими работниками респираторов в случае выполнения действий по оказанию медицинской помощи пациентам с подозрением на заболевание гриппом, вызванное вирусом с пандемическим потенциалом, при котором возникает аэрозоль (сбор клинических образцов, эндотрахеальная интубация, обработка распылителя, бронхоскопия и действия по реанимации, при которых используется экстренная интубация или сердечно-легочная реанимация); 30 использование медицинскими работниками, обеспечивающими непосредственное оказание медицинской помощи пациентам с подозрительным или подтвержденным случаем заболевания гриппом, вызванного вирусом с пандемическим потенциалом, респираторов при входе в палату к таким пациентам; 31 25.1.8. ограничение посещения пациентов родственниками при оказании им медицинской помощи в стационарных условиях; Требования к порядку действий медицинских работников при регистрации случая гриппа, вызванного новым вирусом с пандемическим потенциалом. 15 Медицинский работник, выявивший пациента с симптомами гриппа, вызванного вирусом с пандемическим потенциалом: 16 информирует руководителя территориальной организации здравоохранения, а в выходные и праздничные дни – дежурного врача организации здравоохранения, о случае выявления пациента с симптомами гриппа, вызванного вирусом с пандемическим потенциалом; 17 принимает меры личной безопасности при оказании медицинской помощи пациенту; 18 принимает в установленном порядке решение по изоляции, госпитализации, ограничению допуска пациента в организованные коллективы с учетом клинических и эпидемиологических показаний; 19 организовывает сбор и транспортировку биологического материала, взятого у пациента (до начала этиотропной терапии); 20 организует незамедлительную доставку биологического материала, взятого у пациента (в герметически закрывающейся емкости при соблюдении «холодовой цепи» (+(4-8)°С)), в вирусологические лаборатории или в НЦГ; 21 обеспечивает выполнение общего анализа крови, общего анализа мочи, биохимического анализа крови, рентгенографию органов грудной клетки, 3-х часовую термометрию и осмотр кожных покровов у пациента каждые 3 часа с целью дифференциального диагноза и раннего выявления возможной менингококковой инфекции. Дополнительные обследования пациента назначаются в зависимости от особенностей клинического течения заболевания, развившихся осложнений и сопутствующей патологии; 22 определяет тактику оказания медицинской помощи всем группам пациентов согласно клинической картине заболевания. Коррекция оказания медицинской помощи проводится в зависимости от состояния здоровья пациента, развившихся осложнений и сопутствующей патологии; 23 выявляет контактных лиц в очаге заболевания с фиксацией в формах следующих медицинских документов: 24 форма № 025/у-07 «Медицинская карта амбулаторного больного» утвержденная приказом Министерства здравоохранения Республики Беларусь от 30 августа 2007 г. № 710 «Об утверждении форм первичной медицинской документации в амбулаторно-поликлинических организациях»; 25 форма № 003/у-07 «Медицинская карта стационарного пациента», утвержденная приказом Министерства здравоохранения Республики Беларусь от 1 октября 2007 г. № 792 «Об утверждении форм первичной медицинской документации в организациях здравоохранения, оказывающих стационарную помощь»; 26 форма № 112/у «История развития ребенка», утвержденная приказом Министерства здравоохранения Республики Беларусь от 26 сентября 2007 г. № 774 «Об утверждении форм первичной медицинской документации акушерско-гинекологической и педиатрической службы». 27 Сбор, хранение и транспортировка образцов биологического материала осуществляется в соответствии с лабораторным методом диагностики гриппа и других ОРИ. 28 27. Для диагностики, в том числе дифференциальной, гриппа забираются образцы биологического материала в порядке, установленном Министерством здравоохранения Республики Беларусь. 29 28. Выписка реконвалесцентов или перевод пациентов при необходимости в специализированное отделение организации здравоохранения для лечения развившихся осложнений либо сопутствующей патологии допускается не ранее 7 календарных дней с начала течения заболевания. Вопрос 15 Контроль стерилизации. По принципу размещения индикаторов на стерилизуемых объектах различают два типа химических индикаторов: наружные и внутренние: - Наружные индикаторы (ленты, наклейки) крепятся липким слоем на поверхности используемых упаковок (бумага, металл, стекло и т.д.) и удаляются впоследствии. Наружным индикатором могут являться также некоторые упаковочные материалы (например, бумажно-пластиковые мешки, рулоны), содержащие химический индикатор на своей поверхности. - Внутренние индикаторы размещаются внутри упаковки со стерилизуемыми материалами вне зависимости от ее вида (бумажный или пластиковый пакет, металлический контейнер и др.). К ним относятся различные виды бумажных индикаторных полосок, содержащие на своей поверхности индикаторную краску. В зависимости от количества контролируемых параметров стерилизационного цикла различают несколько классов химических индикаторов. Чем выше класс индикатора, тем больше параметров стерилизационного цикла он контролирует и тем выше вероятность получения стерильных материалов при его использовании. Класс 1. Индикаторы процесса стерилизации Наружные индикаторы, предназначенные для использования на индивидуальных упаковках со стерилизуемыми материалами. Результаты расшифровки позволяют сделать, заключение о том, что данная упаковка с инструментом (материалом) прошла стерилизационную обработку выбранным методом и таким образом отличить ее от необработанной. Класс 2. Индикаторы одной переменной По принципу размещения индикаторов на стерилизуемых объектах различают два типа химических индикаторов: наружные и внутренние: - Наружные индикаторы (ленты, наклейки) крепятся липким слоем на поверхности используемых упаковок (бумага, металл, стекло и т.д.) и удаляются впоследствии. Наружным индикатором могут являться также некоторые упаковочные материалы (например, бумажно-пластиковые мешки, рулоны), содержащие химический индикатор на своей поверхности. - Внутренние индикаторы размещаются внутри упаковки со стерилизуемыми материалами вне зависимости от ее вида (бумажный или пластиковый пакет, металлический контейнер и др.). К ним относятся различные виды бумажных индикаторных полосок, содержащие на своей поверхности индикаторную краску. В зависимости от количества контролируемых параметров стерилизационного цикла различают несколько классов химических индикаторов. Чем выше класс индикатора, тем больше параметров стерилизационного цикла он контролирует и тем выше вероятность получения стерильных материалов при его использовании. Класс 1. Индикаторы процесса стерилизации Наружные индикаторы, предназначенные для использования на индивидуальных упаковках со стерилизуемыми материалами. Результаты расшифровки позволяют сделать, заключение о том, что данная упаковка с инструментом (материалом) прошла стерилизационную обработку выбранным методом и таким образом отличить ее от необработанной. Класс 2. Индикаторы одной переменной
8. Упаковка материалов на стерилизацию. Сроки хранения стерильного мединструментария в зависимости от метода стерилизации, вида упаковки.
При стерилизации паровым, воздушным и газовым методами изделия, как правило, стерилизуют упакованными в стерилизационные упаковочные материалы; при паровом методе, кроме того, используют стерилизационные коробки без фильтров и с фильтрами На упаковках с простерилизованными изделиями должны быть сведения о дате стерилизации, на стерилизационных коробках - о датах стерилизации и вскрытия, а также подпись медработника. Для проведения стерилизации могут быть использованы только упаковочные материалы, разрешенные в установленном порядке к промышленному выпуску и применению (в случае импортных материалов - разрешенные к применению) в Республике Беларусь. При воздушном методе, а также в отдельных случаях при паровом и газовом методах допускается стерилизация инструментов в неупакованном виде (в открытых лотках). Применяемые упаковочные материалы для любого метода стерилизации должны обладать следующими характеристиками: - Не влиять на качество стерилизуемых объектов. - Быть проницаемыми для стерилизующих агентов. - Обеспечивать герметичность вплоть до вскрытия упаковки. - Легко вскрываться без нарушения асептики содержимого. Различают следующие виды упаковочного материала, которые могут применяться отдельно или в сочетании друг с другом: бумага, металл, стекло, ткань, пластмасса. Упаковочные материалы делятся на две категории: одноразового использования (бумага, бумажно-пластиковые материалы), многоразового использования (контейнеры). Для обеспечения длительного поддержания стерильности вне зависимости от метода стерилизации рекомендуется применять 2 слоя упаковочного материала (бумага, марля, ткань и т.д.). Бумага для упаковки выпускается двух видов - простая и крепированная. Последняя обладает повышенной прочностью, устойчива к повреждениям, лучше сохраняет форму. Упаковочный материал может выпускаться в виде отдельных листов различных размеров, в виде пакетов или рулонов различной вместимости. Любой вид упаковочного материала должен соответствовать применяемому методу стерилизации и требованиям государственных стандартов. Загрузка стерилизатора должна обеспечивать свободную циркуляцию воздуха вокруг каждой упаковки и не превышать 70% объема камеры. Срок сохранения стерильности изделий, простерилизованных в герметичной упаковке в пергаменте, бумаге мешочной пропитанной, бумаге мешочной влагопрочной, бумаге упаковочной высокопрочной, бумаге крепированной, стерилизационной коробке с фильтром - 20 суток, а в любой негерметичной упаковке и стерилизационной коробке без фильтра - 3 суток. Изделия, простерилизованные без упаковки, помещают на «стерильный стол» и используют в течение одной рабочей смены. Кратность использования пергамента, бумаги мешочной непропитанной, бумаги мешочной влагопрочной и бумаги крепированной - до 2 раз, бумаги упаковочной высокопрочной (крафт) - до 3 раз (с учетом их целостности).
|
|||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 1685; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.187.233 (0.087 с.) |