
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение состояния идеальных газов.
Цель работы: приобрести навыки в использовании уравнения состояния идеальных газов для практических расчетов, определить экспериментально значение газовой постоянная для воздуха.
Методические указания. Математическая связь между параметрами состояния тела называется термическим уравнением состояния. В общем виде такая связь может быть записана уравнением f(p.T.V) = 0. Надо иметь ввиду, что кроме термического уравнения состояния в термодинамике используется еще калорическое уравнение состояния, которое устанавливает математическую зависимость внутренней энергии или энтальпии тела от термических параметров. Для установления математической связи между параметрами необходимо иметь физическую модель. В газообразных телах элементарные частицы (молекулы и атомы), составляющие термодинамическое тело в некотором замкнутом объеме, имеют наибольшее число степеней свободы и совершают хаотичное (Броуновское) движение. При этом они обмениваются энергией (взаимодействуют) друг с другом и поверхностью, ограничивающей объем. Если предположить, что силы межмолекулярного взаимодействия отсутствуют, а сами молекулы не имеют объема и представляют собой материальные точки, то такой газ Основные закономерности, устанавливающие связь между параметрами для различных процессов в идеальных газах были установлены экспериментальным путем такими учеными, как Бойль, Мариотт, Гей-Люссак, Шарль. Ввиду важности полученных ими соотношений эти зависимости получили название "Законы идеальных газов". Обобщение законов идеальных газов было сделано Клапейроном в следующем виде rV¤T=const, const - величина постоянная для данного газа. В дальнейшем ввели обозначение const = R и назвали газовой постоянной. С учетом этого уравнение состояния идеального газа на 1 кг записывается в следующем виде:
где r - абсолютное давление в системе, Па; V - удельный объем системы, м3/кг; Т - абсолютная температура, К; R - газовая постоянная, кДж/кгT. Для идеального газа массой М кг уравнение (2.1.). записывается в виде: где V = v М - объем тела, м3. Величину газовой постоянной R можно вычислить, зная параметры состояния при нормальных условиях (r =101325 Па, Т =273,15 ° С) Учитывая, что объем одного моля любого газа при нормальных условиях равен Vm =m×v=22,413 м3/ кмоль; v = 22,413/m, м3/кг; где m - молекулярная масса газа, кг/кмоль. Подставляя это значение в (2.3.) получим R = 8314 / m.Число 8314 постоянно для всех газов, обозначается Rm = 8314 Дж/ кмоль К и называется универсальной газовой постоянной. С использованием универсальной газовой постоянной уравнение состояния идеальных газов записывается в виде
|
|||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 63; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.183.221 (0.004 с.) |
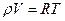 (2.1.)
(2.1.)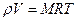 (2.2.)
(2.2.) (2.3.)
(2.3.) (2.4.)
(2.4.)


