
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Реакции с участием кислорода.Стр 1 из 2Следующая ⇒
Лабораторная работа №????? ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Теоретическая часть
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степеней окисления элементов. Окислением называется процесс повышения, а восстановлением – понижения степени окисления. Атом, молекула или ион, в котором степень окисления элемента повышается, называется восстановителем, а в котором понижается – окислителем. Согласно электронной теории (Писаржевский Л.В., 1914), изменение степеней окисления в окислительно-восстановительных реакциях обусловлено отдачей электронов восстановителем и присоединением их окислителем. Окислителями являются простые вещества – неметаллы (галогены, кислород, сера и др.), а также кислоты и соли, в которых центральный атом имеет высшую степень окисления (HNO3, HClO3, КNO3, КClO3, KMnO4, K2Cr2O7, и др.). Восстановителями являются металлы, некоторые неметаллы (водород, углерод, кремний) и соединения, в которых имеется атом в низшей степени окисления (H2S, NH3, НCl, КBr, КI, FeSO4, SnCl2 и др.). Вещества, содержащие атомы в промежуточной степени окисления, могут быть как окислителями, так и восстановителями в зависимости от «партнера» и условий проведения реакции. О таких веществах говорят, что они обладают окислительно-восстановительной двойственностью; к ним относятся нитриты, сульфиты, MnO2 и др. Различают четыре типа окислительно-восстановительных реакций. 1. Межмолекулярное окисление-восстановление. Это реакции, в которых окислитель и восстановитель являются разными веществами, например:
2. Внутримолекулярное окисление-восстановление. Это реакции, которые протекают с изменением степеней окисления атомов разных элементов, входящих в состав одного и того же вещества, например:
3. Диспропорционирование. Это реакции, в которых происходит увеличение и уменьшение степени окисления одного и того же элемента (окислителем и восстановителем является одно и то же вещество):
4. Контрдиспропорционирование. Это реакции, в которых участвуют два вещества с атомами одного и того же элемента в разных степенях окисления:
Определение стехиометрических коэффициентов перед веществами в реакциях окисления-восстановления проводят двумя методами: электронного баланса и полуреакций. Метод электронного баланса В этом методе сущность окислительно-восстановительных процессов выражают электронными схемами. Например, для реакции: NaNO2 + KMnO4 + H2SO4 ® NaNO3 + K2SO4 + MnSO4 + H2O электронные схемы имеют вид:
Цифры 5 и 2 – множители, которые являются коэффициентами при формулах восстановителя (нитрита натрия) и окислителя (перманганата калия). Подставив их в левую и правую части схемы и учитывая, что на связь с ионами K+ и Mn2+ расходуется 3 моль H2SO4, получают уравнение: NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O Метод полуреакций Этот метод используется для реакций в растворах электролитов. Он основан на составлении уравнений двух полуреакций (отдельно для процессов окисления и восстановления) с их последующим суммированием. В уравнениях полуреакций должны выполняться законы сохранения вещества (сумма атомов в левой и правой частях должна быть одинаковой) и сохранения энергии (суммарный заряд всех частиц в левой и правой частях должен быть одинаковым). Например, для реакции: NaNO2 + KMnO4 + H2SO4 ® NaNO3 + K2SO4 + MnSO4 + H2O вначале необходимо составить схему реакции в ионном виде:
а затем записать полуреакции отдельно для процессов окисления и восстановления:
Помножив полуреакцию окисления на число 5, а полуреакцию восстановления на число 2 (при этом уравнивается и сокращается число электронов), производим их сложение:
Сократив подобные, получаем ионное уравнение:
в соответствии с которым молекулярное уравнение реакции имеет вид: 5NaNO2 + 2KMnO4 + 3H2SO4 ® 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O Полуреакции имеются в справочниках, но их обычно составляют самостоятельно, руководствуясь следующими правилами:
1. В кислой среде восстановитель присоединяет атомы кислорода от воды, при этом образуются H+ – катионы; окислитель, наоборот, отдает атомы кислорода катионам водорода, при этом образуется вода. 2. В нейтральной и щелочной средах восстановитель присоединяет атомы кислорода от OH– – ионов (один атом от двух ионов), при этом образуется вода; окислитель, наоборот, отдает атомы кислорода молекулам воды, при этом образуются OH– – ионы (два иона из одной молекулы).
Вопросы к допуску
1. дать определение окислительно-восстановительной реакции. 2. Назвать виды окислительно-восстановительных реакций. 3. Сформулировать правила составления (на примере K2Cr2O7) полуреакции восстановления в кислой, щелочной и нейтральной средах. 4. Определите стехиометрические коэффициенты в реакциях: H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O FeSO4 + K2Cr2O7 + H2SO4 = Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O Укажите в них окислитель, восстановитель и среду. Экспериментальная часть Лабораторная работа №???? Скорость химических реакций. Химическое равновесие. Катализ
Теоретическая часть Под скоростью химической реакции (V) понимают изменение концентрации вещества (С) за единицу времени (t): V = V = Знак определяется направлением изменения концентраций вещества: плюс означает ее увеличение (для продуктов), минус – уменьшение (для исходных веществ). Скорость химической реакции зависит от природы веществ, концентрации реагентов, температуры, наличия катализатора (ингибитора), для гетерогенных реакций – от поверхности раздела фаз. Закон действия масс. Н. Н. Бекетов (1862 г.) впервые установил влияние концентрации реагирующих веществ на скорость химического процесса и на его направление. Позднее (1867 г.) норвежские ученые Гульдберг и Вааге сформулировали это положение в более общей форме: СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ ПРЯМО ПРОПОРЦИОНАЛЬНА ПРОИЗВЕДЕНИЮ КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ (закон действия масс). Если в реакцию вступают два вещества А и В (nА + mВ = рС), то математическое выражение закона действия масс данной реакции будет: V = k·[A]n·[B]m, где V – скорость реакции, [А] и [В] – молярные концентрации вещества А и В, k – константа скорости реакции, n и m – частные кинетические порядки реакции по исходным веществам A и B, соответственно. Пример: 2NO + O2 = 2NO2, V = k [NO]2·[O2] = k·РNO2·Р Константа скорости k не зависит от концентрации реагирующих веществ, но зависит от их природы и от температуры. Ее численное значение равно скорости реакции при условии, если концентрации реагирующих веществ равны единице. Закон справедлив для элементарных реакций, протекающих в одну стадию. Для газов вместо концентраций можно использовать парциальные давления. Большинство химических реакций протекает в несколько элементарных стадий, скорость которых различна. Общая скорость реакции определяется лимитирующей стадией. Для ряда химических реакций может быть несколько лимитирующих стадий. Порядок химической реакции по данному веществу – показатель степени концентрации вещества в кинетическом уравнении реакции. Различают частный и общий порядок реакции. Общий порядок реакции (р) равен сумме показателей степеней (в данном случае n + m = p), в которых концентрации исходных веществ входят в кинетическое уравнение скорости реакции.
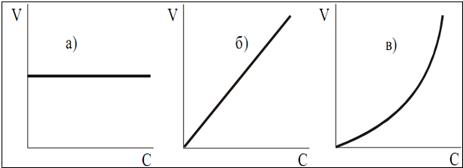
Существуют реакции нулевого (p = 0), первого (p = 1), второго (p = 2) и третьего (p = 3) порядка. Для простых реакций частные порядки совпадают со стехиометрическими коэффициентами перед веществами в химическом уравнении реакции, а общий порядок равен сумме коэффициентов в левой части уравнения реакции. Для сложной реакции общий кинетический порядок не совпадает со стехиометрическими коэффициентами перед веществами, но совпадает с порядком ее лимитирующей стадии. Иногда порядок сложной реакции выражается не целым, а дробным числом. Кинетический порядок реакции определяют экспериментально, обычно графическим методом. В реакциях нулевого порядка скорость реакции остается постоянной. График экспериментальных данных для такой реакции в координатах V(скорость) – концентрация (C) представляет прямую линию, параллельную оси абсцисс (рис. 18 а). В реакциях первого порядка скорость реакции увеличивается пропорционально концентрации (рис. 18 б). В реакциях, порядок которых больше единицы, между V и C наблюдается экспоненциальная зависимость (рис. 18 в). Химические реакции можно классифицировать по числу молекул, участвующих в каждом элементарном химическом акте. Различают: мономолекулярные (превращение одной молекулы), бимолекулярные (соударяются две молекулы), тримолекулярные (при столкновении трех молекул).
Рис. 18. Зависимость скорости (V) от концентрации (C) в реакциях нулевого (а), первого (б) и второго (в) порядка.
Скорость химических реакций в гетерогенных системах. Закономерности, определяющие течение реакции в гомогенных системах, распространяются на гетерогенные системы не в полной мере. Например, в гетерогенной системе газ – твердое тело столкновение между молекулами газа и твердого вещества может происходить лишь на поверхности раздела фаз. Таким образом, концентрация твердого вещества в целом (масса твердой фазы) не влияет на скорость реакции. При восстановлении оксида железа (II) водородом: FeO + H2 = Fe + H2O скорость пропорциональна только концентрации водорода, т. е. V = k·[H2]. В гетерогенных системах реакция происходит на поверхности раздела фаз, поэтому, чем больше поверхность соприкосновения, тем больше скорость реакции. Вот почему твердые вещества значительно быстрее реагируют в измельченном состоянии.
Влияние температуры на скорость реакции. С увеличением температуры скорость реакции возрастает, так как при поглощении энергии ослабляется прочность химической связи. Следовательно, возрастает число столкновений активных молекул в единицу времени. Эмпирическое правило Вант-Гоффа: при повышении температуры на каждые 10ºС скорость реакции возрастает в 2–4 раза, g = Число, показывающее во сколько раз увеличивается скорость данной реакции при повышении температуры на 10ºС, называется ТЕМПЕРАТУРНЫМ КОЭФФИЦИЕНТОМ РЕАКЦИИ γ. Так, для случая, когда температурный коэффициент равен двум (γ = 2), математическое выражение зависимости скорости реакции от температуры имеет следующий вид: Vk = Vн·2n, где Vk – скорость реакции при любой конечной (заданной) температуре, Vн – начальная скорость, n – количество градусов, на которое изменилась температура.
Увеличение скорости реакции с повышением температуры объясняется увеличением числа активных молекул, энергии которых достаточно для осуществления химической реакции. Эту энергию называют энергией активации (Еа). Иногда Еа называют энергетическим барьером. Зависимость константы скорости от температуры выражается уравнением Аррениуса: k = k0·е-Еа/RT, где k0 – предэкспоненциальный множитель, учитывающий общее число столкновений, пространственный фактор, е-Ea/RT – указывает долю столкновений между активными молекулами с энергией большей или равной Еа. Энергия активации Ea и множитель k0 (его называют предэкспоненциальным множителем) являются постоянными величинами, характеризующими данную реакцию; в отличие от константы скорости k, они не зависят от температуры. Энергию активации можно найти, если измерить константу скорости реакции при двух температурах T1 и T2. При вычислении энергии активации потребуются не абсолютные значения константы скорости, а их отношение (k2: k1). Это то же самое, что отношение скоростей реакции при двух температурах (V2: V1) или отношение времени протекания реакции при T1 к ее времени при T2 (τ1: τ2), так как все эти отношения равны между собой: k2: k1 = V2: V1 = τ1: τ2. Формулу для вычисления энергии активации можно получить, если записать уравнение Аррениуса два раза – для температур T1 и T2:
разделить второе уравнение на первое, прологарифмировать полученное уравнение. После преобразования получается формула:
Пример 1. Во сколько раз увеличится константа скорости химической реакции при повышении температуры на 40ºС, если γ равен 3,2? Решение. Согласно правилу Вант-Гоффа:
Влияние катализатора на скорость химической реакции. Влияние катализатора на скорость химической реакции связано с изменением величины энергии активации. Катализаторами называются вещества, изменяющие скорость химических реакций. Катализаторами могут быть твердые, жидкие и газообразные вещества, состав и количество которых к концу реакции остается без изменения. Одни катализаторы сильно ускоряют реакцию – положительный катализ, или просто катализ, другие – замедляют – отрицательный катализ (их называют ингибиторами). Сам катализатор в реакциях не расходуется и в конечные продукты не входит.
Различают два вида катализа – гомогенный (однородный) и гетерогенный (неоднородный) катализ. Химическое равновесие. Все химические реакции можно разделить на необратимые и обратимые. Обратимыми называются реакции, протекающие одновременно в двух противоположных направлениях; необратимыми – реакции, протекающие практически до конца в одном направлении. Число необратимых реакций ограничено: большинство реакций в той или иной мере обратимы. В случае обратимого химического процесса nA + mB Û pC + qD скорость прямой реакции (слева направо), по закону действующих масс, выразится уравнением: V1 = k1·[A]n·[B]m. Скорость обратной реакции (справа налево) выразится уравнением: V2 = k2·[C]p·[D]q. При установлении химического равновесия скорости прямой и обратной реакции равны: V1 = V2 или k1·[A]n·[B]m = k2·[C]p·[D]q, откуда следует:
Заменяя отношение двух постоянных величин
Приведенное выражение является уравнением химического равновесия. Оно показывает, что при обратимых реакциях равновесие устанавливается, когда отношение произведения концентраций образующихся веществ к произведению концентраций взятых веществ становится равным некоторой постоянной величине К. Величина К называется константой химического равновесия и представляет характерную для каждой обратимой реакции величину, которая определяется природой реагирующих веществ, не зависит oт концентраций, но зависит от температуры.
Пример 2. Напишите выражение скорости химической реакции, протекающей в гомогенной системе по уравнению А + 2В = АВ2 и определите, во сколько раз увеличится скорость этой реакции, если: а) концентрацию А увеличить в два раза; б) концентрацию В увеличить в два раза; с) концентрацию А и В увеличить в два раза. Решение. Согласно закону действующих масс, скорость реакции равна: V = k·CA·CB2, после увеличения концентрации А в два раза:V1 = k·2CA·CB2, поэтому V1/V = 2, т. е. скорость реакции возрастет в два раза; после увеличения концентрации В в два раза: V2=k·CA·(2CB)2, поэтому V2/V = 4, т. е. скорость реакции возрастет в четыре раза; после увеличения концентраций А и В в два раза: V3 = k·2CA·(2CB)2, поэтому V3/V = 8, т. е. скорость реакции возрастет в восемь раз. Ответ: а) в два раза, б) в четыре раза, в) в восемь раз.
Смещение химического равновесия. Состояние химического равновесия в основном зависит от трех величин: а) концентрации реагирующих веществ, б) температуры и в) давления, если в реакции участвуют газы. При изменении хотя бы одной из указанных величин химическое равновесие, которое всегда является подвижным, нарушается, и концентрации всех участвующих в реакции веществ начинают изменяться. Изменение концентрации продолжается до тех пор, пока отношение произведений образующихся веществ к произведению концентраций, вступивших в реакцию, не станет равно константе равновесия данной реакции при данной температуре, т. е. пока скорости и прямой и обратной реакции не сравняются. Тогда снова установится равновесие, но уже при иных, чем раньше, концентрациях веществ. Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом увеличивается концентрация веществ, обозначенных в правой части уравнения, то говорят, что равновесие смещено вправо; при увеличении концентрации веществ, обозначенных в левой части уравнения, говорят о смещении равновесия влево. Направление, в котором смещается равновесие, определяется следующим правилом (принцип Ле-Шателье, 1884 г.). Если изменить одно из условий, при которых система находится в состоянии химического равновесия, например, концентрацию какого-либо из реагирующих веществ или температуру, или давление, то равновесие смещается в направлении тойреакции, которая противодействует произведенному изменению («Природа препятствует вмешательству»). Для примера рассмотрим равновесную газовую систему: N2 + 3H2 Û 2NH3 + Q. Согласно принципу Ле-Шателье, уменьшение концентрации одного из компонентов вызовет сдвиг химического равновесия в сторону образования этого компонента. Уменьшение концентрации азота или водорода в приведенной системе вызовет смещение равновесия в сторону диссоциации аммиака и наоборот. При повышении температуры в сторону эндотермического процесса (в данном примере – обратной реакции), при понижении температуры – в сторону экзотермического процесса (в примере – прямой реакции). При увеличении давления равновесие смещается в сторону реакции, приводящей к образованию меньшего числа молекул газа, а следовательно, и меньшего объема (в примере – в сторону прямой реакции). Катализаторы изменяют в равной мере скорость прямого и обратного процессов, способствуют скорейшему установлению равновесия в системе, не оказывая, однако, какого-либо влияния на состояние равновесия. Пример 3. Исходные концентрации веществ А2 и В2 соответственно равны 0,2 и 0,4 моль/л. Константа равновесия гомогенной реакции А2 + В2 Û 2АВ при определенной температуре равна 16. Определите равновесные концентрации компонентов системы и выход вещества АВ (в %). Решение. Обозначим уменьшение концентраций А2 и В2 к моменту равновесия х моль/л; тогда равновесные концентрации [A2] = 0,2 – x; [B2] = 0,4 – x; [AB] = 2x моль/л,
где х1 = 0,169 моль/л; х2 = 0,630 моль/л (не имеет смысла, т. к. это значение больше исходных концентраций). Следовательно [A2] = 0,2 – 0,169 = 0,031 моль/л; [B2] = 0,4 – 0,169 = 0,231 моль/л; [AB] = 2·0,169 = 0,338 моль/л. Если бы реакция была необратима, то АВ (считаем по недостатку вещества А2) получилось бы 0,4 моль/л. Выход вещества АВ: Ответ: [A2] = 0,031; [B2] = 0,231; [AB] = 0,338 моль/л; 84,5 %.
ВОПРОСЫ К ДОПУСКУ
1. Что понимают под скоростью химических реакций? 2. Какие факторы влияют на скорость химических реакций? 3. В чем различие гомогенных и гетерогенных химических процессов? 4. Сформулируйте закон действия масс. 5. Как скорость химических реакций зависит от температуры? Что такое температурный коэффициент химической реакции? Как он рассчитывается? 6. Что такое константа скорости химической реакции? 7. Расскажите порядок выполнения каждого из опытов. 8. Написать уравнения следующих реакций и указать, какие из них обратимые и почему: а) азотистый кальций + хлористый барий; б) сернокислый магний + хлористый барий; в) азотный калий + хлористый натрий.
Экспериментальная часть Лабораторная работа №????? ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Теоретическая часть
Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степеней окисления элементов. Окислением называется процесс повышения, а восстановлением – понижения степени окисления. Атом, молекула или ион, в котором степень окисления элемента повышается, называется восстановителем, а в котором понижается – окислителем. Согласно электронной теории (Писаржевский Л.В., 1914), изменение степеней окисления в окислительно-восстановительных реакциях обусловлено отдачей электронов восстановителем и присоединением их окислителем. Окислителями являются простые вещества – неметаллы (галогены, кислород, сера и др.), а также кислоты и соли, в которых центральный атом имеет высшую степень окисления (HNO3, HClO3, КNO3, КClO3, KMnO4, K2Cr2O7, и др.). Восстановителями являются металлы, некоторые неметаллы (водород, углерод, кремний) и соединения, в которых имеется атом в низшей степени окисления (H2S, NH3, НCl, КBr, КI, FeSO4, SnCl2 и др.). Вещества, содержащие атомы в промежуточной степени окисления, могут быть как окислителями, так и восстановителями в зависимости от «партнера» и условий проведения реакции. О таких веществах говорят, что они обладают окислительно-восстановительной двойственностью; к ним относятся нитриты, сульфиты, MnO2 и др. Различают четыре типа окислительно-восстановительных реакций. 1. Межмолекулярное окисление-восстановление. Это реакции, в которых окислитель и восстановитель являются разными веществами, например:
2. Внутримолекулярное окисление-восстановление. Это реакции, которые протекают с изменением степеней окисления атомов разных элементов, входящих в состав одного и того же вещества, например:
3. Диспропорционирование. Это реакции, в которых происходит увеличение и уменьшение степени окисления одного и того же элемента (окислителем и восстановителем является одно и то же вещество):
4. Контрдиспропорционирование. Это реакции, в которых участвуют два вещества с атомами одного и того же элемента в разных степенях окисления:
Определение стехиометрических коэффициентов перед веществами в реакциях окисления-восстановления проводят двумя методами: электронного баланса и полуреакций. Метод электронного баланса В этом методе сущность окислительно-восстановительных процессов выражают электронными схемами. Например, для реакции: NaNO2 + KMnO4 + H2SO4 ® NaNO3 + K2SO4 + MnSO4 + H2O электронные схемы имеют вид:
Цифры 5 и 2 – множители, которые являются коэффициентами при формулах восстановителя (нитрита натрия) и окислителя (перманганата калия). Подставив их в левую и правую части схемы и учитывая, что на связь с ионами K+ и Mn2+ расходуется 3 моль H2SO4, получают уравнение: NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O Метод полуреакций Этот метод используется для реакций в растворах электролитов. Он основан на составлении уравнений двух полуреакций (отдельно для процессов окисления и восстановления) с их последующим суммированием. В уравнениях полуреакций должны выполняться законы сохранения вещества (сумма атомов в левой и правой частях должна быть одинаковой) и сохранения энергии (суммарный заряд всех частиц в левой и правой частях должен быть одинаковым). Например, для реакции: NaNO2 + KMnO4 + H2SO4 ® NaNO3 + K2SO4 + MnSO4 + H2O вначале необходимо составить схему реакции в ионном виде:
а затем записать полуреакции отдельно для процессов окисления и восстановления:
Помножив полуреакцию окисления на число 5, а полуреакцию восстановления на число 2 (при этом уравнивается и сокращается число электронов), производим их сложение:
Сократив подобные, получаем ионное уравнение:
в соответствии с которым молекулярное уравнение реакции имеет вид: 5NaNO2 + 2KMnO4 + 3H2SO4 ® 5NaNO3 + K2SO4 + 2MnSO4 + 3H2O Полуреакции имеются в справочниках, но их обычно составляют самостоятельно, руководствуясь следующими правилами: 1. В кислой среде восстановитель присоединяет атомы кислорода от воды, при этом образуются H+ – катионы; окислитель, наоборот, отдает атомы кислорода катионам водорода, при этом образуется вода. 2. В нейтральной и щелочной средах восстановитель присоединяет атомы кислорода от OH– – ионов (один атом от двух ионов), при этом образуется вода; окислитель, наоборот, отдает атомы кислорода молекулам воды, при этом образуются OH– – ионы (два иона из одной молекулы).
Вопросы к допуску
1. дать определение окислительно-восстановительной реакции. 2. Назвать виды окислительно-восстановительных реакций. 3. Сформулировать правила составления (на примере K2Cr2O7) полуреакции восстановления в кислой, щелочной и нейтральной средах. 4. Определите стехиометрические коэффициенты в реакциях: H2S + KMnO4 + H2SO4 = S + MnSO4 + K2SO4 + H2O FeSO4 + K2Cr2O7 + H2SO4 = Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O MnO2 + KClO3 + KOH = K2MnO4 + KCl + H2O Укажите в них окислитель, восстановитель и среду. Экспериментальная часть Опыт 1. Реакции с участием кислорода. Взять две пробирки. В одну поместить микрошпатель сульфата железа (II), в другую 2–3 капли раствора сульфата марганца (II). Сульфат железа растворить в воде, затем в обе пробирки ввести раствор щелочи. При встряхивании пробирок осадки темнеют. Почему? Написать уравнения реакций получения гидроксидов железа (II) и марганца (II), их последующего окисления кислородом воздуха (в присутствии воды в качестве среды) до Fe(OH)3 и Mn(OH)4. Коэффициенты в окислительно-восстановительных реакциях подобрать методом электронного баланса. Отметить цвет осадков Fe(OH)2 и Fe(OH)3; Mn(OH)2 и Mn(OH)4. Сделать вывод о роли кислорода, Fe(OH)2 и Mn(OH)2 в этих реакциях.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 401; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.8.247 (0.133 с.) |
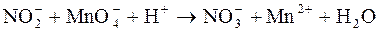 ,
,


 ,
,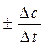 , моль/л·сек (средняя скорость за промежуток времени Dt),
, моль/л·сек (средняя скорость за промежуток времени Dt),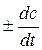 , моль/л·сек (истинная скорость в момент времени t).
, моль/л·сек (истинная скорость в момент времени t). .
.
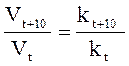 = 2 ¸ 4.
= 2 ¸ 4.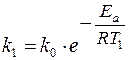 и
и
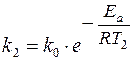
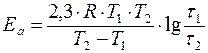
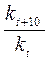 = γ Dt/10,
= γ Dt/10,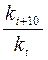 = 3,240/10 = 3,24 = 105.
= 3,240/10 = 3,24 = 105. Ответ: в 105 раз.
Ответ: в 105 раз.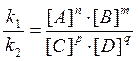 .
.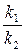 постоянной величиной К, получим:
постоянной величиной К, получим: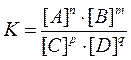 .
.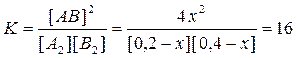 ,
,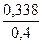 · 100 % = 84,5 %.
· 100 % = 84,5 %.


