Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
По учебной (технологической) практике по микробиологии и вирусологииСтр 1 из 15Следующая ⇒
ОТЧЕТ По учебной (технологической) практике по микробиологии и вирусологии ________________________ ГБУ БашНПВЛ ________________________ (место прохождения практики, название хозяйства или гос. предприятия, район) Казанцева Мария Олеговна (фамилия, имя, отчество) «К защите допускаю» Руководитель: д-р биол. наук, профессор Андреева А.В. (ученая степень, звание, Ф.И.О.) __________________________ (подпись) «___» ___________ 2019 г. Оценка при защите:
__________________________
__________________________ (подпись) «___»__________ 2019 г.
Уфа – 2019
Оглавление
1 Ознакомление с помещением и оборудованием ветеринарной лаборатории. Техника безопасности. Документация. 3 2 Подготовка лабораторной посуды к работе. Приготовление питательных сред и дополнительных растворов. 10 3 Освоение микроскопических методов исследования. 15 4 Участие в бактериологических и вирусологических исследованиях. 19 5 Кормление и уход за лабораторными животными. Биопроба. Аллергическая проба. 23 6 Проведение серологического анализа. 28 7 Способы взятия патматериала у животного при подозрении на бактериальную инфекцию.. 30 8 Способы взятия патматериала у животного при подозрении на вирусную инфекцию.. 34 9 Способы взятия крови для серологических исследований. 36 10 Методы консервирования, упаковки и транспортировки патматериала. 40 11 Сопроводительная документация к патматериалу. Методы дезинфекции. 45 Библиографический список. 49 Дневник. 50
Ознакомление с помещением и оборудованием ветеринарной лаборатории. Техника безопасности. Документация Подготовка лабораторной посуды к работе. Приготовление питательных сред и дополнительных растворов Для работы в бактериологической лаборатории используют лабораторную посуду: Чашки Петри, пробирки различного размера, пастеровские пипетки, колбы, бактериологические петли, инструменты, предметные и покровные стекла, карандаш по стеклу (стеклограф), стерилизаторы, дистилляторы и т. п. Посуду моют в специально оборудованных мойках. Новую посуду кипятят в 1 %-ном растворе пищевой соды или мыльной воде в течение 15-20 мин, промывают водой, помещают на несколько часов в слабый раствор соляной кислоты, затем тщательно ополаскивают дистиллированной водой. Посуду, бывшую в употреблении, выдерживают в течение 2 ч в смеси серной кислоты с дихроматом калия (100 частей кислоты, 50 частей дихромата калия на 1000 частей воды), затем моют ершами в горячей воде, кипятят в мыльной воде или в 1 %-ном растворе гидрокарбоната натрия и тщательно прополаскивают. Вымытую посуду помещают в сушильный шкаф. Предметные стекла после мойки протирают чистой полотняной салфеткой и хранят в склянках с притертой пробкой в смеси спирта и эфира или хорошо завернутыми в чистую бумагу.
Посуду для стерилизации готовят следующим способом. Пробирки, колбы закрывают ватно-марлевыми пробками, завертывают по 10 – 15 шт. в бумагу. На колбы надевают бумажные колпачки, перевязывают от попадания пыли. В один конец градуированных пипеток вставляют ватный тампон, затем вращательным движением обматывают длинной тонкой полоской бумаги шириной 4-5 см. При этом концы пипеток должны быть тщательно завернуты бумагой. В концы пастеровских пипеток вставляют ватные тампоны, а затем по несколько штук завертывают в бумагу или помещают в специальные пеналы. Чашки Петри завертывают по 3-4 шт. в бумагу и стерилизуют в сушильном шкафу или в автоклаве. Колбы и пробирки, закрытые ватно-марлевыми пробками, мясопептонного бульона, агара и других сред помещают в стерилизующий аппарат. Лабораторную посуду, питательные среды и другие материалы стерилизуют. Оборудование для ветеринарной лаборатории включает весь арсенал технических средств, применяемых для проведения анализов, изучения биофизиологических и биохимических процессов в организме животного, разработки и испытания новых ветеринарных препаратов. Перечень исследований, проводимых современными ветеринарными лабораториями, многообразен и включает все виды биохимического, бактериологического, серологического, цитологического, гормонального, патоморфологического анализа. Возможности ветеринарии сегодня охватывают гематологию, иммунологию, иммунохимию, коагулологию, гистологию и многие другие научные направления.
Биологические объекты отличаются сложной многокомпонентной структурой, элементы которой могут никак не проявлять себя в нормальных условиях из-за малого размера или нейтральных химических свойств. Для определения состава биопроб применяют оптические устройства (микроскопы) и аналитическое оборудование, позволяющее исследовать свойства крови, мочи, образцов тканей, других биоматериалов на микроуровне. Наиболее информативный лабораторный метод в ветеринарии – анализы крови (общий клинический, биохимический, на содержание гормонов). Ещё не так давно для выявления отклонений в составе важнейшей физиологической жидкости исследователям приходилось большинство манипуляций выполнять вручную, в результате чего процесс изучения проб занимал много времени. Сегодня данные манипуляции проводятся с помощью автоматических анализаторов крови разного назначения (биохимических, гематологических, гормональных). В результате стало возможным быстрое получение полной и достоверной диагностической информации о количественном и качественном составе крови, наличии кровепаразитов, активности ферментов, электролитной структуре, содержании гормонов, реакции на аллергены, на основе которой исследователь может сделать вывод об общем состояния животного, предположить поражения внутренних органов, оценить степень патологических изменений. Без применения специальной аппаратуры не обходится и такой распространенный вид лабораторной деятельности, как изучение мочи. Специальные анализаторы позволяют выявить присутствие в моче кристаллов мочевой кислоты, трипельфосфатов, оксалатов кальция. Для визуального изучения структуры осадка используются микроскопы. Полученные данные помогают диагностировать непроходимость мочевыводящих протоков, мочекаменную болезнь, почечную недостаточность и другие нарушения функции мочевыделения. Специальная аппаратура применяется и при проведении микробиологических испытаний – бактериологического (для определения бактериального статуса организма, выявления патогенных бактерий-возбудителей) и микологического анализа (для обнаружения грибков-паразитов). При этом используются преимущественно визуальные методы (микроскопия) и инструменты титрования. Новейшие модели титраторов позволяют оценить чувствительность возбудителя к ряду антибиотиков и выбрать наиболее эффективный вариант лечения. Для выполнения гистологических исследований применяют специальное оборудование для изготовления и обработки образцов тканей: микротомы и криостаты, автоматы для парафиновой заливки и окрашивания препаратов, устройства гистологической проводки. С появлением мобильных лабораторно-диагностических комплексов стало возможным проведение выездных исследований, что очень удобно для обслуживания ферм и племенных хозяйств. Кроме аналитических технических средств, ветеринарная лаборатория нуждается в качественных источниках освещения, бактерицидных лампах и функциональной мебели: рабочих столах и тумбах разного назначения, штативах, шкафах для посуды и инструмента, дезинфекционном и стерилизующем оборудовании, сухожаровых шкафах и автоклавах. Лабораторный анализ – основной источник диагностической информации в ветеринарии, необходимое условие для постановки верного диагноза и назначения адекватной терапии. Надёжное сертифицированное ветеринарное оборудование и функциональная мебель, адаптированная к специфике деятельности ветеринарной лаборатории, являются залогом высокой объективности, точности и достоверности результатов проводимых исследований [6].
Иммерсионная микроскопия Применяется для увеличения разрешающей способности метода световой микроскопии. Разрешающая способность системы светооптической микроскопии определяется длиной волны видимого света и числовой апертурой системы. Числовая апертура показывает величину угла максимального конуса света, попадающего в объектив, и зависит от оптических свойств (преломляющей способности) среды между объектом и линзой объектива. Погружение объектива в среду (минеральное масло, вода), имеющую высокий коэффициент преломления, близкий к таковому стекла, препятствует рассеянию света от объекта. Таким образом, достигается увеличение числовой апертуры и соответственно разрешающей способности. Для иммерсионной микроскопии применяют специальные иммерсионные объективы, снабженные меткой (МИ — масляная иммерсия, ВИ — водная иммерсия). Предельная разрешающая способность иммерсионного микроскопа не превышает 0,2 мкм. Общее увеличение микроскопа определяется произведением увеличения объектива на увеличение окуляра. Например, увеличение микроскопа с иммерсионным объективом 90 и окуляром 10 составляет: 90*10 = 900. Микроскопия в проходящем свете (светлопольная микроскопия) используется для изучения окрашенных объектов в фиксированных препаратах. Темнопольная микроскопия. Применяется для прижизненного изучения микробов в нативных неокрашенных препаратах. Микроскопия в темном поле зрения основана на явлении дифракции света при боковом освещении частиц, взвешенных в жидкости (эффект Тиндаля). Эффект достигается с помощью параболоид- или кардиоид-конденсора, которые заменяют обычный конденсор в биологическом микроскопе. При этом способе освещения в объектив попадают только лучи, отраженные от поверхности объекта. В результате на темном фоне (неосвещенном поле зрения) видны ярко светящиеся частицы. Фазово-контрастная микроскопия. Предназначена для изучения нативных препаратов. Фазово-контрастное приспособление дает возможность увидеть в микроскоп прозрачные объекты. Свет проходит через различные биологические структуры с разной скоростью, которая зависит от оптической плотности объекта. В результате возникает изменение фазы световой волны, не воспринимаемое глазом. Фазовое устройство, включающее особые конденсор и объектив, обеспечивает преобразование изменений фазы световой волны в видимые изменения амплитуды. Таким образом достигается усиление различия в оптической плотности объектов. Они приобретают высокую контрастность, которая может быть позитивной или негативной. Позитивным фазовым контрастом называют темное изображение объекта в светлом поле зрения, негативным — светлое изображение объекта на темном фоне.
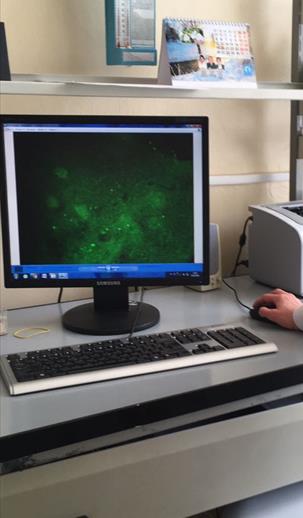
Для фазово-контрастной микроскопии используют обычный микроскоп и дополнительное фазово-контрастное устройство КФ-1 или КФ-4, а также специальные осветители. Люминесцентная (или флуоресцентная) микроскопия (рис. 8). Основана на явлении фотолюминесценции. Люминесценция — свечение веществ, возникающее под воздействием внешнего излучения: светового, ультрафиолетового, ионизирующего и др. Фотолюминесценция — люминесценция объекта под влиянием света. Если освещать люминесцирующий объект синим светом, то он испускает лучи красного, оранжевого, желтого или зеленого цвета. В результате возникает цветное изображение объекта (рис. 9) [8].
Рисунок 8 Цветное изображение объекта под люминесцентным микроскопом Сибирская язва При подозрении на сибирскую язву вскрывать трупы запрещается. Для исследования от трупа животного берут кровь из надреза уха, периферических сосудов или отрезают и отсылают в лабораторию ухо. Если подозрение на сибирскую язву появилось в процессе вскрытия трупа, вскрытие тотчас же приостанавливают и для исследования посылают ухо, как указано ниже. Подозрение на заболевание сибирской язвой свиней обычно возникает при наличии опухоли в области шеи. Если подозрение возникло во время вскрытия трупа свиньи, то дальнейшее вскрытие прекращают, а для бактериологического исследования берут участки отечной соединительной ткани, заглоточные лимфатические узлы. Место надреза предварительно тщательно дезинфицируют и после взятия крови прижигают огнем или раскаленным металлическим предметом. Кровь наносят на стекло толстым слоем и высушивают на воздухе без дополнительной фиксации. Ухо отрезают с той стороны, на которой лежит труп. Предварительно его туго перевязывают шпагатом у основания в двух местах и отрезают между перевязками. Не снимая шпагата, отрезанное ухо завертывают в чистую тряпочку или марлю, пропитанную 3%-ным раствором карболовой кислоты, а затем обертывают целлофаном, полиэтиленовой пленкой или пергаментной бумагой и помещают в герметически закрытую посуду. Место отреза уха на трупе прижигают огнем. Для исследования на сибирскую язву кожевенного сырья реакцией преципитации посылают кусочки кожи величиной 5×5 см [3].
Брадзот овец Для бактериологического исследования посылают кусочки печени, селезенки, мышц, подкожной клетчатки (если имеются отеки), содержимое тонких кишок, кусочки пораженных частей тонкого кишечника, сычуга и трубчатую кость. Материал для бактериологического исследования берут только от свежих трупов. Анаэробная дизентерия ягнят Для бактериологического и биологического исследований посылают свежий труп ягненка или свежие неконсервированные пораженные части кишечника с содержимым, кровь из сердца и паренхиматозные органы. Некробактериозы (некротические поражения конечностей, слизистой полости рта, внутренних органов). Для бактериологического и биологического исследований посылают омертвевший участок ткани, тщательно обмытый кипяченой теплой водой и высушенный ватным тампоном. Пораженную ткань соскабливают стерильной острой ложечкой вплоть до неизмененных слоев ткани, захватывая несколько и последние. Из пораженных органов и тканей вырезают некротические участки вместе с прилегающей здоровой тканью. Столбняк Для бактериологического исследования из мест глубоких ранений берут кусочки ткани и раневой секрет. Ботулизм Для бактериологического и биологического исследований в лабораторию направляют содержимое желудка в объеме 100-200 мл и части паренхиматозных органов, а также пробы подозрительных кормов (силос, зерно, отруби, мясные и рыбные отходы и т. п.). Корма отбирают по нескольку проб из разных мест. Вес пробы не менее 100 г. Патологический материал доставляют в термосе со льдом. Консервировать пробы нельзя. Пробы кормов доставляют в светонепроницаемой таре, предохраняя от высыхания. Туберкулез При подозрении на туберкулез легких для бактериологического исследования берут мокроту из трахеи путем введения в нее стерильного ватного тампона на проволоке через трахеотубус. При подозрении на туберкулез вымени для исследования берут молоко. При этом руки должны быть тщательно вымыты, продезинфицированы спиртом. После предварительного обмывания и дезинфекции вымени 70%-ным спиртом первые порции молока (из подозрительной четверти вымени) сдаивают, а затем берут порции молока в начале, в середине и в конце дойки общим количеством 150-250 мл. Бутылку закрывают стерильной пробкой или стерильным ватным тампоном. Для бактериологического исследования на туберкулез от убитых или павших животных посылают кусочки измененных органов и тканей со свежими, еще неинкапсулированными и необызвествленными поражениями. Взятый материал консервируют в 30% -ном стерильном водном растворе глицерина. Трупы павших или убитых птиц для исследования на туберкулез направляют целиком. Паратуберкулез Для прижизненной бактериологической диагностики паратуберкулезного энтерита берут кал от больных животных и извлекают из него обрывки слизистой оболочки, кусочки с кровью или комочки слизи. Отобранный материал помещают в стерильные пробирки или банки, закрытые корковыми, резиновыми или притертыми пробками. С той же целью у подозрительных по заболеванию (поносящих) животных берут соскобы со слизистой оболочки прямой кишки. Материал пересылают в лабораторию в пробирках. Для посмертной бактериологической диагностики от трупа, павшего или убитого животного в лабораторию направляют кусочки пораженного кишечника и измененные брыжеечные лимфатические узлы. Для гистологического исследования другую часть того же материала консервируют в 10%-ном растворе нейтрального формалина. Для серологической диагностики в лабораторию направляют кровь или сыворотку крови. Бруцеллез Для бактериологического исследования в лабораторию посылают: абортированный плод целиком с плодовыми оболочками или в исключительных случаях желудок плода с содержимым, перевязанный со стороны пищевода и двенадцатиперстной кишки, паренхиматозные органы плода и плодовые оболочки. В крайнем случае, на исследование можно послать слизь и другие выделения из матки абортировавшего животного. Кроме того, в лабораторию направляют содержимое гигром (бурситов), абсцессов, влагалищную слизь, молоко. От убитых с диагностической целью животных направляют паренхиматозные и половые органы, вымя, мочевой пузырь, а также паховые, надвымянные, парааортальные, гипогастральные, подвздошные, аксилярные, предлопаточные, заглоточные, подчелюстные и мезентериальные лимфатические узлы. Если узлы парные, то направляют правый и левый. Для серологического исследования в лабораторию посылают кровь или сыворотку крови, а также молоко в количестве 5-7 мл. Инфекционный эпидидимит Для бактериологического исследования направляют: от баранов – гноеподобное содержимое секвестров придатков, при вскрытии – измененные участки семенников; от овец – выделения из половых органов (в первые дни после аборта), при вскрытии – содержимое полости матки, измененные некротические участки рогов матки, яичники, глубокие тазовые лимфатические узлы и абортированные плоды [5].
Библиографический список 1. Асонов Н. Р. Микробиология [Текст]: 4-е издание – М.: Колос, 2001. – 352с. 2. Кисленко В. Н. Практикум по ветеринарной микробиологии и иммунологии. - М.: КолосС, 2005. – 232с. 3. Архипов Н.И. Патологоанатомическая диагностика вирусных болезней животных: справочное издание / Н.И. Архипов, С.Ф. Чевелёв, Г.И. Брагин и др. М.: Колос, 1999. 4. Ветеринарная вирусология: учебник для вузов / Р. В. Белоусова, Э. А. Преображенская, И. В. Третьякова; под ред. Р. В. Белоусовой. - М.: Великан, 2007. - 424 с. 5. Сюрин В.Н. Вирусные болезни животных / В.Н. Сюрин, А.Я. Самуйленко, Б.В. Соловьев, Н.В. Фомина. М.: Колос,1998. 6. Орлянкин Б.Г. Классификация и номенклатура вирусов позвоночных / Б.Г. Орлянкин, Е.А. Непоклонов, Т.И. Алипер // Ветеринария. 2001. № 10. - 15-20с. 6. Техника безопасности при работе с вирусами. Режим доступа: http://lektsii.net/1-102672.html Дата обращения 5.07.2019 7. Способы взятия патматериала. Методы консервирования и транспортировки патматериала. Режим доступа: http://lectmania.ru/1xd86b.html Дата обращения 12.07.2019 8. Микроскопические методы исследования. Режим доступа: http://microbiology.ucoz.org/index/metody_mikroskopicheskogo_issledovanija_mikrobov/0-19 Дата обращения 4.07.2019 9. Взятие патматериала у животных. Режим доступа: http://vetkrs.ru/patmat.php Дата обращения 13.07.2019
Специальность: 3.36.05.01 Ветеринария Специализация: Ветеринарная фармация Форма обучения: заочная Курс, группа: 2 курс, В 221
ДНЕВНИК ОТЧЕТ по учебной (технологической) практике по микробиологии и вирусологии ________________________ ГБУ БашНПВЛ ________________________ (место прохождения практики, название хозяйства или гос. предприятия, район) Казанцева Мария Олеговна (фамилия, имя, отчество) «К защите допускаю» Руководитель: д-р биол. наук, профессор Андреева А.В. (ученая степень, звание, Ф.И.О.) __________________________ (подпись) «___» ___________ 2019 г. Оценка при защите:
__________________________
__________________________ (подпись) «___»__________ 2019 г.
Уфа – 2019
Оглавление
1 Ознакомление с помещением и оборудованием ветеринарной лаборатории. Техника безопасности. Документация. 3 2 Подготовка лабораторной посуды к работе. Приготовление питательных сред и дополнительных растворов. 10 3 Освоение микроскопических методов исследования. 15 4 Участие в бактериологических и вирусологических исследованиях. 19 5 Кормление и уход за лабораторными животными. Биопроба. Аллергическая проба. 23 6 Проведение серологического анализа. 28 7 Способы взятия патматериала у животного при подозрении на бактериальную инфекцию.. 30 8 Способы взятия патматериала у животного при подозрении на вирусную инфекцию.. 34 9 Способы взятия крови для серологических исследований. 36 10 Методы консервирования, упаковки и транспортировки патматериала. 40 11 Сопроводительная документация к патматериалу. Методы дезинфекции. 45 Библиографический список. 49 Дневник. 50
|
|||||||||||||
|
Последнее изменение этой страницы: 2019-12-15; просмотров: 192; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.136.170 (0.071 с.) |