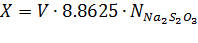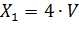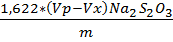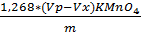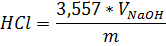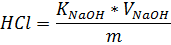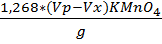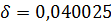Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гипохлорит натрия ⇐ ПредыдущаяСтр 5 из 5
· Плотность (1,240-1,300 г/см3)
· Массовая концентрация активного хлора 10 см3 гипохлорита натрия температурой (20±2)°С переносят пипеткой в мерную колбу, доводят объем раствора водой до метки и тщательно перемешивают (раствор А). 10 см3 полученного раствора А переносят пипеткой в коническую колбу, прибавляют 20 см3 раствора серной кислоты прибавляют 10 см3 раствора иодида калия, перемешивают, закрывают колбу пробкой и помещают в темное место. Через 5 мин титруют выделившийся йод раствором тиосульфата натрия до светло-желтой окраски раствора, затем прибавляют 2-3 см3 раствора крахмала и продолжают титрование до обесцвечивания раствора. Массовую концентрацию активного хлора (X), г/дм3, вычисляют по формуле:
Где: V - объем раствора тиосульфата натрия концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3; 8.8625 - масса активного хлора (г), соответствующая 1 см3 раствора тиосульфата натрия концентрации точно 0,1 моль/дм3.
· Массовая концентрация щелочи в пересчете на NaOH 25 см3 раствора А, переносят пипеткой в коническую колбу и осторожно небольшими порциями прибавляют 10 см3 раствора перекиси водорода, осторожно перемешивая во избежание сильного газовыделения. Через 2-3 мин после прекращения интенсивного газовыделения в колбу прибавляют 2-3 капли фенолфталеина и титруют ее содержимое раствором соляной кислоты до обесцвечивания раствора.
Массовую концентрацию щелочи в пересчете на NaOH(X 1), г/дм3, вычисляют по формуле:
Где: V - объем раствора соляной кислоты концентрации точно 0,1 моль/дм3, израсходованный на титрование, см3; 4 - масса гидроксида натрия (г), соответствующая 1 см3 раствора соляной кислоты концентрации точно 0,1 моль/дм3. Приложение №5 Хлорное железо FeCl 3 · Определение плотности хлорного железа
Ареометр 1,360-1,420
· Определение содержания хлорного железа FeCl 3 В коническую колбу с притертой пробкой на аналитических весах весах взвешиваем 1,5г. анализируемого продукта. Добавляем 50 мл дистиллированной воды, 10 мл 25% HCl, 15 мл 20% раствора KY. Быстро закрываем колбу пробкой, смоченной 20% раствором KY, перемешиваем и оставляем в темном месте на 10 минут. Затем смываем пробку дистиллированной водой в эту же колбу, доводим объем в колбе до 100 мл и титруем 0,1 н. раствором Na2S2O3 до бледно желтого окрашивания раствора, добавляем 2 мл 1% крахмала и дотитровываем до обесцвечивания раствора.
Одновременно проводим холостое определение с тем же количеством реактивов, но без анализируемого продукта.
FeCl3 = Где: Vx-объем раствора тиосульфата натрия израсходованный на титрование холостой пробы,см3 Vp- объем раствора тиосульфата натрия израсходованный на титрование анализируемой пробы,см3 m-масса анализируемой пробы, г. · Определение содержания хлористого железа FeCl 2 Берём коническую колбу на 250 мл, взвешиваем 2г пробы на аналитических весах, добавляем 75 мл кипяченной дистиллированной воды, 20 мл смеси Рейнгарда-Циммермана. Сначала титруем холостую пробу KMnO4 0,1н, а затем колбу с пробой, сравнивая с холостой.
FeCl2 = Где: Vx-объем раствора перманганата калия израсходованный на титрование холостой пробы,см3 Vp- объем раствора перманганата калия израсходованный на титрование анализируемой пробы,см3 m-масса анализируемой пробы, г. · Определение содержания HCl Берём коническую колбу на 250 мл, взвешиваем 1г пробы на технических весах, добавляем 10 мл дистиллированной воды и титруем 1н NaOH до выпадения осадка.
Где: V- объем раствора гидроксида натрия израсходованный на титрование,см3 m-масса анализируемой пробы, г. Приложение №6 Хлористое железо FeCl 2
· Определение содержания HCl
Берём коническую колбу на 250 мл, взвешиваем 1г пробы на технических весах, добавляем 10 мл дистиллированной воды, индикатор бромкрезоловый зелёный и титруем 0,1н NaOH до зелёного цвета раствора.
Где: V- объем раствора гидроксида натрия израсходованный на титрование,см3 m-масса анализируемой пробы, г K-поправочный коэффициент гидроксида натрия, 0,1мольэкв/дм3
· Определение содержания FeCl 2 Берём коническую колбу на 250 мл, взвешиваем 0,5г пробы на аналитических весах, добавляем 75 мл кипяченной дистиллированной воды, 20 мл смеси Рейнгарда-Циммермана. Сначала титруем холостую пробу KMnO4 0,1н, а затем колбу с пробой, сравнивая с холостой.
FeCl2 = Где: Vx-объем раствора перманганата калия израсходованный на титрование холостой пробы,см3 Vp- объем раствора перманганата калия израсходованный на титрование анализируемой пробы,см3 m-масса анализируемой пробы, г. Приложение №7 Пример статистической обработки результатов анализа Определение основного вещества (катамин)
Приложение №8
|
||||||
|
Последнее изменение этой страницы: 2019-08-19; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.254.231 (0.009 с.) |