
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Науковий фундамент термодинамікиСодержание книги
Поиск на нашем сайте
9.1. ТЕРМОДИНАМІКА (від гр. Therme – жар, тепло) – наука про взаємні енергетичні перетворення та стани рівноваги в системах, в яких мають місце теплові ефекти. Термодинаміка вивчає закономірности перетворення різних форм енерґії(тепла, роботи, хемічної, електричної, маґнітної, випромінювання тощо) та властивости тіл, завдяки яким проходять ці перетворення. Термодинаміка має справу із властивостями термодинамічних систем, що знаходяться в рівновазі. Вона не описує протікання процесів у часі. Термодинаміка дає точне співвідношення між вимірюваними властивостями термодинамічних систем і відповідає на питання: наскільки глибоко пройде дана хемічна реакція або фізико-хемічний процес до досягнення стану рівноваги, та дозволяє впевнено передбачити вплив температури, тиску, концентрацій реагентів тощо на хемічну рівновагу. Існує і термодинаміка нерівновагових процесів. Історично склалася назва предмету «термодинаміка» (що не відповідає його змісту) за аналогією з «гідродинамікою», а в дійсности рух тепла (як форми енерґії) в ній не розглядається. 9.2. ТЕРМОДИНАМІКА ґрунтується на чотирьох основних началах (законах, принципах, положеннях, постулатах), які є узагальненням закономірностей, що спостерігаються в природі, технологіях і, взагалі, в практиці людської діяльности, які застосовані до хемічної рівноваґи, електрорушійних сил, фазових переходів та рівноваґ і поверхневих та міжфазних явищ. Нульовий принцип (нульове начало) стверджує про самочинне досягнення теплової рівноваґи в ізольованих термодинамічних системах. Перше начало1 термодинаміки є законом еквівалентности різних форм енерґій, і витікає із загального закону збереження і перетворення енерґіїі речовини, прикладеного до термодинамічних систем і термодинамічних процесів. На його основі складається баланс різних форм енерґій у будь-яких перетвореннях, при цьому використовують властивости функцій термодинамічного стану тіл, систем, що енергетично взаємодіють. Але перше начало не визначає можливости і спрямованість термодинамічних процесів. Друге начало термодинаміки встановлює умови можливостей змін у заданому напрям протікання процесів, умови рівноваги і ступінь завершености оборотніх і необоротніх процесів, які можуть проходити у прямому і зворотньому напрямках. Обмеження, що накладає друге начало термодинаміки на термодинамічний процес, виражається за допомогою деяких певних термодинамічних параметрів і функцій термодинамічного стану – внутрішньої енергії (U), ентальпії (H), ентропії (S), термодинамічних потенціалів Ґіббса (G) і Гельмгольца (F) тощо. Третє начало термодинаміки є доповненням до другого начала у тій частині, що відноситься до розрахунків хемічної рівноваґи на основі термічних властивостей речовин та термодинамічного стану і термодинамічних властивостей речовин, стану термодинамічної рівноваґи за абсолютного нуля температур. Ці основні положення (начала) термодинаміки мають досить узагальнений характер, а їх формулювання та окремі застосування визначаються залежно від конкретного змісту явищ та умов. Термодинаміка побудована таким чином, що дослідним шляхом та спостереженнями встановлені основні начала і положення та застосовано до них звичайний, доволі простий апарат математичної аналізи. 9.3. Феноменолоґічна термодинаміка. Сукупність закономірностей, що виведені математичним шляхом на основі логічного розвитку начал термодинаміки, становить зміст феноменолоґічної (класичної) термодинаміки.
Вона побудована на чисто дедуктивному2 принципі: в ній закони термодинаміки розглядають як дослідні (або внаслідок спостережень) узагальнення, з яких виводять наслідки (висновки) для різних окремих випадків. Феноменолоґічна термодинаміка побудована на таких принципах: · застосовується лише до макросистем. Окремі частинки (молекули, атоми, електрони тощо) або невелика їх сукупність і, відповідно, структура речовини та механізм процесів на мікроскопічному рівні не розглядаються. Нижньою межею макросистем можна вважати сукупність молекул та інших частинок системи, що визначається числами Авоґадро та Лошмідта: 1) число Авоґадро (NA) – число молекул у 1 моль будь-якої речовини або число атомів у 1 ґрам-атомі будь-якої хімічної простої речовини. Так як число Авоґадро може бути визначене до 20-ти незалежними методами, наприклад, на основі: барометричної формули, законів броунівського руху, за формулами, які зв’язують його з иншими фізичними сталими (зі сталою Рідберґа, з атомною масою або маґнітним моментом протона тощо), які хоча і визначаються з високою точністю, але все ж дають певну похибку під час розрахунків, то число Авоґадро має різні значення: NA = (6,02252 ± 0,00028)·1023 [моль–1] (у карбоновій скалі атомних мас); NA = 6,022045(31)·1023 [моль–1]; NA = 6,0220978·1023 [моль–1]. 2) число Лошмідта (NL) –число молекул в 1 см3 речовини, яка перебуває у стані ідеального ґазу за нормальних фізичних умов (н.ф.у.): NL = 2,658…·1019 [см–3]. Число Лошмідта пов’язан з числом Авоґадро таким співвідношенням:
де V0 – об’єм 1 моль ідеального газу за н.ф.у. [см3]. · не вдаючись до мікроскопічного змісту таких макроскопічних величин як тиск, об’єм, густинатощо, встановлюють між ними зв’язок на основі даних досліду; · має справу з властивостями систем, які знаходяться у рівноваговому стані; · вона не описує протікання процесів у часі; · дає точне співвідношення між виміряними властивостями системи; · відповідає на питання: наскільки глибоко пройде даний процес до того, як буде досягнута рівновага? · дає можливість передбачити вплив температури, тиску, концентрації тощо на рівновагу;
· їй не прийнятні модельні уявлення про структуру речовини і характер руху частинок; · сила її полягає у незалежности висновків від конкретної фізичної моделі системи та наближень, до яких неминуче вдається статистичний підхід. 9.4. У залежности від того, в якій галузі науки і техніки розглядається перетворення різних форм енерґій, розрізняють загальну (фізичну), технічну і хемічну термодинаміки. 9.5. ФІЗИЧНА (ЗАГАЛЬНА) ТЕРМОДИНАМІКА – наука, в якій викладені теоретичні основи термодинаміки, її начала та їх застосування до фізичних явищ; вона встановлює математичні співвідношення між різними термодинамічними величинами; яка вивчає процеси перетворення різних форм енерґіїв твердих, рідких, ґазових (в т.ч. і плазменних) тілах і властивости цих тіл; яка розглядає електричні і маґнітні явища, випромінювання і поглинання в цих тілах тощо. Фізична термодинаміка є теоретичною базою технічної і хемічної термодинаміки. 9.6. ТЕХНІЧНА ТЕРМОДИНАМІКА вивчає: основні закони фізичної термодинаміки у прикладанні до двох форм енергії – тепла і роботи; процеси, які відбуваються у робочих тілах (ґазах і парах); властивости робочих тіл (ґазів і пари); встановлення взаємозв’язку між тепловими і механічними процесами в теплових машинах і холодникових уставах; займається розробкою теорії теплових двигунів для раціонального їх конструювання та експлуатації. 9.7. ХЕМІЧНА ТЕРМОДИНАМІКА вивчає: · застосування начал, принципів і загальних положень фізичної термодинаміки до хемічних і фізико-хемічних явищ, процесів і термодинамічних систем; · процеси і теплові баланси фізичних процесів розчинення, випаровування, кристалізації, адсорбції тощо та хемічні реакції, в яких мають місце теплові ефекти; · термодинамічну рівноваґу і вплив на неї зовнішніх умов; · фазову рівноваґу для індивідуальних речовин і сумішей; · хемічну рівноваґу; вплив на термодинамічну, фазову і хемічну рівноваґи зовнішніх умов; · процеси і умови самочинного протікання і направленість хемічних реакцій. 9.8. ГОЛОВНИМИ ЗАВДАННЯМИ ДЛЯ ХЕМІЧНОЇ ТЕРМОДИНАМІКИ є наступне: · визначення умов, при яких даний хемічний чи фізико-хемічний процес можливий (без звершення роботи ззовні); · знаходження меж стійкости даної речовини або сукупности речовин в певних умовах; · з’ясування, яким чином можна зменшити кількість (або взагалі виключити) утворення небажаних речовин, тобто подавити або виключити побічні хемічні реакції; · вибір оптимального режиму процесу (температури, тиску, концентрації реаґентів тощо); якщо термодинамічні розрахунки вказують на принципову здійсненність процесу, то експериментальним шляхом знаходять умови, які сприяють протіканню хемічних процесів з достатньою швидкістю.
|
||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 366; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.44.145 (0.01 с.) |


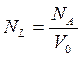 ,
, 2 дедукція – від лат. виведення, перехід від загального до частинного; процес логічного висновку, тобто переходу за тими чи іншими правилами логіки від певних пропозицій-посилок до їх наслідків (висновків, заключень), при цьому наслідки завжди можна охарактеризувати як «окремий випадок (приклад)» загальних посилок)
2 дедукція – від лат. виведення, перехід від загального до частинного; процес логічного висновку, тобто переходу за тими чи іншими правилами логіки від певних пропозицій-посилок до їх наслідків (висновків, заключень), при цьому наслідки завжди можна охарактеризувати як «окремий випадок (приклад)» загальних посилок)


