Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль в жизнедеятельности организмаСодержание книги Поиск на нашем сайте
Организм человека на 60 % состоит из воды, из них 42 % приходится на внутриклеточную жидкость, а остальная часть - на внеклеточную (межклеточную) жидкость, которую подразделяют на внутрисосудистую и интерстициалъную (межтканевую) жидкость. Вода — это не только среда, но также активный участник процессов жизнедеятельности. Если организм человека теряет 20 % воды, то в клетках происходят необратимые изменения и человек погибает. Потребность в воде взрослого человека составляет 35 г в день на 1 кг массы тела, а грудного ребенка – в 3–4 раза больше. Большая роль воды в живой природе связана с рядом уникальных её свойств, благодаря которым вода является средой, растворителем и метаболитом для живых организмов. Вследствие высокой теплоемкости (75,3 Дж/(моль · К)) и большой теплоты испарения (40,8 кДж/моль) вода обеспечивает термостатирование нашего организма. Высокая диэлектрическая проницаемость воды (e = 78,5) способствует растворению солей, кислот, оснований и их диссоциации на ионы, так как сила электростатического взаимодействия между ионами обратно пропорциональна диэлектрической проницаемости среды. Ионное состояние веществ в водной среде обуславливает высокие скорости протекания биохимических реакций, быструю миграцию ионов через биологические мембраны и практически мгновенную передачу нервных импульсов. Высокий дипольный момент молекулы воды (1,82 Д) и способность образовывать четыре водородные связи: две - как донор протонов и две – как акцептор протонов, не только увеличивают растворяющую способность воды по отношению к полярным веществам, но и благоприятствуют формированию определённых структур водных ассоциатов в самой воде, а также у молекул биополимеров в водных растворах. Перечисленные особенности воды и её низкая вязкость (0,001 Па · с при 293 К) способствуют выполнению ею транспортных функций, а также возникновению жидкокристаллического состояния у водных растворов некоторых биосубстратов. Геометрически молекула воды представляет собой угловую систему, в центре которой находится атом кислорода с sp3-гибридизацией валентных атомных орбиталей. При этом в двух вершинах тетраэдра находятся атомы водорода, а к двум другим направлены атомные орбитали атома кислорода с неподеленными электронными парами. За счёт двух атомов водорода, несущих частично положительный заряд, и двух неподелённых электронных пар атома кислорода каждая молекула воды может образовывать четыре водородные связи с соседними молекулами воды. Именно такая межмолекулярная система реализуется в замёрзшей воде, то есть у льда (рис. 1, а). Лёд имеет тетраэдрическую кристаллическую решетку, где атом кислорода одной молекулы воды расположен в центре тетраэдра, а в четырёх его вершинах находятся атомы кислорода соседних молекул, которые соединены водородными связями с центральной молекулой и молекулами ближайших тетраэдров. Подобная структура энергетически выгодна при условиях близких к нормальным, и поэтому она устойчива при этих условиях. Ажурность и наличие внутренних пустот определяют рыхлость и меньшую плотность льда (0,92 г/см3) по сравнению с жидкой водой. При плавлении льда частично рвутся водородные связи и появляются: ассоциаты, в которых сохраняется каркасная структура за счёт водородных связей, полости между ассоциатами и внутри них, а также отдельные молекулы воды (рис. 1, б). В чистой жидкой воде имеется динамическое равновесие как между ассоциатами, так и между ассоциатами и свободными молекулами воды, блуждающими в полостях между ассоциатами или внутри них. Среднее время жизни молекул воды в этих образованиях τср = 10–9 с. С повышением температуры параллельно происходят два процесса: первый связан с увеличением размеров полостей и уменьшением размеров ассоциатов, что приводит к уменьшению плотности системы; второй - с увеличением степени заполнения полостей отдельными молекулами воды, за счёт чего плотность системы увеличивается. В интервале температур от 0 °С до 4 °С преобладает второй процесс, и поэтому плотность воды максимальна при 4 °С (1,000 г/см3), а при температуре выше 4 °С доминирует первый процесс и плотность воды уменьшается, так как происходит разрыхление структуры воды. Однако ассоциаты с трёхмерной сеткой водородных связей сохраняются в жидкой воде при любой температуре. В стандартных условиях, согласно статистическим расчётам, около 30 % всех молекул воды находятся в виде отдельных молекул, а 70 % входит в состав ассоциатов. Среди них 40 % приходится на стабилизированные ассоциаты с определенной структурой, то есть на "структурированную" воду, а 30 % - на случайные ассоциаты, которые не имеют определенной структуры. Совокупность случайных ассоциатов и отдельных молекул воды составляют " 'деструктурированную" воду (всего 60 %). В "структурированной" воде время жизни молекул воды в ассоциатах больше (τ>τcp = 10–9с), чем среднее время их жизни в воде в целом. В "деструктурированной" воде этот показатель, наоборот, меньше (τ < τср). Таким образом, обычная чистая вода является сложной динамичной системой, которую можно представить схемой, изображенной на рис. 2. На положение равновесия в водной системе оказывают влияние многие факторы: температура, акустические, магнитные и электрические поля, а также присутствие ионов Н+ и ОН–, возникающих за счёт диссоциации воды, или радикалов, образующихся при радиационном воздействии на воду. В стандартных условиях одной из энергетически выгодных структур для ассоциатов чистой воды является льдоподобная структура. При условиях, отличающихся от стандартных, или при воздействии какого-либо поля возможно возникновение энергетически выгодных ассоциатов с другой структурой. Подобное происходит в воде, например, после её обработки при сверхкритических температуре и давлении или при мощном импульсном электрическом разряде в объёме жидкости и некоторых других методах обработки воды. Увеличению содержания "структурированной" воды способствуют: – расплавление льда (талая вода) с последующим поддержанием низкой температуры (ниже 10 °С); – длительный контакт с поверхностью нерастворимых в воде минералов: апатита, кальцита, кварца, кремнезёма, кремня, шунгита, глины и некоторых других, приводящий к образованию родниковой воды; – растворение в воде веществ, для ионов или молекул которых характерна положительная гидратация (см. дальше); – воздействие вибрации и различных полей: акустического, магнитного, электрического, обладающих определенными характеристиками; – воздействие сверхкритических температуры и давления.
Вода с повышенным содержанием "структурированной" воды, имеющей льдоподобную структуру, для живых организмов полезна и поэтому часто называется "живой" водой. Это можно объяснить тем, что такая вода лучше усваивается организмами, поскольку без существенной перестройки используется для гидратации тканей, белков и других биосубстратов. Наличие в воде различных ассоциатов, имеющих разную структуру и разное время жизни, позволяет обосновать ещё одну особенность воды - структурно-информационную память. Э та особенность воды часто лежит в основе не всегда понятных изменений её физико-химических свойств, биологических и физиологических функций при воздействии астрогелиогеофизических факторов или после обработки экстрасенсами, а также действия гомеопатических средств. Способность перехода в различные структурно-информационные состояния присуща не только чистой воде, но и её растворам и водным системам живых организмов.
Вода — уникальный растворитель, что объясняется следующими её особенностями: – высокой диэлектрической проницаемостью (Е = 78,5); – способностью проявлять протонодонорные и протоноакцепторные свойства, так как вода амфолит; – способностью проявлять электронодонорные и электроно-акцепторные свойства; – наличием внутренних пустот в жидкой воде из-за ажурности её структуры.
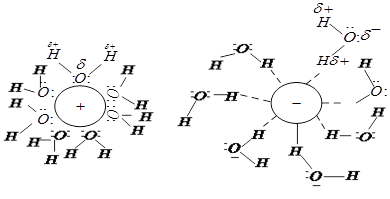
При растворении в воде соединений с ионной связью происходит их диссоциация, а образующиеся ионы окружаются гидратной оболочкой, содержащей плотный и рыхлый слои "связанной" воды. В плотном гидратном слое молекулы воды в значительной степени поляризованы и удерживаются сильным ион–дипольным взаимодействием, а их пространственная структура определяется свойствами иона (катиона или аниона). Между плотным гидратным слоем и "свободной" водой, не участвующей в гидратации ионов, находится рыхлый "деструктурированный" слой гидратной оболочки, состоящий в основном из одиночных молекул воды и мелких ассоциатов. Подвижность молекул воды в рыхлом слое больше, чем в "свободной" воде. Рыхлый слой гидратной оболочки обеспечивает сродство между "свободной" водой и плотным слоем вокруг иона, имеющим специфическую структуру в зависимости от природы иона. Толщина плотного и рыхлого слоёв, а также среднее время жизни молекул воды в гидратной оболочке зависят от природы иона электролита (рис. 3), его концентрации и температуры. В зависимости от средней продолжительности жизни молекул воды в гидратной оболочке иона различают положительную и отрицательную гидратацию. Ионы, имеющие высокую поверхностную плотность заряда, то есть ионы с большим зарядом и малым радиусом, такие как Li+, Na+, Mg2+, A13+, Fe3+, Cr3+, F–, Сl–, СО32–, HCO3–, которые прочно связывают молекулы воды в гидратной оболочке, характеризуются положительной гидратацией. В этих случаях среднее время жизни молекул воды в гидратной оболочке иона больше, чем в "свободной" воде, не участвующей в гидратации. Ионы с положительной гидратацией способствуют увеличению в растворе содержания "структурированной" воды. Вероятно, поэтому катионы Na+ и анионы Сl– в основном сосредоточены в межклеточной жидкости. Для многозарядных катионов А13+, Fe3+, Сг3+, которые наиболее сильно удерживают молекулы воды, время жизни молекул воды в гидратном слое достигает секунд, минут и даже часов. Это объясняется переходом ион-дипольного взаимодействия данных ионов с ближайшими молекулами воды в ковалентную связь между ними с возникновением комплексных катионов [А1(Н2О)6]3+, [Fe(H2O)6]3+, [Cr(H2O)e]3+, устойчивость которых значительно выше, чем устойчивость любых ассоциатов воды. Ионы с малой поверхностной плотностью заряда: К+, Cs+, NH+, I–, Br–, HPO42–, H2PO4–, NO3–, СlО4–, и поэтому слабо притягивающие молекулы воды, имеют в гидратной оболочке тонкий плотный "структурированный" слой и толстый рыхлый "деструктурированный" слой (рис. 3) и характеризуются отрицательной гидратацией (tср< 10-9 с). Ионы с отрицательной гидратацией способствуют уменьшению в растворе содержания "структурированной" воды. Вероятно, поэтому ионы К+, НРО2-4, Н2РО-4; являются ионами внутриклеточной жидкости, способствуя увеличению содержания в ней "деструктурированной" воды.
Рис 4. Различия в структуре гидратных оболочек катиона (а) и аниона (б)
При концентрации ионов в водном растворе более 1 моль/л гидратные оболочки ионов взаимно перекрываются, и в таких растворах "свободной" воды уже практически нет. При наличии в водных растворах электролитов молекул полиэлектролитов: белков, нуклеиновых кислот или растворимых органических соединений "свободная" вода исчезает из них при значительно меньших концентрациях веществ в растворе. Рассмотрим различия в структуре гидратных оболочек катионов и анионов. К катиону молекулы воды сориентированы не поделённой электронной парой атома кислорода, а атомы водорода направлены наружу (рис. 4). Аналогичным образом ориентированы и соседние молекулы воды гидратной оболочки катионов. В отличие от катиона, к аниону молекулы воды гидратной оболочки ориентированы одним атомом водорода, несущим частичный положительный заряд, обеспечивающий возникновение различных видов межмолекулярного взаимодействия. Другой атом водорода и не поделённые электронные пары направлены в толщу гидратной оболочки, что способствует связыванию ближайших молекул воды не только электростатически, но и за счёт водородных связей (рис. 4). "При растворении в воде веществ, молекулы которых полярны и содержат небольшие гидрофобные группы, например С2Н6ОН, NH(CH3)2, C6H5COOH, вокруг их молекул, за счёт водородных связей между полярными группами и молекулами воды, образуется гидратная оболочка, охватывающая всю молекулу в целом и содержащая плотный и рыхлый слои. При этом гидрофобные группы вещества, стремясь уменьшить свой контакт с молекулами воды за счёт гидрофобного отталкивания, вызывают колебания гидратной оболочки, способствуя тем самым увеличению структурированности в ней молекул воды. Это приводит к формированию в гидратной оболочке стабилизированной (льдоподобной) структуры и увеличивает время "оседлой" жизни молекул воды в ней до 10–7 с, то есть для молекул органических соединений характерна положительная гидратация. С увеличением концентрации раствора органического вещества толщина рыхлого слоя их гидратных оболочек вокруг молекул значительно уменьшается, что может ограничить растворимость этих веществ в воде. При растворении в воде дифильных веществ, молекулы которых кроме полярной группы содержат большие гидрофобные группы, Например стеарат натрия С17Н35СООNа (мыло) или фосфолипиды, вокруг них не может образоваться единая гидратная оболочка и поэтому происходит такая взаимная ориентация их молекул, которая исключает контакт гидрофобного фрагмента с молекулами воды. В случае очень низких концентраций таких веществ в растворе это достигается прежде всего за счёт сосредоточения и определённой ориентации дифильных молекул только в поверхностном слое раствора, где образуется из них мономолекулярный слой, в котором гидрофобные фрагменты выступают над поверхностью воды, а полярные группы находятся в воде (рис. 5). В случае больших концентраций дифильных веществ в водном растворе из их молекул образуются ассоциаты, называемые мицеллами (рис. 5), в которых гидрофобные фрагменты спрятаны внутрь. Полярная оболочка мицелл эффективно гидратируется, что способствует стабилизации этих частиц в коллоидных растворах. Гидратация молекул белков в растворе сопровождается структурированием белковой цепи, в результате чего гидрофобные фрагменты этой цепи, взаимодействуя друг с другом, образуют гидрофобное ядро внутри молекулярного ассоциата, из которого выталкивается вода, а на поверхности этого ядра в основном располагаются фрагменты, содержащие гидрофильные группы. Эти группы, взаимодействуя с молекулами воды за счёт водородных связей, способствуют созданию вокруг молекулы белка гидратной оболочки, содержащей плотный и рыхлый слои. Плотный водный слой под действием отдельных гидрофобных групп структурируется с образованием льдоподобной структуры. При этом биологические и физиологические функции белка и его растворимость зависят не только от его собственной структуры, но и от структуры его гидратной оболочки. Аналогично обстоит дело с нуклеиновыми кислотами и полисахаридами в живой клетке. Таким образом, вода является не только основой внутриклеточной среды, где распределены молекулы белков, нуклеиновых кислот, полисахаридов, но и непосредственно участвует в формировании пространственной структуры этих молекул, обеспечивая их биологические и физиологические функции. Каждый грамм ДНК прочно удерживает 0,6 мл воды, гликогена — 1,5 мл воды, а белка — 3 мл воды. Поэтому, как справедливо указывал А. Сент-Дьёрдьи: "нельзя говорить о белках, нуклеиновых кислотах, нуклеопротеидах и о воде так, как если бы это были две различные системы. Они образуют единую систему, которую нельзя разделить на компоненты без разрушения её сущности" (1940). Эти слова полностью созвучны с теорией растворов Д. И. Менделеева (1887), согласно которой раствор — это новая химическая система, возникающая в результате взаимодействия растворителя с растворённым веществом. Интересное взаимодействие воды наблюдается при растворении в ней веществ, молекулы которых неполярны. Растворение этих веществ происходит из-за ажурности структуры воды и наличия внутренних пустот в её ассоциатах. В воде незначительно растворяются газы (N2, О2, C12, CH4, C02), молекулы которых неполярны. Они растворяются путём внедрения их молекул в структурные полости внутри водных ассоциатов, причём размеры этих полостей должны соответствовать размерам молекул газа. При этом молекулы этих веществ удерживаются ближайшими молекулами воды за счёт индукционных и дисперсионных взаимодействий. В то же время, вследствие неполярности этих молекул, они вступают в гидрофобное взаимодействие с молекулами воды окружающих их ассоциатов, структурируя их, образуя вокруг них гидратные оболочки с льдоподобной структурой. Гидратная оболочка вокруг неполярных веществ рыхлого слоя не имеет, а характер их гидратации — положительный (tср > 10–9с). Во многих случаях из таких растворов можно получить твёрдые гидраты этих газов, состав которых не стехиометричен, например СН4 · 5,75 Н2О; С12 · 7,66 Н2О; С3Н8 · 17 Н2О. Подобные гидраты образуют вещества, используемые в медицинской практике в качестве анестезирующих веществ: закись азота N2О, хлороформ СНС13, диэтиловый эфир (С2Н5)2О, фторотан CF3CHBrCl. Таким образом, при растворении любых веществ не только происходит гидратация образующихся частиц, но и изменяются структурно-информационные свойства самой воды. Биологические и физиологические функции биосубстратов сильно зависят от соотношения "структурированная вода", "деструктурированная вода ", отражающего степень упорядоченности водных систем во внутри- и межклеточных жидкостях. К сожалению, эту величину пока нельзя экспериментально определить в водных системах. Растворимость тех или иных веществ во внутриклеточной жидкости зависит от их проницаемости через мембраны и от содержания "деструктурированной" воды в клетке, которое, в свою очередь, определяется состоянием клетки. Содержание "свободной" воды в межклеточных жидкостях - небольшое, и она используется как резерв для гидратации вновь поступающих веществ в организм, для удаления метаболитов и в качестве первичного компонента для термостатирования организма. Главная особенность состояния воды в клетке заключается в том, что скорость указанных превращений и время оседлой жизни молекул воды в каждом конкретном состоянии (внутри клетки, между клетками или внутри сосудов) варьируют в чрезвычайно широких пределах. Кроме того, эти показатели зависят: от состояния рассматриваемой системы, от воздействия температуры, давления, вибрации и действия разных полей - акустического, магнитного, электрического. В этом и заключаются сложность и загадочность водных систем вообще, а в живых организмах – в особенности.
|
||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 397; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.007 с.) |

 В соответствии с принципом "подобное в подобном" в воде хорошо растворяются вещества, молекулы которых содержат ионные связи или полярные функциональные группы и поэтому хорошо сольватируются водой. В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные ("любящие воду") и гидрофобные ("боящиеся воды"). К гидрофильным относятся ионы и полярные группы: гидроксильная –ОН, амино –NH2, карбоксильная –СООН, нитро –NО2, фосфатная –ОРО(ОН)2, сульфо –SO3H. К гидрофобным относятся неполярные группы: углеводородные радикалы предельных (–CnH2n+1), непредельных (–CnH2n-1) и ароматических (–С6Н5) соединений. Гидрофобные свойства характерны также для веществ, молекулы которых неполярны: О2, N2, CО2, С12, СН4 и так далее. Если молекулы вещества содержат и гидрофильный и гидрофобный фрагменты, то их называют дифилъными, а соответствующие вещества — дифилъными соединениями (например, мыло, фосфолипиды, белки). Дифильные молекулы принято изображать в виде "головастика", у которого головка соответствует полярному, а хвост — гидрофобному фрагменту молекулы.
В соответствии с принципом "подобное в подобном" в воде хорошо растворяются вещества, молекулы которых содержат ионные связи или полярные функциональные группы и поэтому хорошо сольватируются водой. В зависимости от сродства к воде функциональные группы подразделяют на гидрофильные ("любящие воду") и гидрофобные ("боящиеся воды"). К гидрофильным относятся ионы и полярные группы: гидроксильная –ОН, амино –NH2, карбоксильная –СООН, нитро –NО2, фосфатная –ОРО(ОН)2, сульфо –SO3H. К гидрофобным относятся неполярные группы: углеводородные радикалы предельных (–CnH2n+1), непредельных (–CnH2n-1) и ароматических (–С6Н5) соединений. Гидрофобные свойства характерны также для веществ, молекулы которых неполярны: О2, N2, CО2, С12, СН4 и так далее. Если молекулы вещества содержат и гидрофильный и гидрофобный фрагменты, то их называют дифилъными, а соответствующие вещества — дифилъными соединениями (например, мыло, фосфолипиды, белки). Дифильные молекулы принято изображать в виде "головастика", у которого головка соответствует полярному, а хвост — гидрофобному фрагменту молекулы.