
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения и понятия координационной теории.
Комплексные соединения Цель занятия: Сформировать у студентов системные знания о строении и свойствах комплексных соединений. Научить студентов получать комплексные соединения и на основании поведения комплексных соединений в растворах делать выводы об их устойчивости. Обоснование темы. Комплексообразование имеет большое значение при протекании биологических процессов в живых организмах. Ионы щелочных и щелочно-земельных металлов в биологических жидкостях находятся в виде аквакомплексов, а ионы d-элементов, являясь прекрасными комплексообразователями, образуют комплексы, в которых в качестве лигандов выступают аминокислоты, нуклеиновые кислоты, витамины и гормоны. Например, железо входит в состав гемоглобина. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов (витамин В12). Кроме того, образование растворимых устойчивых комплексных соединений позволяет выводить из организма соли тяжелых металлов, что способствует дезинтоксикации организма.
Комплексные соединения это молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе.
Классификация и номенклатура комплексных соединений. Классификация комплексных соединений проводится по различным признакам. 1. По заряду комплексного иона различают: катионные [Cu(NH3)4]2 анионные [Co(NO3)6]3- нейтральные [Pt(NH3)Cl2]0 2. По характеру лигандов различают: акво- [Сu(H2O)4]SO4 аммино-[Cu(NH3)4]SO4 ацидо- К2[Cu(Cl)4] гидроксо-K2[Cu(OH)4] По структуре внутренней сферы различают внутрикомплексные(циклические) соединения. Например, в живом организме встречаются клешневидные (хелатные) пятичленные циклы. Они образуются катионом металла и ɑ-аминокислотами. К ним относятся гемоглобин, хлорофилл, витамин В12. При составлении названия комплексных соединений руководствуются следующими правилами: · Сначала называют внутреннюю сферу. · Составные части её называют в следующей последовательности: лиганды анионы, лиганды – молекулы, комплексообразователь. Записывают формулу в обратной последовательности. · К названиям лигандов – ионов добавляют окончание «о» (Сl—хлоро-, СN—циано-). Нейтральные молекулы сохраняют свои названия, за исключением Н2О – акво, NН3 – амин. · Число лигандов указывают греческими числительными: ди, три-, тетра-, пента-, гекса- и т.д. · В последнюю очередь называют ионы внешней сферы. Пример: катионные –[Cu(NH3)4 ]SO4 – тетраамминокупрат (II) сульфат; анионные – Na3[Co(NO2)6] –гексанитрокобольтат (III) натрия; нейтральные [Pt(NH3)]Cl2 - дихлородиамминоплатина.
Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Главную роль в жизнедеятельности живых организмов играют бионеорганические соединения с макроциклическими лигандами. В таких лигандах донорные атомы связаны в единое кольцо – цикл. Наиболее распространены тетрадентатные макроциклы – порфирины. Лигандами являются атомы азота, которые располагаются по углам квадрата и жестко скоординированы в пространстве. Поэтому они образуют прочные координационные соединения даже с катионами щелочно - земельных металлов. Например, если в качестве центрального атома выступает ион магния, то в результате образуется активный центр хлорофилла, а если используются ионы Fe2+, образуется активный центр гемоглобина. Порфириновые комплексы железа и кобальта входят в состав гемоглобина, каталазы, цитохромов, витамина В12. Все эти комплексы имеют октаэдрическую конфигурацию. Дефицит этих веществ в организме приводит к серьезным заболеваниям.
Вопросы для самоконтроля 1. Основные положения и понятия координационной теории 2. Классификация комплексных соединений. 3. Комплексообразующая способностьs-р-иd- элементов. Её причины. 4. Природа химической связи в комплексных соединениях с позиций метода валентных связей. 5. Влияние природы комплексообразователя на распределение электронов в ионе - комплексообразователе. Внешнеорбитальные и внутриорбитальные комплексные соединения. 6. Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). 7. Устойчивость комплексных соединений. Константа нестойкости комплексных соединений, её связь с константой устойчивости. 8. Конкуренция за лиганд или за комплексообразователь: изолированное и совмещенное равновесия замещения лигандов. 9. Общая константа совмещенного равновесия замещения лигандов. инертные и лабильные комплексы. 10. Физико – химические принципы транспорта кислорода гемоглобином. 11. Металло – лигандный гомеостаз и причины его нарушения. 12. Механизм токсического действия тяжелых металлов и мышьяка на основе теории жестких и мягких кислот и оснований (ЖМКО. 13. Термодинамические принципы хелатотерапии. 14. Механизм цитотоксического действия соединений платины. 15. Значение комплексных соединений
Упражнения 1. Вычислите заряды следующих комплексных ионов, образованных Сr (III): а) [Cr(H2O)5Cl], б) [Cr(H2O)4Cl2 ], в) [Cr(H2O)2 (C2O4)2]. Дайте названия этих комплексных соединений. 2. Составьте комплексное соединение, если: а) комплексообразователь Zn2+, лиганды ОН-, координационное число (к.ч.) 4, внешнюю сферу подберите сами. Дайте название этому КС; б) комплексообразователь Аg+, лиганды NH3, к.ч.= 2, внешнюю сферу подберите сами. Дайте название этому КС; в) комплексообразователь Fe+2, лиганды СN, к.ч. = 6, внешнюю сферу подберите сами. Дайте название этому КС. Напишите для всех комплексов первичную и вторичную диссоциацию, покажите выражение константы нестойкости комплексов. 3. Назовите комплексные соли: [Cu(NO3)4] (NO3)2, [Co(H2O)(NH3)4]Br2, [Co(NH3)5SO4]NO3, K4[Fe(CN)6], Na2[PdI4], K2[HgI4], K2[Pt(OH)5Cl]. 4. Напишите формулы комплексных неэлектролитов: а) тетраамминофосфатхром, б) диаминодихлорплатина, в) триамминотрихлорокобальт, г) диамминотетрахлорплатина. В каждом из комплексов укажите степень окисления комплексообразователя 5. Составьте уравнения электролитической диссоциации солей: (NH4)2Fe(SO4)2, [Cu(NH3)4]SO4, Na3[Co(NO2)6]. 6. Напишите выражение для константы нестойкости следующих комплексных ионов: [Cd(NH3)4]+2, [Co(NH3)6]+3, [AlF6]-3. 7. Константы нестойкости для некоторых комплексных ионов равны: а) 1·10-37, б) 8·10-16, в) 1·10-44. Какой из указанных ионов менее устойчив к диссоциации? Лабораторные работы Работа 1. Получение и cвойства комплексных соединений. Приборы и реактивы: штатив с набором пробирок, растворы солей: CuSO4, KI, Bi(NO3)2, Zn(NO3)2, AgNO3, CrCl3, AlCl3, Al2(SO4)3, NiSO4, K3[Fe(CN)6], Na3[Co(NO2)6], K4[Fe(CN)6, растворы гидроксида аммония, гидроксида натрия, азотной и щавелевой кислот, раствор КАl(SO4)2, кристаллический CrCl3·6H2O, NH4CNS. Опыт 1. Различие между простыми и комплексными ионами. В одну пробирку поместите 3-4 капли раствора хлорида железа (111), в другую – 3-4 кап. К3[Fe(CN)6]. В обе пробирки добавьте 2-3 кап. роданида аммония (NH4CNS) или роданида калия (КCNS). Что наблюдаете? Напишите уравнения реакций и объясните данное явление. FeCl3 + 6KCNS → K3[Fe(CN)6] + 3KC цвет? K3[Fe(CN)6] + KCNS → реакции нет, почему? Опыт 2. Комплексные соединения в реакциях обмена а) Поместите в одну пробирку 2-3 капли раствора К3[Fe(CN)6], в другую 2-3 капли раствора FeCl3. В обе пробирки добавьте по 2-3 капли FeSO4 Что происходит? Напишите уравнение реакции обмена. Опыт 3. Образование комплексной соли меди при взаимодействии с раствором аммиака. В пробирку внесите 10-15 капель раствора сульфата меди (ІІ) и по каплям добавьте 25% раствора ΝН4ОН. Наблюдайте растворение выпавшего вначале осадка основного сульфата меди и изменение цвета раствора при образовании комплексного сульфата тетраамин меди (ІІ). 2CuSO4 + 2NH4OH → Cu2(OH)2SO4↓ + (NH4)2SO4 Cu2(OH)2SO4 + 8NH4OH → [Cu(NH3)4(OH)2 + [Cu(NH3)4]SO4 + 8H2O цвет? Работа 2. Получение катионных комплексных соединений Опыт 4 а) Комплексное основание никеля. В пробирку внести 3-4 капли раствора сульфата никеля и такой же объём раствора гидроксида натрия. К осадку добавьте 5-6 капель 25% раствора гидроксида аммония. Что происходит? Сравните окраску ионов Ni+2 в растворе сульфата никеля с окраской полученного раствора. Напишите все уравнения реакций получения комплексного иона, если координационное число Ni+2 равно шести. б) Образование комплексного иона серебра к 3-4 каплям раствора нитрата серебра прибавьте 2-3 кали раствора НС1. что наблюдаете? К части полученного осадка прибавьте 10-12 кап. раствора аммиака. Что происходит? К полученному раствору добавьте раствор азотной кислоты до получения кислой среды. Какой эффект наблюдаете? Опишите все процессы в уравнениях реакций.
Работа 3. Получение анионных комплексных соединений Опыт 5. Получение гидроксокомплексов цинка, хрома и алюминия. В три пробирки поместите раздельно растворы солей цинка, хрома (ІІІ), алюминия и в каждую пробирку добавьте по каплям раствор гидроксида натрия. Наблюдайте вначале выпадение осадков гидроксидов, а затем их растворение в избытке щелочи. Напишите уравнения реакций, учитывая, что образуются растворимые гидроксокомплексы, содержащие ионы [Zn(OH)4]-2, [Cr(OH)4]-, [Al(OH)4]-. Опыт 6. Получение тетраиодвисмута калия В пробирку к 3-4 каплям раствора нитрата висмута прибавьте по каплям раствор иодида калия до выпадения осадка темно-бурого цвета иодида висмута. Растворите этот осадок, прибавив избыток раствора иодида калия. Напишите уравнения реакций образования комплекса висмута (ІІІ), если координационное число его равно 4. Определите заряд комплексного иона. Опыт 7. Получение внутрикомплексного соединения оксалата железа (ІІІ). В две пробирки внести по 5-7 капель раствора хлорида железа (ІІІ). Одну пробирку оставить для контроля. В другую пробирку добавить раствор гидроксида натрия до начала выпадения осадка. К полученному осадку прибавьте насыщенный раствор щавелевой кислоты. Наблюдается растворение осадка и обесцвечивание раствора. Проверьте присутствие ионов железа (ІІІ) в обоих пробирках, прибавлением раствора роданида калия. Во всех ли пробирках наблюдается образование окрашенного раствора? Напишите уравнения реакций в молекулярной и ионной формах, если формула комплексного иона железа имеет вид [Fe(C2O4)3]-3. Опыт 8. Разрушение комплекса при разбавлении раствора. Внести в пробирку 3 капли раствора нитрата серебра и добавить к нему раствор иодида калия по каплям до выпадения осадка, постоянно встряхивая пробирку. Выпавший вначале осадок растворяется. К полученному раствору добавьте 4-6 капель воды. что наблюдаете? Дайте объяснение и напишите уравнение реакций. Аналогичный опыт проделайте с раствором соли алюминия, получив вначале гидроксид алюминия. Опыт 9. Сравнение устойчивости аквакомплексов меди. в) В пробирку поместите небольшое количество безводного порошка сульфата меди и добавьте воды до половины пробирки. Раствор приобретает окраску за счет образования аквакомплекса меди. Составьте формулу этого комплекса и укажите составные части. Полученный раствор разделите на 3 пробирки. Одну оставьте для контроля. Во вторую по каплям добавьте раствор NH4OH, встряхивая каждый раз пробирку для лучшего перемешивания ее содержимого. В третью пробирку добавьте небольшое количество сухого хлорида натрия. Отметьте изменение цвета в обоих пробирках, напишите уравнения соответствующих реакций. Растворы во второй и третьей пробирках разбавьте водой. Что наблюдаете? Сделайте вывод об устойчивости аква-, амиачного и галогенидного комплексов меди.
Тесты для самоконтроля 1. Заряд комплексного иона в соединении K3[Fe(CN6)]: а) 1- б) 2-+ в) 3+- г) 1+ 2. Заряд иона комплексообразователя в соединении K4[Fe(CN)6 а) 1+ б) 2+ в) 3+ г) 4+ 3. Координационное число комплексообразователя в формуле: [Ag(NH3)2]CI а) 1 б) 2 в) 3 г) 4 4. Степень окисления комплексообразователя в комплексном соединении: К[В(С6Н5О)4] равна: а) +2, б) +3, в) -4, г) -2. 5. Комплексное соединение имеет формулу: а) AlCl3 б) Al(OH)2Cl в) Al(HCO3)3 г) K3[Al(OH)6] 6. Какие типы геометрии молекул возможны при sp3- гибридизации: а) тетраэдрическая, б) треугольная, в) линейная, г) угловая. 7. Лучшими комплексообразователями являются: а) s- элементы, б) p- элементы, в) d- элементы, г) f- элементы. 8. Комплексные соли при диссоциации образуют: а) простые ионы, б) комплексные ионы, в) не диссоциируют, г) нейтральные молекулы. 9. Степень окисления комплексообразователя в соединении [Cr(H2O)4]PO4 равна: а) +6, б) +3, в) +4, г) -4.
Литература ЛИТЕРАТУРА ОСНОВНАЯ 1. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для медицинских вузов. /Ю.А. Ершов, В.А. Попков, А.С. Берлянд и другие. Под ред. Ю.А. Ершова, 8 изд.,560 с. – М.: Высш. Шк., 2010. 2. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учебное пособие для студентов медицинских вузов.(Ред. В.А. Попков).- М., Высшая школа, 4 изд., 239 с., 2008 г. 3. Сборник задач и упражнений по общей химии. Учебное пособие. (С.А.Пузаков, В.А. Попков, А.А. Филиппова). М: Высшая школа, 4 изд., 255с., 2010г. 4. Глинка Н. Л. Общая химия. Изд-во «Химия», 1978., С. 49-56.
ЛИТЕРАТУРА ДОПОЛНИТЕЛЬНАЯ
1. Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузаков), 976с.-ГЭОТАР Медиа, 2007г. 2. Ахметов Н. С. Актуальные вопросы курса неорганической химии. М., Просвещение, 1991, С. 25-40. 3. Егоров А. С., Шацкая К. П. Химия. Пособие – репититор для поступающих в вузы 4. Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии М., 1998. С. 57-61. 5. Керенцева В. П. Строение вещества, Изд-во СГУ, 1980.
Комплексные соединения Цель занятия: Сформировать у студентов системные знания о строении и свойствах комплексных соединений. Научить студентов получать комплексные соединения и на основании поведения комплексных соединений в растворах делать выводы об их устойчивости. Обоснование темы. Комплексообразование имеет большое значение при протекании биологических процессов в живых организмах. Ионы щелочных и щелочно-земельных металлов в биологических жидкостях находятся в виде аквакомплексов, а ионы d-элементов, являясь прекрасными комплексообразователями, образуют комплексы, в которых в качестве лигандов выступают аминокислоты, нуклеиновые кислоты, витамины и гормоны. Например, железо входит в состав гемоглобина. Некоторые комплексные соединения обладают биологической активностью и применяются в качестве лекарственных препаратов (витамин В12). Кроме того, образование растворимых устойчивых комплексных соединений позволяет выводить из организма соли тяжелых металлов, что способствует дезинтоксикации организма.
Комплексные соединения это молекулярные или ионные соединения, образующиеся путем присоединения к атому или иону металла или неметалла, нейтральных молекул или других ионов. Они способны существовать как в кристалле, так и в растворе.
Основные положения и понятия координационной теории. Для объяснения строения и свойств комплексных соединений в 1893 г. швейцарским химиком А Вернером была предложена координационная теория в которую он ввел два понятия: о координации и о побочной валентности. По Вернеру главной валентностью называется валентность посредством которой соединяются атомы с образованием простых соединений, подчиняющихся теории валентности. Но, исчерпав главную валентность, атом способен, как правило, к дальнейшему присоединению за счет побочной валентности, в результате проявления которой и образуется комплексное соединение. Под действием сил главной и побочной валентности атомы стремятся равномерно окружить себя ионами или молекулами и являются таким образом центром притяжения. Такие атомы называются центральными или комплексообразователями. Ионы или молекулы, непосредственно связанные с комплексообразователем, называются лигандами. Посредством главной валентности присоединяются лиганды ионы, а посредством побочной валентности – ионы и молекулы. Притяжение лиганд к комплексообразователю называется координацией, а число лиганд – координационным числом комплексообразователя. Можно сказать, что комплексные соединения это соединения, молекулы которых состоят из центрального атома (или иона) непосредственно связанного с определённым числом других молекул или ионов, называемых лигандами. В роли комплексообразователей чаще всего выступают катионы металлов (Со+3, Рt+4, Cr+3, Cu+2Au+3 и др.) В качестве лигандов могут выступать ионы Cl-, CN-, NCS-, NO2-, OH-, SO42- так и нейтральные молекулы NH3, H2O, амины, аминокислоты, спирты, тиоспирты, РН3, эфиры. Число координационных мест, занимаемых лигандом около комплексообразователя, называется его координационной ёмкостью или дентатностью. Лиганды, присоединенные к комплексообразователю одной связью, занимают одно координационное месть и называются монодентатнымия (Cl-, CN-, NCS-). Если же лиганд присоединён к комплексообразователю посредством нескольких связей, то он является полидентатным. Например: SO42- , СО32-являются бидентатными. Комплексообразователь и лиганды составляют внутреннюю сферу соединения или комплекс (в формулах комплекс заключают в квадратные скобки). Ионы, не связанные непосредственно с комплексообразвателем, составляют внешнюю координационную сферу. Ионы внешней сферы связаны менее прочно по сравнению с лигандами и пространственно удалены от комплексообразователя. Они легко замещаются другими ионами в водных растворах. Например, в соединении К3[Fe(CN)6] комплексообразователем является Fe+2, лигандами - CN-. Два лиганда присоединены за счет главной валентности, а 4 – за счет побочной валентности, следовательно координационное число равно 6. Ион Fe+2 с лигандами CN- составляют внутреннюю сферу или комплекс, а ионы К+ внешнюю координационную сферу:
Как правило координационное число равно удвоенному заряду катиона металла, например: однозарядные катионы имеют координационное число равное 2, 2-х зарядные – 4, а 3-х зарядные – 6. если элемент проявляет переменную степень окисления, то с увеличением её координационное число растет. Для некоторых комплексообразователей координационное число является постоянным, например: Со+3, Рt+4, Cr+3 имеют координационное число равное 6, у ионов В+3, Ве+2, Сu+2 , Au+3 координационное число равно 4. для большинства ионов координационное число является переменным и зависит от природы ионов внешней сферы и от условий образования комплексов.
|
||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 200; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.192.89 (0.011 с.) |
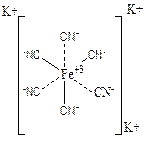 .
.


