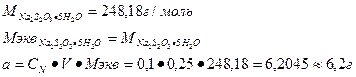Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Запишите реакцию, лежащую в основе метода йодометрии.
Запишите реакцию, лежащую в основе метода йодометрии. 2I- + Ох = І2 + Red 2. В каких случаях метод иодометрии применяется для определения окислителей, а в каких – для определения восстановителей? Приведите примеры. При определении восстановителей используют прямую реакцию: Запишите реакцию взаимодействия йода с тиосульфатом натрия. Уравняйте, применив метод полуреакций.
4. Допишите реакции и уравняйте, применив метод полуреакций: А) SО32- + I2 + Н2О → I2 + Na 2SО3 + Н2О = 2 НI + Na2SO4 Б) Sn2+ + I2 → Sn2+ + I2 → Sn4+ + 2 I- В) MnО42- + I- + Н+→ Г) СlО3- + Н+ + I- → Какие продукты образуются при взаимодействии бихромата калия с иодидом калия в сернокислой среде? Напишите уравнение соответствующей реакции.
6. По приведенным схемам составьте полные уравнения реакций:
В каких случаях и как проводится метод прямого титрования? Прямое титрование: определяют сильные восстановители, которые непосредственно титруют раствором йода в йодиде калия (KI). Так определяют сульфиды, сульфиты, тиосульфаты и другие сильные восстановители. Почему титрование в методе йодометрии нужно проводить на холоду? Титрование ведут на холоду, так как при нагревании йод может частично улетучиваться, а также потому что с повышением температуры понижается чувствительность крахмала как индикатора.
Почему титрованные растворы йода необходимо хранить в склянках из темного стекла? По какой реакции иодид калия окисляется кислородом воздуха?
На свету ускоряется окисление йода. 4I(-) + 4H(+) + O2 => 2I2 + 2H2O Свет ускоряет эту реакцию, поэтому реакционную смесь хранят в темноте.
Приведите формулу для расчета массы навески кристаллического тиосульфата натрия для приготовления раствора заданного объема и концентрации.
Запишите реакцию, лежащую в основе метода йодометрии. 2I- + Ох = І2 + Red 2. В каких случаях метод иодометрии применяется для определения окислителей, а в каких – для определения восстановителей? Приведите примеры. При определении восстановителей используют прямую реакцию:
|
|||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 560; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.142.17 (0.008 с.) |




 ; Br2 + 2KI = 2KBr + I2
; Br2 + 2KI = 2KBr + I2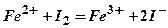 .
.