
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Карбонизация аммиачно-солевого раствораСодержание книги
Поиск на нашем сайте
Введение
Целью лабораторного практикума по курсу «Общая химическая технология» является закрепление теоретических знаний, знакомство с экспериментальными методами исследования химических процессов, выработка навыков обработки результатов экспериментов и расчета показателей эффективности процессов. Перед выполнением работы студенты знакомятся с теоретическими сведениями по теме лабораторной работы, схемой экспериментальной установки и методикой выполнения лабораторной работы, правилами техники безопасности при работе на установке. После беседы с преподавателем по этим вопросам студенты допускаются к работе на установке, выполняют экспериментальную часть работы, проводят обработку полученных результатов, рассчитывают необходимые показатели процесса и оформляют отчет.
Содержание отчета 1. Цель работы. 2. Теоретические сведения по теме работы. 3. Схема экспериментальной установки. 4. Методика выполнения работы. 5. Полученные результаты и их обработка. Расчет основных показателей процесса.
Титульный лист отчета по лабораторной работе оформляется по форме в соответствии с приложением А. Выполненная и оформленная работа защищается на следующем занятии или в часы консультаций. На защите студенты должны показать знание теоретических вопросов по теме лабораторной работы и практического ее выполнения. Контрольные вопросы приводятся в конце описания каждой лабораторной работы. Количество выполняемых работ зависит от специальности и формы обучения студентов и определяется рабочей учебной программой дисциплины. Лабораторная работа № 1
Карбонизация аммиачно-солевого раствора
Цель работы Ознакомление с процессом карбонизации, определение выхода гидрокарбоната натрия на лабораторной установке.
Теоретические сведения К содовым продуктам, в больших количествах вырабатываемых химической промышленностью, относятся кристаллическая сода (карбонат натрия) Наиболее важным содовым продуктом является кальцинированная сода. Единственным промышленным способом производства соды в настоящее время является аммиачный способ, практические основы которого были разработаны в конце XIX века бельгийским инженером Сольве, а теория процесса русским ученым П.П.Федотьевым и другими. Аммиачный способ производства соды включает следующие стадии. Раствор поваренной соли насыщается аммиаком (аммонизация), а затем углекислым газом (карбонизация). При этом выпадает осадок гидрокарбоната натрия.
Осадок гидрокарбоната натрия отфильтровывается и прокаливается (кальцинация).
При этом образуется конечный продукт Свежий углекислый газ получается обжигом известняка.
Полученная при обжиге известь гасится водой.
Известковое молоко используется для регенерации аммиака из маточного раствора после фильтрации гидрокарбоната натрия (дистилляция).
Полученный аммиак направляется на аммонизацию солевого раствора. Раствор хлорида кальция является отходом. Основной стадией аммиачно-содового производства является стадия карбонизации, описываемая суммарным уравнением (1.1). В свою очередь эта реакция протекает в несколько стадий. Стадия монокарбонизации.
Стадия бикарбонизации.
Обменное разложение.
Реакция (1.8) является обратимой. гетерогенной реакцией. Ее равновесие и равновесный выход осадка гидрокарбоната натрия определяются условиями растворимости в четырехкомпонентной системе В промышленных условиях основной технологический показатель (степень использования хлорида натрия) колеблется в пределах 65 - 75 %. Повысить его можно увеличением концентрации хлорида натрия в исходном рассоле, степени насыщения его аммиаком, повышением давления и содержания углекислого газа в газе, подаваемом на карбонизацию, а также снижением температуры в конце процесса карбонизации. Методика выполнения работы. Приготавливается 50 см3 аммонизированного рассола, содержащего 240 – 250 г/дм3
Рис. 1.1 Схема экспериментальной установки для карбонизации аммиачно-солевого раствора 1, 4 – буферные склянки, 2, 5 – гидравлические затворы, 3, 6, 8 – ротаметры, 7 – смеситель, 9 – абсорбер, 10 – поглотительная склянка, 11 – кран трехходовой.
открывается на выход в атмосферу, включается подача воздуха и с помощью ротаметра (3) устанавливается его расход. Из баллона подается углекислый газ и с помощью ротаметра (6) устанавливается его расход. Трехходовой кран (11) переключается на подачу газовой смеси в абсорбер (9), с помощью ротаметра (8) устанавливается ее расход. Процесс карбонизации продолжается в течение 1 – 1,5 часов. По окончании карбонизации осадок гидрокарбоната отфильтровывается на воронке Бюхнера при помощи вакуумного насоса. Осадок гидрокарбоната промывается насыщенным раствором гидрокарбоната натрия, сушится при температуре 40 – 50оС и взвешивается. Маточный раствор после фильтрации осадка гидрокарбоната натрия анализируется на содержание свободного и полусвязанного аммиака. Анализ проводится аналогично анализу исходного раствора на содержание аммиака. Для анализа отбирается проба раствора объемом 2 см3 в коническую колбу, добавляется 10 см3 дистиллированной воды и 1 – 2 капли метилового оранжевого, после чего титруется 1н раствором соляной кислоты до перехода желтой окраски в розовую. При титровании свободный и полусвязанный аммиак нейтрализуется кислотой:
Техника безопасности 1. Приготовление аммонизированного раствора следует проводить в вытяжном шкафу. 2. Не открывать самостоятельно баллон с углекислым газом. Для выполнения этой операции пригласить лаборанта или преподавателя. 3. Не перекрывать (не пережимать) трубку, ведущую от газовой линии в гидрозатвор (во избежание чрезмерного повышения давления и возможного при этом разрыва стеклянных сосудов). 1.7 Контрольные вопросы 1. Из каких основных стадий складывается аммиачный способ производства соды? Составить уравнения соответствующих реакций. 2. Дать характеристику стадии карбонизации как основной стадии аммиачно-содового производства. 3. От каких факторов зависит состояние равновесия процесса карбонизации и равновесная степень превращения хлорида натрия в гидрокарбонат натрия. 4. От каких факторов зависит скорость процесса карбонизации?
Литература. 1. Мухленов И.П. и др. Общая химическая технология. – М.: Высшая школа, 1970, с. 379 – 391. 2. Зайцев И.Д. и др. Производство соды. – М.: Химия, 1986, с. 21 – 24, 104 – 112. 3. Мухленов И.П. и др. Практикум по общей химической технологии. – М.: Высшая школа, 1973, с. 30 – 39.
Лабораторная работа № 2 Никелирование металлов
Цель работы Ознакомление с процессом электрохимическо никелирования металлов, определение выхода по току и толщины покрытия.
Теоретические сведения Никелирование металлов широко применяется в технике при защитнодекоративной отделке изделий машиностроения, приборостроения, а также предметов широкого потребления. Это объясняется тем, что хотя никель относится к числу электроотрицательных металлов ( В гальванической паре никель – железо никель является катодным покрытием и, следовательно, может защищать железо лишь при условии отсутствия оголенных участков и пор. Поэтому никелевое покрытие должно обладать минимальной пористостью. Это условие может быть соблюдено при правильном ведении процесса никелирования и определенной толщине слоя никеля. Для никелевого покрытия без подслоя на стали она колеблется в пределах 12 – 36 мкм. Для уменьшения пористости на стали осаждают сначала слой меди, а затем уже слой никеля. В этих условиях никелевые покрытия наносятся меньшей толщины. Суммарная толщина никеля и меди при этом не должна быть меньше положенной толщины никеля, толщина же наружного слоя никеля должна составлять не менее половины от суммарной толщины. Никелевое покрытие хорошо полируется и может быть легко доведено до зеркального блеска. Никелирование применяется также для защиты химической аппаратуры от действия щелочных растворов, в полиграфическом производстве для повышения поверхностной твердости и сопротивления износу гартовых стереотипов и клише, а также в качестве подслоя при хромировании. Никелирование может осуществляться как электрохимическим, так и химическим методом. По химическому методу восстановление сульфата никеля до металла происходит с помощью гипофосфита натрия:
Основным преимуществом химического никелирования является возможность осаждения никеля равномерным слоем на изделиях любой конфигурации, в том числе и на внутренних стенках полых изделий. Однако этот метод дорог, и осаждение никеля в основном производится электрохимическим методом. Электрохимический метод основан на электролизе водных растворов солей никеля. Чаще всего используются сернокислые никелевые электролиты основным компонентом, которых является Наиболее часто используется электролит состава:
При электролизе катодом является покрываемое изделие (стальная пластинка, в качестве анода используется никелевая пластинка. На электродах протекают следующие процессы. Катод:
Основным показателем эффективности процесса никелирования является выход никеля по току. Выход по току – это отношение массы фактически полученного продукта (никеля) к теоретической массе продукта, который должен был получиться по закону Фарадея.
где
По закону Фарадея
где
Для никеля Из (2.2) и (2.3) следует:
Выход по току зависит от плотности тока, температуры электролита, pH раствора. Электролит описанного выше состава имеет рН = 5,5. При температуре 20 – 25оС и плотности тока 0,5 – 1,0 А/дм2 получаются доброкачественные покрытия с выходом по току до 95%. При подогревании до 40оС и перемешивании катодная плотность тока может быть увеличена до 2,5 А/дм2. При рН > 6 из электролита выпадает осадок гидроксида никеля, при рН = 4 покрытие получается блестящим, но не прочным в связи с точечной пористостью. При дальнейшем снижении рН (в сильнокислых растворах) резко снижается выход никеля по току в связи с увеличением выхода водорода. Для блестящего никелирования в электролит вводится добавка натриевой соли 2,6 (2,7) дисульфонафталиновой кислоты. Еще лучшие результаты дают добавки паратолуолсульфамида и кумарина, а также сахарина и пропинола или бутиндиола; в этих электролитах осадки получаются с высоким зеркальным блеском, при этом повышается чистота покрываемой поверхности, так как этот электролит обладает выравнивающими свойствами. Никелевый электролит очень чувствителен к примесям. Так наличие железа в электролите приводит к отслаиванию и растрескиванию покрытия. Примесь меди и цинка вызывает образование пятнистых, полосчатых темносерых и черных осадков никеля. Загрязнение электролита органическими соединениями, наличие в нем взвешенных частиц, а также отклонения от режима электролиза (по рН и температуре) могут привести к образованию точечной пористости (“питтинга“). Это обусловлено прилипанием к покрываемой поверхности пузырьков водорода, которые экранируют поверхность основы и препятствуют осаждению в этом месте никеля. “Питтинг“ может быть удален при перемешивании электролита, а также введением пероксида водорода (1 см3 10 % - ного раствора на 1 дм3 электролита).
Методика выполнения работы Стальная пластинка, подвергаемая никелированию, предварительно тщательно зачищается наждачной бумагой, поверхность пластинки протирается фильтровальной бумагой, а затем обезжиривается органическими растворителями или горячим раствором щелочи, после чего протирается пастой (смесь соды с мелом) и промывается водой. После этого производится омеднение пластинки, для чего она опускается на 1 – 2 минуты в ванночку с раствором сульфата меди. Затем пластинка промывается водой, высушивается и взвешивается на аналитических весах. Аналогичная подготовка (без омеднения) осуществляется с медным катодом кулометра. Подготовленная стальная пластинка устанавливается в катодный (средний) зажим электролизера. Медный катод устанавливается в катодный зажим кулометра. При этом катодные пластинки должны быть установлены параллельно с анодными. Выводы электролизера и кулометра соединяются последовательно, концы соединительных проводов подсоединяются к выводным клеммам постоянного тока выпрямителя. В электролизер и кулометр заливаются растворы соответствующих электролитов с таким расчетом, чтобы электродные пластинки были погружены в растворы примерно на три четверти их высоты. Крышки с электродами устанавливаются в стаканы, включается сетевой выключатель выпрямителя, и с помощью регулятора напряжения устанавливается сила тока с таким рассчетом, чтобы катодная плотность тока в электролизере находилась в пределах 0,5 – 1,0 А/дм2 (определяется предварительным расчетом). Процесс никелирования продолжается в течение 0,5 – 1,0 часа. По окончании процесса выпрямитель выключается, катодные пластинки электролизера и кулометра отсоединяются, промываются водой, высушиваются и взвешиваются. По разности двух взвешиваний определяются массы никеля, осажденного на стальной пластинке, и меди, осажденной на катоде кулометра.
Техника безопасности 1. Корпус выпрямителя должен иметь защитное заземление. 2. Установку электродов необходимо проводить только при выключенном выпрямителе. Следить за правильным положением электродов. 3. Внимательно следить за состоянием изоляции всех проводников, и их правильным соединением. 4. Работу с растворами электролитов проводить в резиновых перчатках избегать попадания брызг электролита на кожу и одежду.
2.7 Контрольные вопросы 1. С какой целью проводится никелирование металлических изделий? 2. Какими методами может осуществляться никелирование? 3. Химический метод никелирования. Его достоинства и недостатки. 4. Электрохимический метод никелирования. Электродные процессы при никелировании. 5. Состав электролитов, используемых для никелирования. 6. Выход по току. Факторы, от которых он зависит. 7. Качество никелевого покрытия. Условия получения качественного покрытия. 8. Электродные процессы, протекающие в кулометре. Для чего он используется? 9. Вывести формулу (2.8) для определения толщины никелевого покрытия.
Литература. 1. Федотьев И.П. и др. Прикладная электрохимия. – Л.: Химия, 1967, с.75 – 81, 181 – 188. 2. Мухленов И.П. и др. Практикум по общей химической технологии. – М.: Высшая школа, 1973, с.266 – 274.
Лабораторная работа № 3 Сухая перегонка древесины
Цель работы Ознакомление с процессом пиролиза древесины, составление материального баланса процесса, расчет выхода продуктов пиролиза.
Теоретические сведения Сухая перегонка (или пиролиз) древесины – это процесс разложения древесины при нагревании без доступа воздуха. Как и другие процессы пиролиза, сухая перегонка древесины представляет собой сложный гетерогенный высокотемпературный процесс. В результате перегонки получаются обогащенный углеродом твердый продукт (древесный уголь), жидкие продукты (смолы, вода, метиловый спирт, уксусная кислота, ацетон и др.) и газы (оксид и диоксид углерода, метан, водород и др.). Характер и свойства выделяющихся в ходе пиролиза продуктов определяются температурой нагрева древесины. При температуре 100 – 170оС наблюдается слабое разложение древесины и выделяются водяные пары. В интервале 170 – 270оС происходит ускорение процесса, наблюдается заметное разложение древесины с выделением небольшого количества уксусной кислоты и газа, состоящего на одну треть из оксида углерода и на две трети из диоксида углерода. При температурах до 270оС процесс разложения древесины идет с поглощением тепла. При температурах выше 270оС начинают протекать экзотермические процессы, приводящие к быстрому обугливанию древесины В интервале 280 – 380оС происходит обильное выделение паров уксусной кислоты, метилового спирта, ацетона, а также легкой смолы и углеводородов. При температурах 380 – 500оС выделяются газообразные продукты и образуется небольшое количество тяжелой смолы. В газообразных продуктах уменьшается содержание оксида и диоксида углерода и возрастает содержание углеводородов (метан, этан, этилен и др.). В интервале 500 – 700оС происходит разложение летучих продуктов с образованием водорода (раскаленный уголь катализирует этот процесс). На практике обычно ограничиваются нагреванием древесины до 400 – 450оС. Парогазовая смесь при охлаждении разделяется на конденсат и неконденсирующиеся газы. Конденсат при отстаивании образует два слоя: смолу и водный конденсат. Лиственные породы дают смолу более тяжелую, чем водный конденсат, который в связи с этим называется надсмольной водой. Хвойные породы, наоборот, дают более легкую смолу и соответственно надсмольную воду. Основные компоненты конденсата: вода, растворенная смола, уксусная кислота, ацетон, метиловый и аллиловый спирты, альдегиды, метилацетон. Наибольший практический интерес представляют метиловый спирт и уксусная кислота. В конденсате лиственных пород содержится около 3% метилового спирта и до 10% уксусной кислоты. В конденсате хвойных пород содержится до 1,5% метилового спирта и до 4% уксусной кислоты (от массы древесины). Смола представляет собой жидкость от желтого до черного цвета. Она содержит алифатические углеводороды, фенолы, терпены и т.п. Смола хвойных пород содержит скипидар и продукты перегонки канифоли, отсутствующие в смоле лиственных пород. Из смолы получают ценные продукты: креозот, гваякол, терпены и др. Выход продуктов сухой перегонки зависит от скорости подъема температуры, т.е. от продолжительности процесса. При медленном нагреве возрастает количество вторичных реакций, что уменьшает выход смолы и увеличивает выход угля. Твердая фаза (древесный уголь) состоит из углерода, неорганических веществ (зола) и остаточного количества летучих. Состав угля мало зависит от породы древесины. Древесный уголь используется для получения активных углей, широко использующихся в качестве адсорбентов, а также как топливо и восстановитель. Методика выполнения работы Предварительно очищенный контейнер (3) взвешивается на техно-химических весах, заполняется опилками, снова взвешивается и устанавливается в печь (1). Печь закрывается крышкой (2) с помощью зажимов. Сборник жидких продуктов (9) также взвешивается и подсоединяется к холодильнику (8) и газометру (11), заполненному раствором хлорида натрия.
1 – электрическая печь, 2 – крышка, 3 – контейнер, 4 – электро- нагреватель, 5 – автотрансформатор, 6 – термопара, 7 – измерительный прибор, 8 – холодильник, 9 – сборник жидкости, 10 – сосуд с водой, 11 – газометр, 12 – манометр, 13 – кран, 14 – сливной сосуд.
Собранная установка проверяется на герметичность. Для этого открывается кран (13) и ведется наблюдение за показаниями манометра (12). Если вакуум, полученный при вытекании жидкости из газометра, устойчиво сохраняется после закрывания крана (13), установка считается герметичной. Если установка герметична, включается электрообогрев печи и ведется наблюдение за изменением температуры, выделением газов и паров, при этом с помощью крана (13) регулируется сток жидкости из газометра таким образом, чтобы в нем поддерживался небольшой вакуум 3–5 мм водяного столба. По достижении температуры 400оС электрообогрев печи отключается, и печь охлаждается до температуры 100оС, после чего крышка печи открывается, контейнер извлекается из печи, охлаждается до комнатной температуры и взвешивается. Сборник жидкости отсоединяется от холодильника и газометра и взвешивается.
Техника безопасности 1. Установка должна располагаться в вытяжном шкафу или иметь местную вытяжку. 2. Корпус электрической печи должен иметь защитное заземление. 3. Нельзя прикасаться руками к деталям корпуса электрической печи, не имеющим тепловой изоляции.
3.7 Контрольные вопросы 1. Что такое сухая перегонка древесины? 2. Дать характеристику твердого продукта перегонки, назвать области применения древесного угля. 3. Жидкие продукты перегонки, их характеристика и использование. 4. Газообразные продукты перегонки, их состав. Литература 1. Мухленов И.П. и др. Практикум по общей химической технологии. – М.: Высшая школа, 1967, с. 119 – 125. 2. Мухленов И.П. и др. Общая химическая технология. – М.: Высшая школа, 1979, с.158 – 159.
Лабораторная работа № 4
Цель работы Ознакомление с процессом некаталитической поликонденсации и получением полисульфидных каучуков, определение выхода тиокола.
Теоретические сведения Высокомолекулярными соединениями (ВМС) или полимерами называются соединения, молекулы которых состоят из многократно повторяющихся структурных единиц (элементарных звеньев):
где
Молекулярная масса полимера (M) равна произведению молекулярной массы элементарного звена (
Степень полимеризации обычно измеряется десятками, сотнями или тысячами единиц, а молекулярная масса макромолекул - сотнями, тысячами, а иногда миллионами. По происхождению полимеры подразделяются на природные (крахмал, целлюлоза, белки, натуральный каучук, силикаты), искусственные (получаемые переработкой природных полимеров) и синтетические (получаемые синтетическим путем из низкомолекулярных соединений). По структуре молекул полимеры могут быть линейными (каждое звено соединено с двумя соседними), разветвленными (основная цепь имеет боковые ответвления меньшей длины, чем основная) и пространственными (между линейными цепями имеются поперечные связи). По химическому составу главной цепи полимеры можно разбить на три группы: карбоцепные (главная цепь состоит только из атомов углерода), гетероцепные (главная цепь кроме атомов углерода содержит атомы других элементов, например, атомы кислорода, азота, серы, фосфора и др.). элементоорганические (главная цепь не содержит атомов углерода, а состоит из атомов других элементов, например, атомов кремния и кислорода, а атомы углерода находятся в боковых цепях). Свойства полимеров зависят не только от химического состава элементарных звеньев, но и от степени полимеризации, а также от строения молекул. Увеличение молекулярной массы полимера увеличивает механическую прочность, твердость, термическую устойчивость полимера, уменьшает его растворимость в растворителях. То же наблюдается при образовании пространственных структур вследствие возникновения поперечных связей между линейными цепями. Если элементарные звенья не содержат полярных групп, то полимерные цепи обладают гибкостью, а полимер характеризуется эластичностью, морозоустойчивостью, высокими диэлектрическими свойствами. Наличие полярных групп, например, Наличие атомов галогенов в элементарных звеньях придает полимерам устойчивость к горению, действию кислот и щелочей. Для полимеров чаще всего характерно неупорядоченное расположение макромолекул, т.е. аморфное (стеклообразное) состояние. При нагревании стеклообразное состояние переходит в высокоэластичное, а затем в вязкотекучее состояние. При охлаждении происходят обратные переходы. Если такие превращения могут осуществляться многократно, то полимер называется термопластичным. Полимеры, которые находятся в высокоэластичном состоянии при обычной температуре, называются эластомерами. Пластомеры, напротив, при обычной температуре имеют повышенную прочность, высокий модуль упругости и слабую растворимость. Если при нагревании полимер переходит в высокоэластичное состояние, а затем затвердевает и теряет способность переходить в высокоэластичное состояние, то он называется термореактивным. Обычно это объясняется образованием пространственной структуры. Высокомолекулярные соединения получаются из низкомолекулярных соединений (мономеров) двумя основными способами: полимеризацией и поликонденсацией. Полимеризация – это процесс соединения многих молекул мономера в молекулу полимера того же элементарного состава. При этом не образуется побочных продуктов. Обычно полимеризации подвергаются ненасыщенные соединения, содержащие двойную связь между атомами углерода, реже – тройную или систему сопряженных двойных связей. Наибольшее практическое значение имеет полимеризация этилена и его замещенных (винильных соединений), а также полимеризация диенов.
Большинство полимеров поликонденсационного типа являются термопластичными. Полиэтилен используется для получения пленок. Бутадиен и его производные являются мономерами для синтеза каучуков. Поликонденсация – процесс взаимодействия двух или более мономеров, в результате которого наряду с полимером образуются низкомолекулярные побочные продукты, например, вода, аммиак, метанол. Для того, чтобы мономеры могли участвовать в реакции поликонденсации, они должны быть полифункциональными, т.е. иметь несколько функциональных групп. Например дикарбоновые кислоты и двухатомные спирты (гликоли) могут реагировать по схеме:
Процесс поликонденсации протекает ступенчато, цепь растет в результате последовательного присоединения молекул мономеров к цепи. В большинстве случаев поликонденсация является обратимым процессом т.е. одновременно с ней протекают процессы деструкции, при которых степень поликонденсации уменьшается. При поликонденсации большое значение имеет соотношение исходных мономеров. При избытке одного из них степень поликонденсации снижается вследствие присоединения к обоим концам макромолекулы одинаковых функциональных групп. При повышении температуры процесс поликонденсации сдвигается в сторону образования полимера, так как при этом снижается вязкость среды и ускоряется удаление из зоны реакции низкомолекулярных побочных продуктов. Однако при высоких температурах могут ускоряться процессы деструкции. Степень поликонденсации также возрастает при увеличении продолжительности процесса. Поликонденсация может проводиться как в присутствии катализаторов (получение фенолоформальдегидных и карбамидных смол), так и без них (получение полиамидных смол). Методом поликонденсации получаются некоторые специальные каучуки, например, полисульфидные каучуки (тиоколы). В качестве исходных реагентов при этом используются дигалоидалкилы и полисульфиды металлов. При взаимодействии дихлорэтана и тетрасульфида натрия реакция поликонденсации протекает по схеме:
Процесс поликонденсации протекает с выделением тепла, поэтому он проводится эмульсионным способом в инертной дисперсионной среде, что позволяет легко регулировать температуру процесса и получать однородный продукт в виде легко рассеивающейся суспензии, которая легко коагулирует при добавлении электролита (кислоты). В качестве диспергаторов используются гидроксиды (оксиды) или карбонаты магния, а также других щелочноземельных металлов. Получаемые полимеры характеризуются линейной структурой и каучукоподобными свойствами. Они способны вулканизироваться при помощи оксидов металлов (обычно оксида цинка). Тиоколовые пленки после вулканизации обладают высокой влаго- и газонепроницаемостью, превышающей аналогичные свойства вулканизатов натурального или бутадиенового каучуков. Тиоколы устойчивы к действию озона, солнечного света и различных окислителей. Наличие в молекулах тиоколов большого количества полярных атомов серы обеспечивает высокую стойкость к набуханию в водных растворах, маслах и топливах. При составлении резиновых смесей в тиоколы вводят наполнители и пластификаторы. Тиоколы используются для гуммирования аппаратов, изготовления бензо-, маслостойких изделий и деталей (шланги, рукава). Жидкие тиоколы применяются для герметизации, уплотнения, а также в качестве замазок.
Методика выполнения работы Работа начинается с получения раствора тетрасульфида натрия
В фарфоровую чашку вносится 50 см3 воды, доводится до кипения, после чего осторожно порциями добавляется 15,5 г гидроксида натрия. В полученный раствор вводится порциями заранее рассчитанное количество серы с избытком (10%) по отношению к стехиометрическому количеству по уравнению реакции (4.7). Образовавшийся раствор бурого цвета охлаждается до 30 – 40оС и фильтруется через гигроскопическую вату. Профильтрованный раствор переносится в круглодонную колбу установленную в водяной бане, к колбе подсоединяется обратный холодильник с мешалкой и электродвигателем. Водяная баня нагревается до 70оС. Через боковой вход в колбу вносится в качестве диспергатора оксид магния в количестве 2% (масс.) от суммарной массы гидроксида натрия и серы. После этого к боковому входу подсоединяется капельная воронка, включается электродвигатель и при энергичном перемешивании через капельную воронку вводится 10 см3 дихлорэтана со скоростью 8 – 10 капель в минуту. В ходе процесса в водяной бане поддерживается температура 70оС По окончании процесса содержимое колбы переносится в фарфоровую чашку, верхний слой сливается, оставшийся тиокол несколько раз промывается теплой (40 – 50оС) водой, 2 – 3% раствором соляной кислоты (20 см3) до нейтральной реакции, затем снова 3 – 4 раза теплой водой. Полученный тиокол высушивается при комнатной температуре и взвешивается. Для испытания свойств тиокола в несколько пробирок вносятся пробы по 0,2 г тиокола, приливается по 1 – 2 см3 растворителей (бензин, бензол, хлороформ, четыреххлористый углерод, хлорбензол, ацетон, уксусная кислота, 5%-, 10%-, 20%-ные растворы серной и соляной кислот и гидроксида натрия) и через 15 – 20 отмечаются наблюдаемые изменения (растворяется, набухает или не изменяется).
Техника безопасности 1. Установка должна располагаться в вытяжном шкафу. 2. Все операции, связанные с приготовлением растворов, синтезом тиокола и испытанием его свойств должны проводиться при включенной вентиляции. 3. При растворении гидроксида натрия в горячей воде добавлять его к воде небольшими порциями и во избежание попадания брызг раствора на кожу рук или в глаза пользоваться за
|
||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 446; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.235.104 (0.02 с.) |

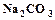 , пищевая сода (гидрокарбонат натрия)
, пищевая сода (гидрокарбонат натрия) 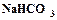 , кристаллическая сода
, кристаллическая сода 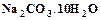 , тяжелая сода
, тяжелая сода 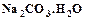 , каустическая сода (едкий натр)
, каустическая сода (едкий натр) 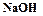 .
.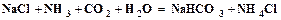 . (1.1)
. (1.1)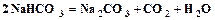 . (1.2)
. (1.2)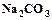 (кальцинированная сода) и углекислый газ, который возвращается на стадию карбонизации.
(кальцинированная сода) и углекислый газ, который возвращается на стадию карбонизации.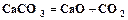 . (1.3)
. (1.3)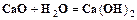 . (1.4)
. (1.4)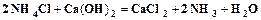 . (1.5)
. (1.5)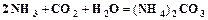 . (1.6)
. (1.6)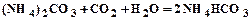 . (1.7)
. (1.7)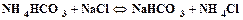 . (1.8)
. (1.8)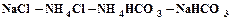 , которая была изучена П.П.Федотьевым. Выход гидрокарбоната натрия (или степень превращения
, которая была изучена П.П.Федотьевым. Выход гидрокарбоната натрия (или степень превращения 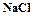 в осадок
в осадок 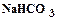 ) зависит от температуры и концентрации
) зависит от температуры и концентрации 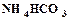 в растворе. Наивысший равновесный выход
в растворе. Наивысший равновесный выход 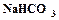 достигается при температуре 32оС и равен 84%.
достигается при температуре 32оС и равен 84%.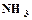 . Раствор анализируется на содержание аммиака и заливается в абсорбер (9). Трехходовой кран
. Раствор анализируется на содержание аммиака и заливается в абсорбер (9). Трехходовой кран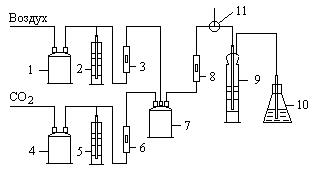
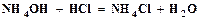 , (1.9)
, (1.9)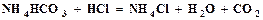 , (1.10)
, (1.10)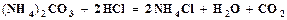 . (1.11)
. (1.11)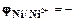 0,23В), однако в обычных атмосферных условиях, благодаря пассивированию, он длительное время сохраняет свой блеск.
0,23В), однако в обычных атмосферных условиях, благодаря пассивированию, он длительное время сохраняет свой блеск.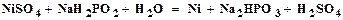 (2.1)
(2.1)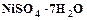 . Для повышения электропроводности вводятся сульфаты натрия, магния, аммония. Для устранения пассивирования никелевых анодов вводятся хлориды натрия, калия, никеля. Для предотвращения выпадения основных соединений никеля в электролит добавляется борная кислота.
. Для повышения электропроводности вводятся сульфаты натрия, магния, аммония. Для устранения пассивирования никелевых анодов вводятся хлориды натрия, калия, никеля. Для предотвращения выпадения основных соединений никеля в электролит добавляется борная кислота.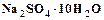 80 – 160 (г/дм3),
80 – 160 (г/дм3), 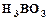 20 (г/дм3).
20 (г/дм3).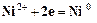 , Анод:
, Анод: 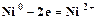 , (2.2)
, (2.2)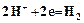 .
. 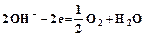 .
.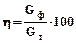 (2.3)
(2.3)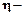 выход по току (%),
выход по току (%),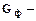 масса фактически полученного продукта (г),
масса фактически полученного продукта (г),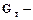 теоретическая масса продукта (г).
теоретическая масса продукта (г).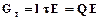 (2.4)
(2.4)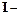 сила тока (А),
сила тока (А),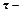 продолжительность процесса (час)
продолжительность процесса (час)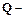 количество электричества, прошедшего через электролит (А.час),
количество электричества, прошедшего через электролит (А.час),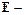 электрохимический эквивалент продукта (г/А.час).
электрохимический эквивалент продукта (г/А.час).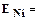 1,095 г/А.час.
1,095 г/А.час.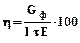 (2.5)
(2.5)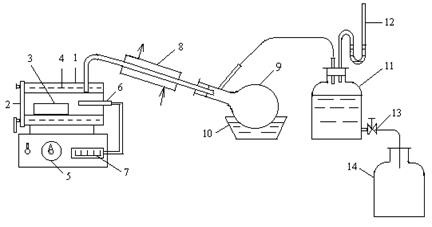
 или
или  ,
, элементарное звено,
элементарное звено,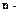 степень полимеризации.
степень полимеризации.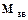 ) на степень полимеризации:
) на степень полимеризации: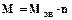 . (4.1)
. (4.1)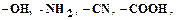 придает элементарным звеньям свойства диполей, увеличивает силы межмолекулярного взаимодействия, что способствует увеличению прочности и теплостойкости, но снижает диэлектрические свойства.
придает элементарным звеньям свойства диполей, увеличивает силы межмолекулярного взаимодействия, что способствует увеличению прочности и теплостойкости, но снижает диэлектрические свойства.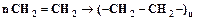 , (4.2)
, (4.2)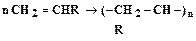 , (4.3)
, (4.3)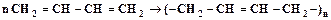 . (4.4)
. (4.4)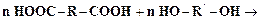
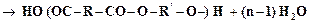 . (4.5)
. (4.5)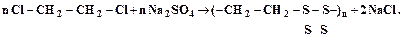 (4.6)
(4.6)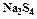 . Он образуется при нагревании элементарной серы с концентрированным раствором гидроксида натрия по следующему суммарному уравнению:
. Он образуется при нагревании элементарной серы с концентрированным раствором гидроксида натрия по следующему суммарному уравнению: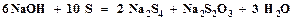 . (4.7)
. (4.7)


