Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Институт техносферной безопасностиСодержание книги
Поиск на нашем сайте
Институт техносферной безопасности Кафедра химии метрологии и стандартизации
Неорганическая химия
Методические указания по изучению дисциплины, вопросы химических диктантов, тесты и контрольные задания для самостоятельной работы, бакалавров первого курса направления 19.03.04 – технология продукции и организации общественного питания
Краснодар
Составители: д.т.н., проф. Т.Н. Боковикова к.х.н., доц. Л.А. Марченко
Общая и неорганическая химия: Методические указания по изучению дисциплины, вопросы химических диктантов, тесты и контрольные задания для самостоятельной работы, бакалавров всех форм обучения направления 19. 03.04– технология продукции и организации общественного питания. : /Сост. Т.Н. Боковикова, Л.А. Марченко, Кубан. гос. технол. ун-т. каф. Химии, метрологии и стандартизации.-2014.URL:http// www. moodle.ru/kubstu/ru
Табл. 7. Библиогр. назв. 10, Приложений 5
Содержание
Введение Внедрение в учебный процесс государственного образовательного стандарта третьего поколения для студентов технологических специаль-ностей требует создания новых учебных материалов по общей и неорга-нической химии, которые учитывали бы требования, предъявляемые к самостоятельной работе студентов, в рамках выделенных часов, отводимых для подготовки к практическим, лабораторным занятиям и экзаменам. Методические указания составлены с учетом образовательных программ и учитывают уровень знаний студентов по таким темам как классы неорганических соединений, строение атома, периодическая система, химическая связь, растворы, окислительно-восстановительные реакции, комплексные соединения, электрохимия, химия элементов. Для проверки усвоения материала полезно восстановить в памяти основные положения прочитанного в лекции, ответить на предложенные вопросы по каждой теме и выполнить контрольные задания.
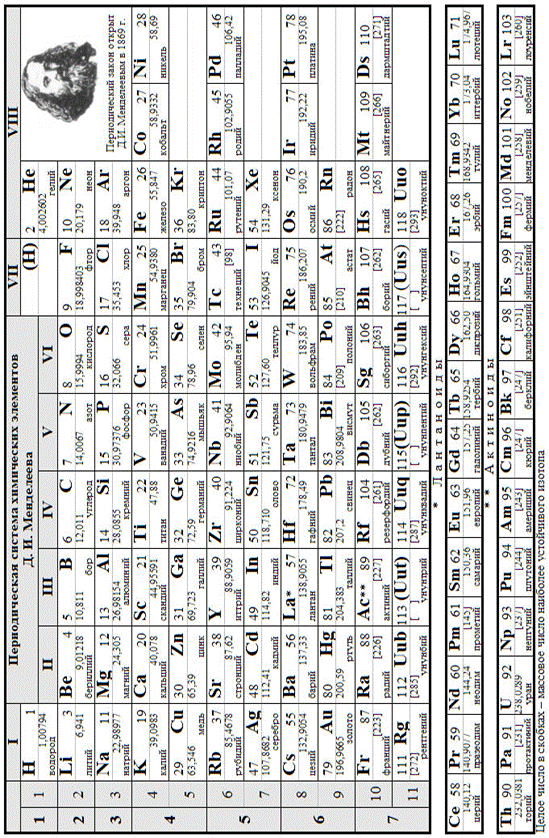
Задание 1 СТРОЕНИЕ АТОМА. ХИМИЧЕСКАЯ СВЯЗЬ Классы неорганических соединений Вопрос 1
Nа2НРO4 P 2O5– кислотный оксид; оксид фосфора (V); H3 РO4– кислотный гидроксид;ортофосфорная кислота; Na 3 РO4 – средняя соль; фосфат натрия. Nа 2 НРO4 – кислая соль; гидрофосфат натрия. Nа H2 РO4– кислая соль; дигидрофосфат натрия H3 РO4 + 3NaOH = Na3РO4 + 3H2O H3 РO4 + 3OH- = 3H2O + РO4 3- H3 РO4 + HCl = реакция не идет Вопрос 2 Даны Zn(OH)2 и H2SO4 Zn(OH)2 – двухкислотное основание – образует два ряда солей- средние и основные. Средняя соль ZnSO4, сульфат цинка; основная соль (ZnOH)2SO4, гидроксосульфат цинка. H2SO4 – двухосновная кислота, образует два ряда солей – средние и кислые, кислая соль Zn(HSO4)2, гидросульфат цинка.
Вопрос 3 Осуществить превращения Al→Al(NO3)3→AlOH(NO3)2→ Al(OH)3 → Al2 (SO4) Сr(NO3)3 + Al → Al(NO3)3 + Сr Al(NO3)3 + NaOH нед. →AlOH(NO3)2 + NaNO3 Al3+ + OH- + 2NO3- = AlOH(NO3)2 AlOH(NO3)2 +2 NaOH= Al(OH)3 + 2NaNO3 AlOH(NO3)2 + 2OH- = Al(OH)3 + 2NO3- 2Al(OH)3 +3H2SO4 = Al2 (SO4) 3 +6H2O 2Al(OH)3 + 6 H+ = 2 Al3+ + 6H2O Задание 3 ОБЩИЕ СВОЙСТВА РАСТВОРОВ Решение
1. Pb(NO3)2 + 2HCl ® PbCl2¯ + HNO3; 2. PbCl2 (тв.) Û Pb2+ + 2Cl–; 3. ПР(PbCl2) =[Pb2+] . [Cl–]2 = 1,6 . 10–5; 4. Соль и кислота – сильные электролиты: Pb(NO3)2 Û Pb2+ + 2NO3–; HCl Û Н+ + Cl–; поэтому: С0(Pb2+) = 0,01 моль/дм3; С0(Cl–) = 0,02 моль/дм3. При сливании общий объем раствора увеличился вдвое. Следовательно, после сливания растворов концентрации ионов уменьшились вдвое и стали равны:
5. Пс = С(Pb2+) . С2(Cl–) = 0,005 . (0,01)2 = 5 . 10–7; 6. 5 . 10–7 < 1,6 . 10–5; Пс < ПР Ответ: полученный раствор является ненасыщенным, осадок не образуется. Задание 4. Вопрос 1. Составьте уравнение диссоциации следующих соединений Sn(OH)2, CrCl3: Н+ + НSnО2 - ↓↑ ↑↓ Н+ + SnО2 2 - Sn 2+ +OH-
Al2(SO4)3 → 2Al3+ + 3SO4 2- Вопрос 2. Напишите молекулярные и ионные уравнения реакций обмена:↓ 3KOH + Cr(OH)3 = K3 [Cr(OH)6] Cr(OH)3 + 3OH- = [Cr(OH)6] 3- Вопрос 3. Напишите молекулярные и ионные уравнения реакций гидролиза: Fe 2(SO4)3 + 2H2O Fe3+ + HOH
NH4Cl + H2O Na2S + H2O
CH3COONH4 + H2O < — > CH3COOH + NH4OH
2 AlCl3 + 3Na2CO3 + 3H2O → 2 Al (OH)3 + 3CO 2 + 6NaCl 2 Al3+ + 3CO32– + 3H2O → 2 Al (OH)3 + 3CO 2.
Задание 5. Вопрос 1 +7N…2s22р3 +7N-1…2s22р4 , NH2OH может быть и окислителем и восстановителем. Реакция, в которой NH2OH - окислитель 2NH2OH+4FeSO4+3H2SO4 = 2Fe2(SO4)3+(NH4)2SO4+H2O
1 2NH2OH+6H++4 ē =2NH+4+H2O 2NH2OH+4Fe2++6H+=2NH4++Fe3+ Реакция, в которой NH2OH – восстановитель.
1 2NH2OH + 2OH− −2 ē = N2 + 4 H2O 1 __ I2 + 2ē = 2I− ___________________ 2NH2OH + I2 + 2OH− = N2 + 2I−+ 4 H2O Вопрос 2
2KМnO4 + 5Na2SO3 + 3Н2SO4 = 2MnSO4 + 5Na2SO4 + К2 SO4 +3Н2О
5 SO32 - + Н2 О – 2е ® SO42 - + 2Н+ 2МnO4 ¯ + 16Н+ +5SO32 - + 5Н2 О ® 2Мn2+ + 8Н2О + 5SO42 - + 10Н+
ХИМИЯ d -ЭЛЕМЕНТОВ Вопросы химических диктантов. Тема 3. Химическая связь. 1. Количественные характеристики (параметры) химической связи; 2. Типы химической связи (ковалентная полярная и неполярная, ионная); 3. Основные положения метода валентных связей (МВС); 4. Свойства ковалентной связи; 5. В чем отличие σ-связи от π-связи? 6. Что является основным условием образования гибридных структур? 7. Типы гибридизации, форма молекул и углы связи (привести примеры); 8. Локализованная и нелокализованная химическая связь? 9. Основные положения метода молекулярных орбиталей (ММО). 10. Типы межмолекулярного взаимодействия. Тема 5. Растворы. 1. Что называется растворами? 2. Классификация растворов; 3. Способы выражения концентрации растворов; 4. Что такое электролитическая диссоциация? 5. Закон разведения Оствальда; 6. Что означает и как называется показатель рН? 7. Что такое буферные растворы? 8. Что такое индикаторы? 9. Чем отличаются сильные электролиты от слабых? 10. Что такое активность и ионная сила сильных электролитов? 11. В каких случаях реакции обмена в растворах электролитов протекают необратимо? 12. Какие реакции называются гидролизом? 13. От чего зависит степень гидролиза? 14. Что называется константой гидролиза? Выражение Кг для различных типов солей? Тема 7. Металлы. 1. Физические свойства металлов. 2. Способы получения металлов. 3. Взаимодействие металлов с простыми веществами, их отношение к воде, щелочам, к кислотам неокислителям; 4. Отношение металлов к концентрированной Н2SO4 ; 5. Отношение металлов к концентрированной и разбавленной HNO3 ; Вопросы тестов ТЕСТ 1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ ХИМИЧЕСКОЕ РАВНОВЕСИЕ 1. Скорость реакции при повышении температуры на 50° (температурный коэффициент равен 2) увеличится: 1) в 2 раза; 2) в 8 раз; 3) в 10 раз; 4) в 32 раза. 2. Реакция, в которой понижение давления не вызовет смещения равновесия: 1) Pb (т) + 3O2(г) 2) I2 (г) + 5СO2(г) 3. Равновесие в реакции 2SO2(г) + O2(г 1) при повышении температуры; 2) при понижении концентрации SO2; 3) при понижении концентрации О2; 4) при повышении давления. 4.При повышении давления в 2 раза скорость химической реакции 2SO2 (г) + O2(г) 1) в 2 раза; 2) в 4 раза; 3) в 6 раз; 4) в 8 раз. 5.При повышении давления в 5 раз скорость прямой реакции Н2(г) + I2 (г) 1) увеличится в 5 раз; 2) уменьшится в 5 раз; 3) увеличится в 10 раз; 4) увеличится в 25 раз. 6. При повышении температуры на 20 градусов скорость реакции увеличилась в 16 раз, следовательно, температурный коэффициент реакции равен...: 1)2; 2) 4; 3)8; 4)32. 7. Равновесие 2HCl(г) + O2(г) 1) при понижении давления; 2) при повышении температуры; 3) при повышении концентрации Cl2; 4) при понижении концентрации О2. 8. Равновесие CS 2(г) + 4O2(г) 1) при повышении температуры; 2) при повышении концентрации SО3; 3) при понижении концентрации О2; 4) при повышении давления. 9. Реакция, в которой повышение давления и понижение температуры вызовут смещение равновесия в одну сторону: 1) 2NO (г) + Cl2(г) 3) CO (г) + H 2O(г) 10. Равновесие реакции CaO (г) + CO2(г) 1) при понижении давления; 2) при увеличении концентрации СО2; 3) при понижении температуры; 4) при дополнительном введении СаСОз. ТЕСТ 4 РАСТВОРЫ 1. Метилоранж становится желтым в растворе 1)NH4C1; 2)Na2SO4; 3) MgCl2; 4) CH3COONa. 2. Значение рН среды меньше 7 имеет водный раствор соли 1)СН3СООК; 2)А1С13; 3)NaCl; 4)Na2SO4. 3. Какова концентрация ионов гидроксила в растворе,рН которого 9? 1) 10 -5 г/ион л 2) 10 -9 г/ион л 3) 10 -12 г/ион л; 4) 10 -6 г/ион л 4. В каком из растворов рН =4 1) С (НС1) = 0,0004., 2) С(КОН) =0,004., 3) С (НС1) = 0,0001, С(КОН) =0,0001 5.Из раствора карбоната лития выделится газ при добавлении 1) NaCl; 2)NaClO; 3)HC1; 4)KC1O4. 6.Полностью гидролизуются в растворе соль 1)К2СO3; 2)A12S3; 3)K2S; 4) (NH4)2SO4. 7.Одновременно не могут находиться в растворе вещества набора 1) РеС13 и NaOH; 2) FeCl3 и NaNO3; 3) FeCl3 и H2SO3; 4) FeCl3 и HNO3. 8. Сумма коэффициентов в полном ионом уравнении в реакции между гидроксидом хрома (III) и гидроксидом калия равна 1) 16; 2) 11; 3) 7; 4) 9. 9. Укажите какое молекулярное уравнение соответствует данному ионному уравнению Ba2+ + CO3 2 → BaCO3 1) хлорид бария +угольная кислота; 2)сульфат бария + карбонат калия 3) гидроксид бария + карбонат натрия; 4) гидроксид бария + угольная кислота 10.Одновременно могут находиться в растворе вещества набора 1) K2SO3 и НС1; 2) H2SO4 и ВаС12; 3)Н2SО4 и КОН; 4) H2SO4 и НС1О4.
ТЕСТ 5 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ 1. Какой из ионов обладает лучшими комплексообразующими свойствами? 1) Са +2, 2) Fe +3, 3) Al +3, 4) К + 2. Составьте координационные формулы и укажите соединение с комплексным анионом 1) Pt CI2 •2NH3, 2) Сr(ОН) 3 •3КОН 3) Co CI3 4 NH3, 4) FeCI3 • 6 H2O 3. В каком комплексном ионе имеет место dsp 2 -гибридизация? 1) [AuCI4 ] - 2) [ Au (CN)4 ] - 3) [ Fe (CN)6 ] 3- 4) [ Сr (CN)6] 3- 4. Укажите внешнеорбитальный комплексный ион 1) [ Сr (H2O)6] 3 - 2) [ Fe (CN)6 ] 4- 3) [ СоCI4 ] - 4) [ Ni (CN)4 ] 2- 5. Укажите низкоспиновый комплексный ион 1) К3[Cr(OH)6] 2) К2 [ Zn(OH)4] 3) [ Сr(NH3)6]CI3 4) Н2 [AuCI4 ] 6. Укажите парамагнитный комплекс 1)[ Ni(NH3)4 ]CI2 2) [ Cu (H2 O)4 ]CI2 3) К2[ СоCI4 ] 4) К4 [ Fe (CN)6 ] 7. Укажите комплексный неэлектролит 1) СrCI3 • 4H2O 2) Pt CI4 2NH3 3) HgI2 •2KI 4) Ni CI2 •4NH3; 8. Какая константа нестойкости соответствует наиболее устойчивому комплексу? 1) 10 -5 2) 10 -9 3) 10 -12 4) 10 - 36 9. Укажите уравнение для определения Кн комплексного соединения [Сo (NH3) 4 ] CI2
1) [Сo 2+ ] +[NH3 ] 4 [Сo 2+ ] [NH3 ] Кн = ___________________ 2) Кн = ___________________ [ [Сo (NH3) 4 ] 2+ ] [ [Сo (NH3) 4 ] 2+ ]
3) [Сo 2+ ] [NH3 ] 4 [CI ] 2 [Сo 2+ ] [NH3 ] 4 Кн = ___________________ 4) Кн = ___________________ [ [Сo (NH3) 4 ] CI2 ] [ [Сo (NH3) 4 ] 2+ ]
10. Какое из указанных соединений разрушит комплекс [ Cu ([NH3)4 ]CI2? 1) КОН 2) К2S 3) H2 O 4) КCI Вопросы к коллоквиуму Семестр
Ой семестр
Примеры экзаменационных билетов Семестр Билет № 1 по курсу «Неорганическая химия» ВОПРОСЫ 1.Ковалентная связь. Теория Гейтлера и Лондона. Основные положения метода валентных связей. 2. Напишите электронную формулу элемента с порядковым номером 17, определите степени окисления, напишите формулы оксидов, гидроксидов, солей, водородного соединения. Назовите их. По методу ВС постройте графическую формулу молекулы СSСI 2. 3. Напишите уравнения реакций обмена в молекулярном и ионном виде: б) сульфид железа (II) + соляная кислота®; а) AI2 (SO4)3 + 8NaOH ®; 4. Напишите в молекулярном и ионном виде уравнения реакций гидролиза: а) Zn +Na3PO4 + H2O® б) Na3 AsO3 + H2O ®; 5. Составьте электронно-ионные уравнения: а) KMnO4 + Na2 SO3 + H2 SO4 ®; б) K2Cr2O7 + H2O2 + H2 SO4 ® Ой семестр Билет № 1 по курсу Неорганическая химия
ВОПРОСЫ 1. Метод валентных связей. 2. Соединения хрома в степени окисления +6: оксид, гидроксид, соли, роль в ОВ- реакциях. 3-4. Напишите уравнения реакций. с помощью которых можно осуществить превращения. Для реакций обмена напишите ион-ные уравнения, для ОВ-:реакций – электронно-ионные. MnO2 ® K2MnO4 ® KMnO4 ¾® MnSO4 ® Mn(NO3) 2 ¾® ¾® НMnO4 5. а) Как изменяются окислительные свойства в ряду Fe3+®Co3+® Ni3+. Ответ подтвердите уравнениями реакций б) Напишите уравнение реакции а) Zn + Н2 SО4 конц. ¾®
Приложение 1
Приложение 2
Приложение 3
Формулы кислот и названия их анионов
Приложение 4
Приложение 5 Наиболее часто встречающиеся в ОВ реакциях элементы и их соеди-нения имеют следующие степени окисления: Н -1 0 +1 Гидриды металлов(СаН2 Н2 Н2О, ОН ¯ N -3 –2 – 1 0 +1 +2 +3 +4 +5 NH3 N2H4 NH2OH N2 N2O NO N2O3 NO2 N2O NH4+ NO2¯ NO3¯ O -2 –1 0 +2 Н2О, ОН ¯ H2O2 O2, O3 OF2 P -3 0 +1 +3 +5 PН3 P4 PO2 H2¯ PO3 H 2- PO4 3- PH4+ As -3 0 +3 +5 AsН3 As AsO33- AsO43- S –2 0 +2 +4 +6 S2- S8 SO SO2 SO3 S2O32-, [Sn] 2- SO32- SO42-, S2O32- CI (Br,I) -1 0 +1 +3 +5 +7 CI¯ CI2 CIO¯ CIO2¯ CIO3¯ CIO4¯ Fe 0 +2 +3 +6 Fe Fe2+ Fe3+ FeO42- Fe(OH)2 Fe(OH)3 FeO2¯ Mn 0 +2 +4 + 6 +7 Mn Mn2+ MnO2 MnO42- MnO4¯ Cr 0 +2 +3 + 6 Cr Cr2+ Cr3+ Cr2O72- (в кислой среде) Cr (OH)2 [Cr (OH)6] 3- CrO42- (в щелочной среде) Sn 0 +2 +4 Sn Sn2+ Sn4+ (в кислой среде) [Sn (OH)4] 2- [Sn (OH)6] 2- (в щелочной среде) (аналогично для свинца) Bi 0 +3 + 5 Bi Bi3+ BiO3¯
..
Институт техносферной безопасности Кафедра химии метрологии и стандартизации
Неорганическая химия
Методические указания по изучению дисциплины, вопросы химических диктантов, тесты и контрольные задания для самостоятельной работы, бакалавров первого курса направления 19.03.04 – технология продукции и организации общественного питания
Краснодар
Составители: д.т.н., проф. Т.Н. Боковикова к.х.н., доц. Л.А. Марченко
Общая и неорганическая химия: Методические указания по изучению дисциплины, вопросы химических диктантов, тесты и контрольные задания для самостоятельной работы, бакалавров всех форм обучения направления 19. 03.04– технология продукции и организации общественного питания. : /Сост. Т.Н. Боковикова, Л.А. Марченко, Кубан. гос. технол. ун-т. каф. Химии, метрологии и стандартизации.-2014.URL:http// www. moodle.ru/kubstu/ru
Табл. 7. Библиогр. назв. 10, Приложений 5
Содержание
Введение Внедрение в учебный процесс государственного образовательного стандарта третьего поколения для студентов технологических специаль-ностей требует создания новых учебных материалов по общей и неорга-нической химии, которые учитывали бы требования, предъявляемые к самостоятельной работе студентов, в рамках выделенных часов, отводимых для подготовки к практическим, лабораторным занятиям и экзаменам. Методические указания составлены с учетом образовательных программ и учитывают уровень знаний студентов по таким темам как классы неорганических соединений, строение атома, периодическая система, химическая связь, растворы, окислительно-восстановительные реакции, комплексные соединения, электрохимия, химия элементов. Для проверки усвоения материала полезно восстановить в памяти основные положения прочитанного в лекции, ответить на предложенные вопросы по каждой теме и выполнить контрольные задания.
Задание 1
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 706; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.189.124 (0.01 с.) |

 Nа Н2РO4
Nа Н2РO4  P+5 — P 2O5 — H3 РO4 — Na3РO4
P+5 — P 2O5 — H3 РO4 — Na3РO4

 ;
; ;
; Sn(OH)2
Sn(OH)2 


 2 2Fe2+-2 ē =2Fe3+
2 2Fe2+-2 ē =2Fe3+ 2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O
2NH2OH + I2 + 2KOH = N2 + 2KI + 4H2O

 CaCО3 (г) + Q сместится влево:
CaCО3 (г) + Q сместится влево: