
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ацетиленовые углеводороды (Алкины)Стр 1 из 2Следующая ⇒
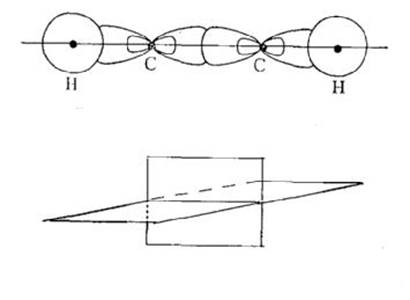
Ацетиленовые углеводороды (Алкины) - соединения, содержащие тройную связь –СºС–. Общая формула алкинов СnН2n -2 Строение алкинов: В молекуле ацетилена все 4 атома расположены на одной прямой, углы между s-связями – 180°. Атомы С - в состоянии Sp-гибридизации: 2 гибридные орбитали, расположенные на прямой линии под углом 180о;
· 2 негибридизированные р-орбитали, расположенные в 2-х взаимно перпендикулярных плоскостях. По одной гибридной орбитали атомы С образуют Ϭ – связь С - С, лежащей на линии, соединяющей центры атомов. Другая гибридная орбиталь каждого атома С образует Ϭ – связь С-Н при перекрывании с S – орбиталью атома Н. В итоге, 3 Ϭ – связи, лежащие на одной прямой под углом 180о и 2 π-связи между атомами С за счет перекрывания 2-х пар негибридизированных р-орбиталей, лежащих в 2-х взаимно перпендикулярных областях. Линия пересечения плоскостей - прямая Ϭ – связи: Энергия тройной связи - 829,6 кДж/моль, связи С–Н в молекуле ацетилена 506,9 кДж/моль. Гомологический ряд ацетилена
Рациональная номенклатура - производные ацетилена, в котором один или оба Н замещены на алкилы:
Пилацетилен ИЮПАК: -выбирают самую длинную цепь с тройной связью, - окончание «ан» в названии алкана меняют на «ин», -перед названием цифрой указывается № ненасыщенного атома С. - Цепь атомов С нумеруют так, чтобы ненасыщенные атомы обозначались наиболее меньшими номерами. - Далее, как и при наименовании алканов:
Метилпентин - 2 Тривиальные названия радикалов (алкинильные группы):
Изомерия (структурная и положение тройной связи):
Способы получения Промышленные способы: 1. Термическая деструкция алканов C1–С4:
2. Ацетилен из карбида кальция (Вёлер, 1862) (синтезы и сварка):
СаС2 + 2Н2О ® СНºСН + Са (ОН)2 Карбид кальция ацетилен 3. Из дигалогенпроизводных алканов (Кат. спирт. раств. щелочей или тв. NaOH; КОН) А) из вицинальных:
Б) из геминальных:
Ацетилен с метилмагнийбромидом а) СНºСН + H3C– Mg –Вr ®НСºС–Mg Вr + CH4 ↑ (реактив Иоцича) НСºС– Mg – Вr + Вr– С2Н5 ® НСºС– С2Н5 + MgВr2 в ж. NH3 б) СНºСН + NaNH2 ® СНºС–Na + NH3↑ НСºС–Na + Вr– С2Н5 ® НСºС– СН2 – СН3 + NaВr Физические свойства. Гомологи С2–С4, газы; C5 – C15 – жидкости; С15 и выше – твердые вещества. Положение тройной связи влияет на температуру кипения: 1-пентин температура кип. +39,6 °С; 2-пентин –56,2 °С. Химические свойства Реакции: · Присоединения: · Замещения S N · Полимеризации, конденсации · Окисления 1. Реакции присоединения (АЕ, АN, АR): Ацетилен 1,2-дибромэтан ®СНВr2-СНВr2 Тетрабромэтан 1.3 Присоединение галогенводородов (АЕ) по правилу Марковникова в две стадии:
Пропинид меди (осадок красно-фио- летового цвета) 2.1.3 С NаNH2 (в жид. NH3, эфире, метилате Na в спирте):
Ацетилен винилацетилен 3.2. Тримеризация собразованием дивинилацетилена (Кат. СuCl2, NH4Cl): 3СН º СН ® СН2 = СН -С º С-СН=СН2 Ацетилен дивинилацетилен 3.3 Образование полимера купрена (токопроводящий изоляционный полимер)
3.4 Синтез бензола (Зелинский, Казанский):
4. Окисление алкинов: 4.1 В прис. КMnO4 с разрывом С-С-связей и образованием карбоновых кислот:
2 СНºСН + 4О2 ® 4СО2 + 2Н2О + ∆Н Ацетиленовые углеводороды (Алкины) - соединения, содержащие тройную связь –СºС–. Общая формула алкинов СnН2n -2 Строение алкинов: В молекуле ацетилена все 4 атома расположены на одной прямой, углы между s-связями – 180°. Атомы С - в состоянии Sp-гибридизации: 2 гибридные орбитали, расположенные на прямой линии под углом 180о;
· 2 негибридизированные р-орбитали, расположенные в 2-х взаимно перпендикулярных плоскостях. По одной гибридной орбитали атомы С образуют Ϭ – связь С - С, лежащей на линии, соединяющей центры атомов. Другая гибридная орбиталь каждого атома С образует Ϭ – связь С-Н при перекрывании с S – орбиталью атома Н.
В итоге, 3 Ϭ – связи, лежащие на одной прямой под углом 180о и 2 π-связи между атомами С за счет перекрывания 2-х пар негибридизированных р-орбиталей, лежащих в 2-х взаимно перпендикулярных областях. Линия пересечения плоскостей - прямая Ϭ – связи:
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 1028; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.249.158 (0.012 с.) |
 метилэтилацетилен метилизопро-
метилэтилацетилен метилизопро-




 Ацетилен более сильная кислота, чем вода. Сухие ацетилениды взрывоопасны.
Ацетилен более сильная кислота, чем вода. Сухие ацетилениды взрывоопасны. купрен
купрен ацетилен Бензол
ацетилен Бензол 4.2 Горение с выделением тепла (сварка, резка):
4.2 Горение с выделением тепла (сварка, резка):


