Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Загальні відомості про будову речовини
Види хімічного зв'язку Хімічний зв'язок – це сукупність сил, що діють між атомами чи групою атомів. Внаслідок дії цих сил утворюються молекули. При обговоренні хімічного зв'язку зазвичай користуються терміном “валентність”. Дане поняття означає міру здатності елемента до утворення хімічного зв'язку. Хімічний зв'язок здійснюється в основному за рахунок так званих валентних електронів. Описати хімічний зв'язок – це означає з'ясувати, як розподіляється електронна щільність у молекулі. Розглянемо основні види зв'язків, за рахунок яких відбувається об'єднання атомів у молекули. Ковалентний зв'язок характеризується утворенням стійких електронних пар з електронів, які раніше належали до окремих атомів, котрі входять до складу молекул. Електрони, рухаючись молекулярними орбітами, найбільш часто розташовуються між ядрами, де створюється начебто надлишок негативного заряду, що сприяє зближенню атомів (рис. 1.1).
Якщо ж двоатомна молекула складається з атомів різних елементів, то електронна пара може бути зміщена до одного з атомів. У таких випадках ковалентний зв'язок називають полярним, а молекули з полярним зв'язком, у яких центри позитивних і негативних зарядів не збігаються, - полярними чи дипольними (рис.1.1, б). Дипольна молекула характеризується величиною електричного дипольного момента m, вимірюваного в Кл×м
де q - абсолютне значення заряду; l - відстань між центрами позитивного і негативного зарядів. Багатоатомні молекули також можуть бути неполярними – при симетричному розташуванні зарядів або полярними – при асиметричному. Приклади нейтральних (неполярних) і дипольних (полярних) молекул наведені на рис. 1.2 (а, б) відповідно. Як приклад речовин з полярним ковалентним зв'язком, можна навести молекули типу H2O, H2S, N2O5 і всіх кислот. Речовини, утворені молекулами з ковалентним зв'язком, характеризуються високою твердістю. Вони є тугоплавкі й хімічно інертні, що пояснюється міцністю ковалентного зв'язку і його спрямованістю.
Іонний зв'язок спричинюється силами електростатичного притягання між позитивними і негативними іонами. Як приклади іонних сполук можна навести елементи, що дуже відрізняються за властивостями, наприклад типові метали і типові неметали. На рис. 1.3 показано іонний зв'язок на прикладі іонних кристалів хлористого цезію CsCl і титанату барію BaTiО3. Молекули речовини з іонним зв'язком є полярні. До речовин з іонним зв'язком належать більшість солей і деякі оксиди (Cu2O, ZnО, CdО, Fe2O3, NiО і ін.). Іонні сполуки за механічною міцністю і хімічною стійкістю поступаються речовинам, утвореним за допомогою ковалентного зв'язку, тому що іонний зв’язок є менш міцний, ніж ковалентний.
Отже, металевий зв'язок визначається водночас наявністю ковалентного зв'язку між нейтральними молекулами та електростатичним притяганням між іонами і вільними електронами, що в підсумку забезпечує монолітність і міцність металу. Завдяки наявності вільних електронів метали мають високу електро- і теплопровідність. Висока пластичність металів пояснюється відсутністю спрямова-ності металевого зв'язку. Міжмолекулярний зв'язок, чи зв'язок Ван-дер-Ваальса, спостерігається у низці речовин між молекулами з ковалентним характером усередині молекулярної взаємодії. Наявність міжмолекулярного притягання в цьому разі є можлива при погодженому русі валентних електронів у сусідніх молекулах (рис. 1.4, б). Тоді сили притягання валентних електронів ядром сусідньої молекули стають сильніше за сили взаємного відштовхування електронних оболонок цих молекул. Речовини з молекулярним характером зв'язку мають низькі температури плавлення (наприклад, у парафіна tпл = 50 – 52 оС). Це свідчить про те, що зв'язок Ван-дер-Ваальса є дуже слабкий.
Кристалічна будова речовини У твердих речовинах атоми і молекули розташовано в геометрично правильному порядку або в хаотичнім безладді. Відповідно до цього речовини, що мають геометрично упорядковане розташування атомів чи молекул, називають кристалічними, а речовини з хаотичним розташуванням атомів або молекул – аморфними.
Кристалічні решітки можна класифікувати як за виглядом часток, що їх утворюють, так і за формою елементарної комірки. Геометрично можливі 14 видів просторових решіток, що є основою шістьох систем кристалічних решіток (триклинна, моноклінна, ромбічна, гексагональна, тетрагональна, кубічна). Елементарні комірки деяких кристалічних систем подано на рис. 1.5, а співвідношення між їхніми осьовими кутами й осьовими одиницями наведені в табл. 1.1. Найважливішими параметрами кристала є розміри елементарної комірки; їх визначають як рівноважні відстані в напрямку характеристичних осей між центрами часток, що займають сусідні вузли решітки, і називають сталими решітки. Розміщення часток у просторових решітках здійснюється у такий спосіб, щоб забезпечити максимально можливу для даного типу кристала енергію їхнього зв'язку, а також енергетичну однорідність у цілому. Таблиця 1.1. Просторові решітки кристалічних систем.
Для часток сферичної форми найбільш сприятливим часто стає таке їх розміщення, при якому кожна сфера перебуває в зіткненні з найбільшим числом найближчих сусідів. Подібні просторові утворення називаються структурами найщільнішого упакування. У залежності від вигляду часток, що вони утворюють кристалічні решітки, розрізнюють атомні, іонні, металеві й молекулярні кристалічні решітки. У вузлах атомних решіток перебувають нейтральні атоми, що вони сполучені один з одним ковалентним зв'язком. Прикладами кристалів цього типу можуть слугувати алмаз, кремній, германій, сіре олово, а також кристали складних речовин, таких, як кварц, карбід кремнію, сульфід цинку, нітрид алюмінію. У вузлах іонних решіток розташовуються, чергуючись, позитивні й негативні іони. Вони сполучені один з одним іонним зв'язком. Прикладами кристалів, у яких переважує іонний тип зв'язку, можуть бути NaCl, Ca2, KF. Багато іонних кристалів належать до класу діелектриків.
У вузлах металевих решіток розташовано позитивні іони, у проміжках між якими перебувають вільні електрони. Утворюються металеві решітки за допомогою металевого зв'язку. Стабільність кристала забезпечується силами притягання між позитивними іонами й електронним газом. Прикладами таких кристалів є метали та їхні сплави. За енергією кристалічних решіток метали займають проміжне становище між кристалами з атомними решітками і молекулярними решітками. Щільність більшості металів є значна, що свідчить про доволі щільну структуру металевих кристалів. З іншого боку, такі властивості металів, як високі ковкість і тягучість, указують на відсутність твердості в металевих решітках: їхні площини відносно легко зсуваються одна щодо іншої. У вузлах молекулярних решіток перебувають молекули. Такі решітки утворюються за рахунок ковалентного та іонного зв'язків. Молекули органічних сполук (полімерів) можуть мати витягнуту форму у вигляді зиґзаґоподібних скручених ланцюжків, сітчасту чи складну просторову форму. Аморфні речовини. Внутрішня побудова аморфних речовин характеризується безладним розташуванням атомів і молекул, тобто в них є відсутня кристалічна побудова. Вони поділяються на дві великі групи: а) прості аморфні речовини - низькомолекулярні рідини, неорганічні стекла, плавлений кварц; б) високополімерні сполуки - каучук, гуми, органічне скло, смоли. Аморфно-кристалічні речовини. Деякі речовини можуть перебувати як у кристалічному, так і в аморфному стані. Так, оксид кремнію SiО2 зустрічається в природі у вигляді кристалів кварцу, а також в аморфному стані у вигляді мінералу – опалу. Аморфний стан речовини є менш стійким, ніж кристалічний, тому є можливий спонтанний перехід речовини з аморфного стану в кристалічний. Прикладом такого перетворення є розстеклування - спонтанна кристалізація скла при підвищених температурах або тиску. У зв'язку з утворенням дрібних кристаликів скло змінює свої оптичні властивості і перетворюється на аморфно-кристалічний матеріал, який називається ситалом. Анізотропія кристалів Навіть найбільш упорядкована з розглянутих кристалічних решіток (кубічна) не має абсолютної просторової симетрії. Тому і властивості кристалів (електричні, магнітні, механічні, хімічні) залежать від напрямку, в якому вони розглядаються. Таку неоднаковість властивостей кристала в різних напрямках називають анізотропією.
Якщо кристалічне тіло складається з одного великого кристала, тобто є монокристалічним, то воно має анізотропію властивостей. Ступінь анізотропії може бути значною. Наприклад, дослідження монокристала міді засвідчили, що межа міцності на розтягання змінюється від 120 до 360 МПа, а відносне подовження при розтяганні – від 10 до 55 %. Анізотропія кристалічних тіл виявляється тим сильніше, чим менше ступінь симетрії їхніх кристалічних решіток. Якщо тіло складається з великої кількості кристалів, тобто є полікристалічним, то за рахунок усереднення властивостей окремих кристалів властивості тіла в цілому не залежать від напрямку. Такий стан називають квазіізотропією. Анізотропія кристалів має важливе значення. За допомогою спеціальної обробки можуть бути отримані текстуровані матеріали з орієнтованим розташуванням кристалів, у яких виявляється анізотропія. Цю особливість можна використовувати, наприклад для виготовлення текстурованої сталі крупнокристалічної побудови, ребра кристалів якої розташовано паралельно напрямку прокатки. При намагнічуванні магнітні властивості сталі за напрямком прокаткування є вище, ніж за іншими напрямками. Властивості аморфних тіл не залежать від обраного напрямку, тобто аморфні тіла ізотропні. Наприклад, кристал кварцу, якщо його розплавити, після охолодження утворить так званий плавлений кварц, що він має властивості, цілком однакові в усіх напрямках і при цьому вони надто відрізняються від властивостей кристалічного кварцу. Поліморфізм (алотропія). Багато речовин, у залежності від умов кристалізації, можуть мати різні форми кристалічних решіток. Здатність речовини мати різні форми кристалічних решіток називають поліморфізмом, або алотропією. Поліморфні перетворення відбуваються головним чином під впливом температури, хоча не виключено вплив і інших факторів – зміни тиску, наявності сторонніх домішок. Сутність поліморфізму полягає в тому, що за певних температур у твердій речовині виникають нові центри кристалізації, в процесі зростання яких утворяться нові решітки. Різні поліморфні форми речовини називають модифікаціями і позначають початковими буквами грецького алфавіту (a, b, c, d тощо). Поліморфні перетворення відбуваються в кобальті, залізі, олові, титані, селені, фосфорі тощо. При зміні кристалічної структури змінюються і властивості речовини. Найбільш яскравим прикладом поліморфних перетворень є модифікації вуглецю. Графіт, що має гексагональну кристалічну решітку – м'який і крихкий матеріал, добре проводить електричний струм. Алмаз, кристалічна решітка якого складається з двох гранецентрованих кристалічних решіток, зсунутих одна відносно одної на 1/4 сталої кристалічної решітки a, є найтвердішою речовиною. Зонна теорія твердих тіл
При конденсації газоподібної речовини в рідину, а потім утворенні кристалічних решіток твердого тіла всі наявні в даному типі атомів електронні рівні (як заповнені, так і незаповнені електронами) дещо зміщуються внаслідок впливу сусідніх атомів один на одного. Таким чином, з окремих енергетичних рівнів відокремлених атомів у твердому тілі утвориться смуга, називана зоною енергетичних рівнів (рис. 1.9, б).
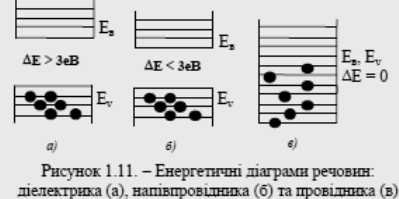
Розглянемо енергетичну діаграму вуглецю (рис. 1.10.). Його електронна формула: 1s22s22p2. В окремих атомах вуглецю 4 валентних електрони розміщуються по два на рівнях 2s та 2р. При зближенні атомів рівні розщеплюються на зони ємністю 2 та 6 електронів. При зближенні до відстані аг утворюється одна об'єднана не повністю заповнена зона ємністю 8 електронів на атом. Таке тіло (графіт) проводить електричний струм. Якщо міжатомна відстань зменшується до аа, то об'єднана зона розщеплюється на дві: кожна ємністю 4 електрони на атом. Ці зони розділені великою забороненою зоною (~ 5,3 еВ) і 4 валентних електрони розміщу-ються у нижній (валентній) зоні, заповнюючи її цілковито, а верхня зона є вільна, тобто таке тіло (алмаз) не має вільних електронів і є діелектриком. Висновки зонної теорії. Характер енергетичного спектра металевих провідників, напівпровідників та діелектриків є різний. У провідниках валентна зона заповнена або частково, або повністю і перекривається зоною провідності. У напівпровідниках та діелектриках зона провідності та валентна зона розділені забороненою зоною, а валентна зона заповнена повністю. Формально до діелектриків відносять речовини, які мають заборонену зону більш за 3 еВ. Діелектриками називають матеріали, в яких в енергетичному спектрі зона провідності та валентна зона розділяються забороненою зоною шириною не менше за 3 еВ. Тому теплові коливання атомів не можуть звільнити валентні електрони і вони мають дуже малу електронну провідність (рис. 1.11, а).
Напівпровідниками називають матеріали, які в енергетичному спектрі мають заповнену валентну зону та незаповнену зону провідності. Ці зони розділені забороненою зоною шириною від 0,1 до 3 еВ. Тому теплові коливання атомів можуть додати деяким електронам енергію, достатню, щоб стати вільними. Ось чому провідність напівпровідників надто залежить від зовнішніх факторів: температури, випромінювання, електричного поля та т.п. (рис.1.11, б). Провідниками називають матеріали в енергетичному спектрі яких валентна зона та зона провідності перекриваються, тому електрони у провідниках є вільні і вони добре проводять електричний струм (рис. 1.11, в). При температурі наближеній до абсолютного нуля, напівпровідники набувають властивостей діелектриків, тобто їхня електропровідність дорівнює нулю.
Пасивні діелектрики
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-07; просмотров: 359; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.12.172 (0.019 с.) |
 Якщо двоатомна молекула складається з атомів одного елемента (H2, N2, Cl2), то електронна пара однаковою мірою належить до обох атомів. У подібному випадку молекулу та існуючий в ній ковалентний зв'язок називають неполярним чи нейтральним (рис. 1.1, а). У неполярних молекулах центри позитивних та негативних зарядів збігаються.
Якщо двоатомна молекула складається з атомів одного елемента (H2, N2, Cl2), то електронна пара однаковою мірою належить до обох атомів. У подібному випадку молекулу та існуючий в ній ковалентний зв'язок називають неполярним чи нейтральним (рис. 1.1, а). У неполярних молекулах центри позитивних та негативних зарядів збігаються. m = ql, (1.1)
m = ql, (1.1) Донорно-акцепторний зв'язок є різновидом ковалентного зв'язку. Виникає він між атомами елементів, один з яких є здатен віддати електрони (донор), а інший – здатен прийняти ці електрони (акцептор). Прикладом таких сполук можуть слугувати сполуки, утворені елементами третьої і п'ятої груп Періодичної системи Д. І. Менделєєва, наприклад арсенід галію GaAs.
Донорно-акцепторний зв'язок є різновидом ковалентного зв'язку. Виникає він між атомами елементів, один з яких є здатен віддати електрони (донор), а інший – здатен прийняти ці електрони (акцептор). Прикладом таких сполук можуть слугувати сполуки, утворені елементами третьої і п'ятої груп Періодичної системи Д. І. Менделєєва, наприклад арсенід галію GaAs. Металевий зв'язок. Для металів характерний є хімічний зв'язок, який ґрунтується на колективізації валентних електронів, що належать не двом, а практично всім атомам у кристалі. Атоми металів здатні віддавати зовнішні електрони, перетворюючись на позитивні іони, чи знову їх приєднувати, перетворюючись на нейтральні атоми. Таким чином, метал можна розглядати як систему, побудовану з позитивних іонів, що вони перебувають в середовищі вільних, колективізованих електронів (рис. 1.4, а).
Металевий зв'язок. Для металів характерний є хімічний зв'язок, який ґрунтується на колективізації валентних електронів, що належать не двом, а практично всім атомам у кристалі. Атоми металів здатні віддавати зовнішні електрони, перетворюючись на позитивні іони, чи знову їх приєднувати, перетворюючись на нейтральні атоми. Таким чином, метал можна розглядати як систему, побудовану з позитивних іонів, що вони перебувають в середовищі вільних, колективізованих електронів (рис. 1.4, а). Кристалічні речовини. Більшість твердих речовин має кристалічну побудову. Кожна речовина зазвичай утворює кристали цілком певної форми. Зовнішня форма кристала відбиває його внутрішню побудову й зумовлена геометрично правильним розташуванням атомів чи молекул, що вони утворюють кристал. Це розташування атомів можна подати у вигляді просторових кристалічних решіток, що вони складаються з численної кількості сполучених одна з одною елементарних кристалічних комірок.
Кристалічні речовини. Більшість твердих речовин має кристалічну побудову. Кожна речовина зазвичай утворює кристали цілком певної форми. Зовнішня форма кристала відбиває його внутрішню побудову й зумовлена геометрично правильним розташуванням атомів чи молекул, що вони утворюють кристал. Це розташування атомів можна подати у вигляді просторових кристалічних решіток, що вони складаються з численної кількості сполучених одна з одною елементарних кристалічних комірок.
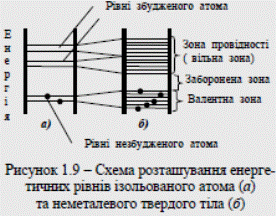 Усі тіла, в залежності від їхньої електропровідності за постійної напруги поділяють на діелектрики, провідники і напівпровідники. Різницю між ними можна показати за допомогою енергетичних діаграм зонної теорії твердих тіл. Як відомо з дослідження спектрів різних речовин у газоподібних станах, коли атоми відстоять один від одного на великих відстанях, для кожної речовини є характерні цілком певні спектральні лінії. Це свідчить про наявність певних енергетичних рівнів (станів) для різних атомів. Частина цих рівнів заповнена при нормальному, незбудженому стані атома, на інших рівнях електрони можуть перебувати лише тоді, коли атом підлягає зовнішньому енергетичному впливу, тобто коли він збуджений. Прагнучи до стійкого стану, атом випромінює надлишок енергії в момент переходу зі збуджених рівнів на рівні, де його енергія є мінімальна. Це можна проілюструвати енергетичною діаграмою атома, наведеною на рис. 1.9, а.
Усі тіла, в залежності від їхньої електропровідності за постійної напруги поділяють на діелектрики, провідники і напівпровідники. Різницю між ними можна показати за допомогою енергетичних діаграм зонної теорії твердих тіл. Як відомо з дослідження спектрів різних речовин у газоподібних станах, коли атоми відстоять один від одного на великих відстанях, для кожної речовини є характерні цілком певні спектральні лінії. Це свідчить про наявність певних енергетичних рівнів (станів) для різних атомів. Частина цих рівнів заповнена при нормальному, незбудженому стані атома, на інших рівнях електрони можуть перебувати лише тоді, коли атом підлягає зовнішньому енергетичному впливу, тобто коли він збуджений. Прагнучи до стійкого стану, атом випромінює надлишок енергії в момент переходу зі збуджених рівнів на рівні, де його енергія є мінімальна. Це можна проілюструвати енергетичною діаграмою атома, наведеною на рис. 1.9, а. Найверхню із заповнених електронами зон називають валентною. Ця зона відповідає енергетичним рівням електронів зовнішньої оболонки атомів. Найближчу до неї вільну від електронів зону називають зоною провідності. Зона, яка розділяє валентну зону та зону провідності, - заборонена зона. Щоб валентний електрон зробити вільним, треба прикласти до нього енергію, більшу за ширину забороненої зони.
Найверхню із заповнених електронами зон називають валентною. Ця зона відповідає енергетичним рівням електронів зовнішньої оболонки атомів. Найближчу до неї вільну від електронів зону називають зоною провідності. Зона, яка розділяє валентну зону та зону провідності, - заборонена зона. Щоб валентний електрон зробити вільним, треба прикласти до нього енергію, більшу за ширину забороненої зони.