
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет и задача молекулярной биологии, её значение для практики. История развития молекулярной биологии.Стр 1 из 12Следующая ⇒
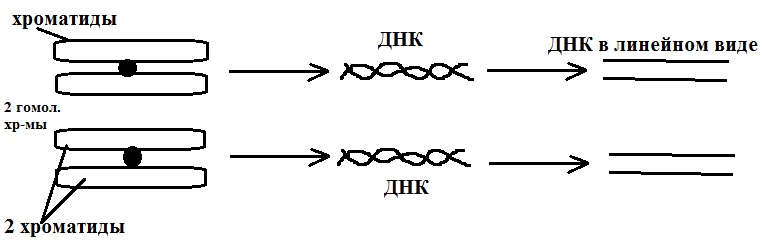
ОБЩИЕ ПРИНЦИПЫ И ОСОБЕННОСТИ МОЛЕКУЛЯРНОЙ ОРГАНИЗАЦИИ ЖИВЫХ СИСТЕМ. ЖИЗНЬ. ОСНОВНЫЕ ПРИЗНАКИ ЖИВОГО. Жизнь -это способ существов-я открытых саморегулирующихся и самообр-ся систем на основе биохим. взаимод. белков, НК, АК и др. соединений и преобразования поступающих из внешней среды в-в и мол-л. Основн. признаки жив.сист: · Обмен в-в и Е с окруж.сред · Рост · Размножение · Раздражимость · Изменчивость Каждый из признаков в отдельности может быть присущ и нежив. сист. Живые сист. облад. всеми признаками в совокупности. Наименьшая единица – клетка. Общие принципы организации живых систем. 1. Большинство хим. комп-ов жив.сист. представл. собой орг соед-я,(т.е соед. С в которых атомы связываются др.с др., а так же с H,O, N). С, О, Н,N- более 90% массы жив.сист. 2. Орг. соед. Вход-ие в состав жив. сист. Разнообразны. Наибольшим разнообразием отлич белки и НК. (Пр-р: киш палочка насчитыв 5000 различ орг соед-ий, из них 3000-белков, 1000-НК, 1000- др орг соед-я. У ч-ка 50.000 разновидностей белков). 3. Разнообр. органич. соед. построены из большого колич-ва мономеров (Пр-р в сост. белков -20 различ.АК). Их различ. комбинации дают неограниченное число вариаций белков, НК. 4. Идентичность каждого вида и каждой особи сохран. благодаря наличию свойственных только им наборов белков и НК. 5. Все биомол-лы в кл-е выполн спецефич.ф-ции. 6. Живые орг-мы создают и поддерж. присущую им упорядочность за счет Е, поступающей из внеш.сред. при этом степень упорядоченности внеш.сред.уменьш (энтропия растет). 7. Живые орг-мы как преобраз-ли Е подчиняются законам термодинамики.
I закон сохран. и превращ. Е.- Е не куда не исчезает, не возник.заново, она может первращ. из одного вида в другую. II закон теплота не может самопроизвольно передаваться от более холодного к более теплому. Особенности жив.систем как преобразователей Е 1. Построены из сравнительно хрупких мол-л, не способных выдерж. высокую t, p, pH. 2. Не могут использ. тепло как источник Е и функционируют при постоянной t. 3. Для осущ. жизнедеят. использ. хим. Е 4. При образовании Е ключевую роль играют ф-ты, котор. выступают в качестве катализаторов хим.р-ции и сниж. их энергию активации. 5. Энергетические потребности всех жив.орг. прямо или косвенно удовлетв-ся. солнечной Е.
СТРОЕНИЕ ДНК. МОДЕЛЬ УОТСОНА-КРИКА ДНК - гетерополимер, мономерами, кот. явл. нуклеотиды. Полимеры – в-ва молекулы кот. сост. из повторяющихся, одинаковых или сходных струк-х ед. (000000-полимер, 0-стр-я ед. мономер). Биополимеры: гомополимер (из одинак. мономер крахмал, целлюлоза); гетерополимер (из разных мономер). В состав ДНК входит 4 нуклеотида: А,Г (пуриновые нукл.); Ц,Т (пиримидиновые нукл.) Разл. нуклеотиды отлич. друг от друга только различ. строением азотистого основания. Полусхематич. строения нукл. 1) пуриновые АзотОснов - производные пурина
2) Пиримидиновые АО – производные пиримидина
Нуклеотиды способны соед. др. с др. при помощи фосфодиэфирных связей и образ-ть полинукл. цепочки. Правило Чаргаффа. 1.Суммарное кол-во пуриновых нукл. ДНК суммарному кол-ву пиримидиновых SА+Г=SТ+Ц 2.Количество А=Т, а кол-во Г=Ц. Формы ДНК В –форма хар-на для живых систем ин виво. правозакручена А – форма образ-ся при транскрипции, один виток 11 п.н. С – форма, один виток – 9 п.н. правозакручена Z – левозакручена. Получена искусственно при высокой концентрации солей. По А образ. набор фрагментов 32Р – 1 нуклеотид 32Р АГЦТ – 5 нуклеотидов 32Р АГЦТАГТЦТ– 10 нуклеотидов По Г образ. набор фрагментов 32Р А – 2 нуклеотида 32Р АГЦТА – 6 нуклеотидов 32Р АГЦТАГТЦТА–11 нуклеотидов
По Т образ. набор фрагментов 32Р АГЦ – 4 нуклеотида 32Р АГЦТАГ – 7 нуклеотидов 32Р АГЦТАГТЦ–9 нуклеотидов
По Ц образ. набор фрагментов 32Р АГ – 3 нуклеотида 32Р АГЦТАГТ – 8 нуклеотидов 32Р АГЦТАГТЦТАГ –12 нуклеотидов калибровочная дорожка, отраж. число нуклеотидов Чтение электрофолаграмы осущ. от + к - (снизу вверх). + соответствует 5’-концу фрагмента ДНК. 5’ АГЦТАГТЦТАГЦ 3’
Метод Сенгера (ферментативный метод) Метод основан на остановке ферментативного синтеза ДНК при помощи дидезоксинуклеотидов (gg)
Ген – ед-ца функции. 2) Ген мутирует как единое целое и представляет собой единицу наследственной изменчивости. Ген – ед. Мутации. 3) Ген занимает опр участок локус на хромосоме и явл предельной единицей рекомбинации и не разделим далее посредствам кроссинговера.
Ген (по Моргану) ‒ мельчайшая, далее неделимая единица наследственности, представляющая собой ед ф-и, мутации, рекомбинации. В 50 годы 20 века начали накапливаться данные о делимости гена. Возник вопрос о том, каковы пределы делимости гена. Ответ на этот вопрос был получен в работах с. Бензера выполненных на бактериофаге Т4. Жизненный цикл бактериофага!
У фага Т4 имеется условно-летальная мутация. r2 (от англ rapid-lisis – быстрый лизис). Фаги выращиваются на бактериальном газоне.
r2 условно летальная мутация – мутация r2: - не растут на E.Coli, штамм К12; - растут на E.Coli, штамм В. Этапы работы Бензера по изучению тонкой структуры гена: 1) Получение большого кол-ва независимых мутаций по гену r2+ (r2+→ r2). Около 2 тыс независимых мутаций. 2) Проведение для этих мутаций функц-ого теста на аллелизм (цис-транс-тест), путем совместного заражения различ-ми мутантами культурами E.Coli, К12.
Если отсутствует рост – комплементация отсутствует. * - мутация.
Вывод: Ген не явл единицей ф-й, единицей ф-й явл часть гена, котор получ название – цистрон. Цистрон – функциональная часть гена, в пределах котор выполняется цис-транс-тест, явл единицей ф-й.
Цистрон – кодирует 1 ППЦ. Белок кодируется 4 цистонами.
3) Рекомбинационное картирование мутации. Рекомбинация – обмен участками между молекулами ДНК. Также осуществляется путем совместного заражения E.Coli различными мутантами относящихся к одному цистрону r2А или r2В. Частота рекомбинации явл мерой расстояния между точкой мутации. rf (от латинского recombination fregyency); rf= Минимальная частота рекомбинации – 0,02%; Общая длина рекомб карты (фага) – 1500%; Общее число фагов нуклеотидов (Т4) -1,8 * 105; Единица рекомбинации =
Вывод: Единица рекомбинации =2 нуклеотида и она получ название 1 рекон. РЕАЛИЗАЦИЯ ГЕН-Й ИНФ-И (ГИ) И ЕЕ ПРОСТРАНСТВЕННЫЕ ОСОБЕННОСТИ У ПРО- И ЭУКАРИОТ. ЦЕНТРАЛЬНАЯ ДОГМА (ЦД) В МБ. Реализация ГИ – перенос информации о первичной стр-ре белка от мол-л ДНК через ряд промежуточных этапов к синтезированным белковым молекулам. Впервые путь такого переноса был установлен в 1958г. Ф Криком. Он выражается в виде схемы: ДНК à РНКà Белок Данная схема получила название ЦД молекулярной биологии. Формулировка «ЦД»: перенос генетической информации в живых системах осуществляется в одном направлении, а именно от ДНК к РНК, а затем к белку. Эволюция представлений о путях переноса генетической информации:
2) Схема отражающая основные матричные процессы:
Схема циклов роботы рибосом
Этапы элонгации: 1. Реак-ия транскриптидирования – перебрасыв-ие п.п.ц с тРНК1 на тРНК2, бораз-ие пептидной связи. 2. Раек-ия транслокации – перемещ-ие рибосомы вдоль мол-лы иРНК на 1 кадон вправо, переход пептидил тРНК из А центра в Р центр, поступл-ие в А центр нового кадона, освобож-ие тРНК1. 3. Присоединение новой аминоацил тРНК к А центру рибосомы – поступ-ие в А центр рибосомы новой аминоацил тРНК(3), в соответ-ии с принципом компл-ти кадон – антикадон.
В элонгации принисают участие белковые факторы элонгации без кот. не происходит ее действие (у прокариот: EF – Tu, EF – Ts. EF – G. у эукариот: EF1, EF2). Процессинг синтезир-ой белковой мол-лы – процесс ее созревания. Он включает след-ие этапы: - модификация N и C концов – отсоединение некот-го колич-ва АК. - обр-ие дисульфидных мостиков, препят-их денатурации
МГЭ прокариот Началу изуч. МГЭ положило открытие в конце 60-х г., необычных мутантов по, общими для этих мутантов были вставки стр-ах, кот приводили к мутациям и были названы Ys – элем-ты. YS – элем-ты обл-ют способ-ю менять свое местоположение на хр-ме, т.е. явл. МГЭ. Им-ся 2 разнов-ти: 1) Ys-элем-ты - их размеры =200-5700 п.н. он хар-ся след особенностями: · На концах несут несовершенные повторы (палиндромы), длиной от нескольких пар до неск. десятков пар нуклеотидов. · Содержат ген кодирующий синтез транспозаза, отвеч. за перемещ. Ys-ов. · При встраивании в др. уч-ки хр-м небольшие дупликации длина 5-11 п.н. (флакирующие Ys-эл-ты). Бакт. Хр. E.Coli несет только Ys-ов в кл перемещ с частотой 10-6-10-8 на клет деление. 2) Tn – элементы (транспозоны) харак. теми же особ., что и Ys кроме гена кодир. транпозазу, они могут переносить гены устойч-ые к антибиотикам. Эти гены могут расп-ся как внутри Tn так и между 2-мя Tn-эле-ми.
МГЭ эукариот Транспозоны Пример: - Ac, Ds у кукурузы, -P- эле-ы у дрозофилы По краям не несут инвентир. повторы, а в центр. част. ген, кодир. синтез фер-та транспозаза. В 1976 г. Гвоздев, Георгиев открыли МГЭ у дрозофилы, кот получили назв Мобильные Дисперсированные Гены (МДГ). МДГ случайно распред. по всему геному и способ. переем-ся с частотой 1*10-5 – 10-8 на поколение. В наст. Время у дрозофилы открыто множество МГЭ кот. Названы терминами обозн. Склонности к переем.: Hobo – бродяга, flea – блоха, магелан бигль Ретротранспозоны Получ. Такое название потому что в их перемещ приним. участие обратная транскрипция (ретро-обратный). Широко распространены у млекоп. сост. более 10% от всей ДНК
ГЕНЕТИЧЕСКАЯ РЕКОМБИНАЦИЯ Г.Р. - совок. процессов приводящ. к перераспред. нукл. послед-й и в геномах. Явление г.р. было открыто в 1910 г. Т. Морганом на дрозофиле. В частности им был установлен обмен уч-ми между гомолог. хр-ми получ. назв. – кроссинговер ( один из частных случаев рекомбинации). К Г.Р. след. процессы: -обмен уч-ми между молек. ДНК (или РНК) -встраивание уч-в ДНК в опред. места на молек-х ДНК. -комбинирование хр-м при формировании гамет и спор -кроссинговер – обмен уч-ми между гомолог. хр-ми В настоящее время Г.Р. подразд на 2 класса: 1) общая 2) сайт-специфическая(«незаконная») 1. Общая: протекает на основе гомологии рекомбин. уч-в ДНК 2. «незаконная»: для ее осущ. гомологии реком. уч-в Общая рекомбинация Наиболее изученным процессом отн. к общей рекомб. явл. кроссинговер, кот. происх. в профазе мейоза1 у эу-. На этой стадии хр-м сост из 2-х хроматид в обмене уч-т 2 хроматиды из 4, каждая из хроматид содер. 1 мол. ДНК.
Молек. мех-м общей рекомбинации на примере кроссинговера
Осн. этапы рекомбинации: 1) Присоед. RecBCD к одной из мол-л ДНК, частич. расплетение 2-ой спирали. 2) Перемещение RecBCD-белка вдоль мол-лы ДНК, поиск сайта рекомбинации (v=300 нукл./сек). Образование разрыва (1-но нитевого) в 1-й из молек-л ДНК эндонуклеаза, т.о. Rec BCD белок действ. одновременно как и геликаза и эндонуклеаза. 3) Удерживание расплетенного уч-ка ДНК в одноцепочечном состоянии (SSB-белки), образ. Т.наз. «уса» перебрасывание «уса» на соседнюю мол-лу, частичное расплет. 2-й спирали, взаимодействие 2-х путей ДНК принад-т разным молек. по принципу комплементарности. Данный этап осущ при участии Rec A-белка 4) Образ. 1-нонитевого разрыва в другой мол-ле (Rec-BCD) формирование гетеродуплекса, уч-ов мол-й гетерозиготности и полухиазм. Полухиазма (стр-ра Холлидея) - место пересеч-я нитей ДНК, принадл-х различ-м мол-м. Уч-ки мол-й гетерозиготности – уч-ки в них одна нить принадл. 1 мол-ле ДНК, а др. др-й. 5) Образ. 2-го однонитевого разрыва в области полухиазм. 6) коррекция уч-в (сайтов) мол-й гетерозиготности: А) 1→2,4 →3; В) 2→3,3→4; С)2→1, 4→3. Коррекция – приведение нукл. состава 1 нити в соотв. с нукл. составом другой. Нереципропный обмен (конверсия генов) – данный мех-м общей рекомбинации был установлен в 1961 г Австралиским ученым Холидеем. Признаки бактерий: 1.Морфологические признаки - форма, окраска, размеры колоний, образуемых бактериальными кл-ми 2. Биохимические признаки – способность (+) или неспос-ть (-) синтезировать определенные в-ва (АК, витамины), а также использ определенные в-ва в кач-ве источника Е (глюкоза, фруктоза, галактоза и др.) Met+ - синтез метионина, met- - неспособность синтезир метионин. Мутанты, не способные синтезировать или усваивать определен в-ва – ауксотрофные мутанты. Признаки устойчивости К температуре t (R – устойчивы, S – чувствительны).
К антибиотикам Основные методы работы с б-ями: Метод разведения 1мл культуры + 9мл среды => в 10 раз => 1мл + 9 мл => в 100 раз и т.д. 4. Метод селективных пит сред Селективные пит среды – минимальн пит среда с добавлением в нее 1го определенного в-ва (АК, витамины). Используется для выявления ауксотрофных мутантов. Селективн пит среды: (-)min + met; (-) min + lus (лизин); (+) min + trp (триптофан). Вывод: мутант не способен синтезировать триптофан. Метод отпечатывания К полной питательной среде прикасаются специальным цилиндром, покрытым бархатной материей, и затем касаются чистой среды. Сохраняется «рисунок» колоний. 29. СПОСОБЫ ПЕРЕНОСА ГЕН.ИНФОРМАЦИИ У БАКТЕРИЙ. ТРАНСФОРМАЦИЯ,МЕХАНИЗМ, ЗНАЧЕНИЕ. 3 осн. способа переноса ген-й инф-ии от одних кл-к к другим: 1. трансформация (при пом.изолир-й ДНК). 2. Коньюгация (путем непосредственного контакта между бакт-ми кл-ми). 3. Трансдукция (при пом бактериофагов.
2 – встраивание ДНК донора в бактер хромосому реципиента путем незаконной рекомбинации.
Схема эксп-та Эвери.
ВЫВОД:днк является носителем ген-й инф-ии, отвечает за передачу признаков от бактерий шт S к бакт шт.R.
ЗНАЧЕНИЕ ТРАНСФ-ИИ: является одним из осн-х способов переноса генов в кл-ки реципиента в генной инженерии.
Схема метода
На основе таких опытов строятся генетические карты бактерий. Особенности ген.карты: Имеет кольцевую форму; Меры расстояния между генами является время конъюгации в мин. Общий вид генетической карты бактерий:
Общая длинна ген.карты E.Coli 111 мин.
ПРЕДМЕТ И ЗАДАЧА МОЛЕКУЛЯРНОЙ БИОЛОГИИ, ЕЁ ЗНАЧЕНИЕ ДЛЯ ПРАКТИКИ. ИСТОРИЯ РАЗВИТИЯ МОЛЕКУЛЯРНОЙ БИОЛОГИИ. МБ – молодая наука, возникшая на стыке биохимии, биофизики, цитологии, генетики и ряда других биологических наук. ДР – 1938 год. Термин молекулярная биология предложен английским учёным Уивероном. Предмет – структура и функционирование важнейших биологических макромолекул: ДНК, РНК, белков Задачи – изучает: - строение и физико-химическое свойство белков и нуклеиновых кислот - процессы репликации, репарации, рекомбинации молекулы ДНК - принцип и механизмы кодирования информации о синтезе белков на молекулах ДНК и РНК - структура геномов различных организмов от вирусов до млекопитающих - молекулярные механизмы реализации наследственной информации (транскрипция, процессинг, трансляция) - мобильные генетические элементы - строение и функционирование клеточных мембран - молекулярные механизмы старения и гибели клеток Значение МБ для практики: Явл. теоретической основой генной и клеточной инженерии играет важную роль в развитии биотехнологии. Основные направления практического применяются учеными: 1. Биотехнологическое производство различ в-в. 2. Молекулярные подходы в медицине: · Генная терапия (замена дефектных генов на норм) · Диагностика лечения раковых заболеваний · Трансплантология · Культура тканей и органов · Молекулярные механизмы старения. · 3. С/Х-ые: · Получение трансгенных сортов растений и пород животных · Микроклональное размножение разных видов растений. История развития МБ: История изучения ДНК и РНК 1868 – Фридрих Мишер впервые выделил ДНК из ядер погибших лейкоцитов. 1934 – А.Н.Белоозерский впервые выделил ДНК из кл-ок растений. 1934 – Кольцов в своих работах закладывает основы МБ как науки. Основные идеи Кольцова: 1. Матричный принцип репродукции биол-х макромол-л 2. Гипотеза молекулярного строения хромосом 3. Двух нитчатая стр-ра мол-л наследственности 4. Тезис «omnis molecula ex molecula» - каждая молекула из молекул. Предшественники зарождения молекулярной биологии: Н.К. Кольцов и Н.В. Тимофеев-Ресовский. 1935 год – Н.В. Тимофеев-Ресовский опубликовал статью «о природе генных мутаций и молекулярной структуре гена». 1944 год – Э. Шредингер опубликовал работу «Что такое жизнь с точки зрения физики». 1889 год – Альтман предложил термин «нуклеиновые кислоты». 1881 год – Кёссель показал, что в состав НК входит азотистые основания, сахар рибоза/дезоксирибоза и остаток фосфорной кислоты. 1944 год – О. Эвери с сотрудниками впервые доказал, что именно ДНК является носителем генетической информации клетки. 1948 год – Р. Вендерли установил постоянство содержания ДНК в гаплоидном наборе хромосомного вида 1949-51 гг. – Э. Чаргафф устанавливает количественную закономерность – правило Чаргаффа 1952 год – М. Уилкинс и Р. Фронклин впервые провели рентгеноструктурный анализ кристаллов ДНК и показали её спиральную структуру. 1953 год – Дж. Уотсон, Ф. Крик разработали модель строения ДНК – двойная спираль, которая основывалась на правилах Чаргаффа и данных рентгенных анализов. 1962 год – Уотсон, Крик, Уилкинс удостоены Нобелевской премии за открытие структуры ДНК. 1954 год – Г. Гамов – впервые выделил концепцию генетического кода. 1954 год – Г. Стент – предложил 3 модели репликации ДНК – консервативная, полуконсервативная и дисперсную. 1956 год – А. Конберг – впервые открыл и выделил фермент ДНК-полимераза. 1956 год – Ф. Крик предсказал необходимость адаптерной/транспортной РНК. 1961 год – Ф. Крик формулирует центральную догму молекулярной биологии (ДНК -> РНК -> белок). 1961 год – Гро и Шпингельман открыли и-РНК, которая выступает в качестве посредника. 1961 год – Ф. Жакоб и Ж. Моно предложили модель Оперона. 1965 год – Р. Холли впервые поясняет структуру т-РНК. 1969 год – Арвер открывает явление рестрикции – модификации бактерий молекулами рестриктазами. 1970 год – Г. Корана впервые осуществляет искусственный химический синтез гена. 1972 год – Темин и Балтимор открывают явление обратной транскрипции у РНК-содержащих вирусов. 1972 год – П. Берг с сотрудниками конструируют первую рекомбинантную молекулу ДНК – дата рождения генной инженерии. 1973 год – А. Максан и У. Гилберт разрабатывают химический метод определение последовательности ДНК – сиквенирование 1977 год – Ф. Сенвер разрабатывает ферментативный метод сиквенирования. 50-70 -е годы – «Золотой век» МБ 1984 год – Мюллис разрабатывает метод ПЦР. 1999 год – стартует проект «Геном человека». 2001 год – полностью расшифрована структура ДНК 3 человеческих индивидуумов. 2006 – Ямахаба, Топохачи откр явление РНК-интерференции и генный нокаут. · История изучения белков 1728 год – Я. Беккери выделяет первый препарат белкового вещества белкового происхождения 1753 год – К. Нейман выделяет из куриного яйца белок альбумин и открывает явление денатурации 1806 год – Ваклен выделяет первую АК – аспарагин (из спаржи) 1846 год – Мульдер разрабатывает протеиновую теорию белков. 1858 год – Мошне получает первые кристаллы белков Конец 19 века – Фишер разрабатывает пептидную теорию белков., согл кот белки сост из АК, соед пептид связями. 1915 год – У. Брэгг впервые проводит рентгеноструктурный анализ белков и использует его для изучения пространственной стр-ры белков. 30-40 гг. 20 века – Астбери изучает простр-ую структуру фибриллярных белков. 1951 год – Польминг открывает вторич структуру белков 1960 год – Дж. Кендрю изучает 3-мерную структуру меоглобина 1968 год – Перуту изучает 3-мерную структуру гемоглобина.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 617; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.144.32 (0.189 с.) |






 Имеется рост фага на E.Coli, на К12 произошла комплементация, в результате чего фенотипически проявляется r2+.
Имеется рост фага на E.Coli, на К12 произошла комплементация, в результате чего фенотипически проявляется r2+. В результ этого этапа было установлено, что ген r2+ имеет 2-е группы комплементации.
В результ этого этапа было установлено, что ген r2+ имеет 2-е группы комплементации. Ген – кодирует белок.
Ген – кодирует белок. * 100
* 100 *1,8 * 105 = 2,34 нуклеотида;
*1,8 * 105 = 2,34 нуклеотида;
 1) Схема Ф. Крика ДНКà РНК à Белок
1) Схема Ф. Крика ДНКà РНК à Белок




 В рекомб. уч-т 2 мол-лы ДНК и следующие осн-е белки: -Rec BCD, - Rec A, -SSB
В рекомб. уч-т 2 мол-лы ДНК и следующие осн-е белки: -Rec BCD, - Rec A, -SSB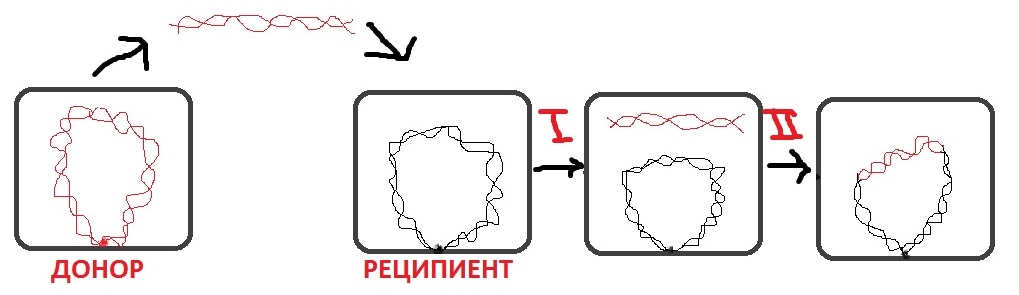
 схема опыта Гриффитса. s(гладкий)-вирулентные, R(шероховатый) невирулентные(мутанты)
схема опыта Гриффитса. s(гладкий)-вирулентные, R(шероховатый) невирулентные(мутанты)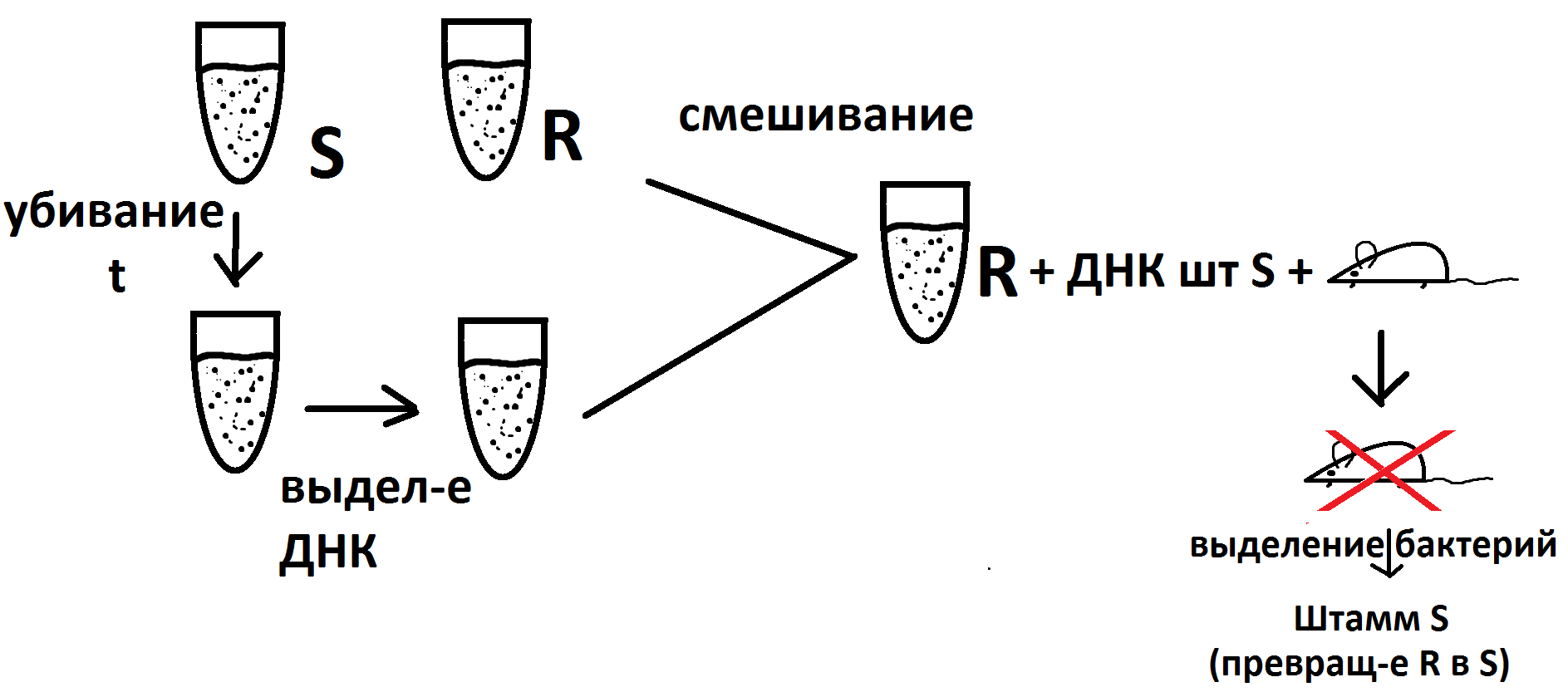
 МОЛЕК-Й МЕХ-М ТРАНСФ-ИИ. для осущ-я трансф-ии кл-ки рец-ента должны нах-ся в сост-ии компетентности, кот.они приобретают в лаг-фазе роста.
МОЛЕК-Й МЕХ-М ТРАНСФ-ИИ. для осущ-я трансф-ии кл-ки рец-ента должны нах-ся в сост-ии компетентности, кот.они приобретают в лаг-фазе роста.




