Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Схема 2. Цикл трикарбоновых к-т и катаболич. р-ции. Двойными стрелками отмечены многостадийные р-ции; семиальдегиды к-т w-оксокислоты.Содержание книги
Поиск на нашем сайте
Схема 2. Цикл трикарбоновых к-т и катаболич. р-ции. Двойными стрелками отмечены многостадийные р-ции; семиальдегиды к-т w-оксокислоты.
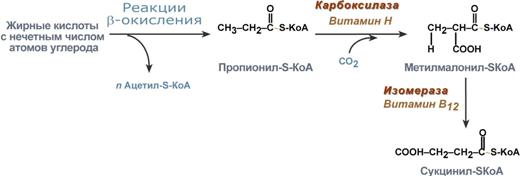
Пример. Окисление пальмитиновой кислоты · так как имеется 16 атомов углерода, то при β-окислении образуется 8 молекул ацетил-SКоА. Последний поступает в ЦТК, при его окислении в одном обороте цикла образуется 3 молекулы НАДН, 1 молекула ФАДН2 и 1 молекула ГТФ, что эквивалентно 12 молекулам АТФ. Итак, 8 молекул ацетил-S-КоА обеспечат образование 8×12= 96 молекул АТФ. · для пальмитиновой кислоты число циклов β-окисления равно 7. В каждом цикле образуется 1 молекула ФАДН2 и 1 молекула НАДН. Поступая в дыхательную цепь, в сумме они "дадут" 5 молекул АТФ. Таким образом, в 7 циклах образуется 7×5= 35 молекул АТФ. · двойных связей в пальмитиновой кислоте нет. · на активацию жирной кислоты идет 1 молекула АТФ, которая, однако, гидролизуется до АМФ, то есть тратятся 2 макроэргические связи или две АТФ. Таким образом, суммируя, получаем 96+35-2 =129 молекул АТФ образуется при окислении пальмитиновой кислоты. Окисление нечетных и ненасыщенных жирных кислот Окисление жирных кислот с нечетным числом углеродных атомов Жирные кислоты с нечетным числом углеродов поступают в организм с растительной пищей и морепродуктами. Их окисление происходит по обычному пути до последней реакции, в которой образуется пропионил-SКоА. Суть превращений пропионил-SКоА сводится к его карбоксилированию, изомеризации и образованию сукцинил-SКоА. В этих реакциях участвуют биотин и витамин В12.
Последние реакции окисления жирных кислот с нечетным числом атомов углерода Окисление ненасыщенных жирных кислот. При окислении ненасыщенных жирных кислот возникает потребность клетки в дополнительных ферментах изомеразах. Эти изомеразы перемещают двойные связи в жирнокислотных остатках из γ - в β - положение и переводят природные двойные связи из цис - в транс -положение. Таким образом, уже имеющаяся двойная связь готовится к β-окислению и пропускается первая реакция цикла, в которой участвует ФАД.
Пример. Окисление линолевой кислоты · так как число атомов углерода равно 18, то количество молекул ацетил-S-КоА равно 9. Значит при его окислении в ЦТК образуется 9×12=108 молекул АТФ. · исходя из формулы (n/2 - 1) число циклов β-окисления равно 8. При расчете получаем 8×5=40 молекул АТФ. · в кислоте имеются 2 двойные связи. Следовательно, в двух циклах β-окисления не образуется 2 молекулы ФАДН2, что равноценно потере 4 молекул АТФ. · на активацию жирной кислоты тратятся 2 макроэргические связи. · таким образом, энергетический выход 108 + 40 - 4 - 2 =142 молекулы АТФ
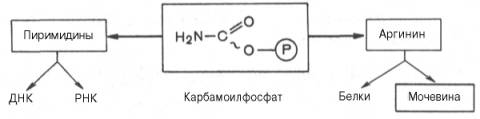
ЦИКЛ МОЧЕВИНЫ. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного, обмена. На долю мочевины приходится до 80–85% от всего азота мочи. Основным и, возможно, единственным местом синтеза мочевины является печень. Впервые Г. Кребс и К. Гензеляйт в 1932 г. вывели уравнения реакций синтеза мочевины, которые представлены в виде цикла, получившего в литературе название орнитинового цикламочевинообразования Кребса. Следует указать, что в биохимии это была первая циклическая система метаболизма, описание которой почти на 5 лет опеределило открытие Г. Кребсом другого метаболического процесса – цикла трикарбоновых кислот (см. ранее). Дальнейшие исследования в основном подтвердили циклический характер биосинтеза мочевины в печени. Благодаря исследованиям Г. Коена, С. Ратнер и сотр. были уточнены промежуточные этапы и ферментные системы, катализирующие образование мочевины. Таким образом, весь цикл мочевинообразования может быть представлен следующим образом. На первом этапе синтезируется макроэрги-ческое соединение карбамоилфосфат – метаболически активная форма аммиака, используемая в качестве исходного продукта для синтеза пи-римидиновых нуклеотидов (соответственно ДНК и РНК) и аргинина (соответственно белка и мочевины):
К настоящему времени открыты три разных пути синтеза карбамоил-фосфата de novo, катализируемые тремя разными ферментами. Первую необратимую реакцию катализирует регуляторный фермент – аммиакзави-симая карбамоилфосфатсинтетаза (КФ 6.3.4.16):
Реакция требует затраты двух молекул АТФ, открыта в митохондриях клеток печени и используется преимущественно для синтеза аргинина и мочевины. В этой реакции в качестве активного стимулирующего ал-лостерического эффектора действует N-ацетилглутамат. Вторую, также необратимую, реакцию катализирует глутаминзависимая карбамоилфосфатсинтетаза (КФ 6.3.5.5):
Данная реакция открыта в цитозоле клеток животных и требует наличия ионов Mg2+. Следует указать, что благодаря включению гидролитической стадии она используется преимущественно для синтеза пиримидиновых нуклеотидов (см. далее). Фермент широко распространен в клетках животных. Третью обратимую реакцию катализирует карбаматкиназа (КФ 2.7.2.2):
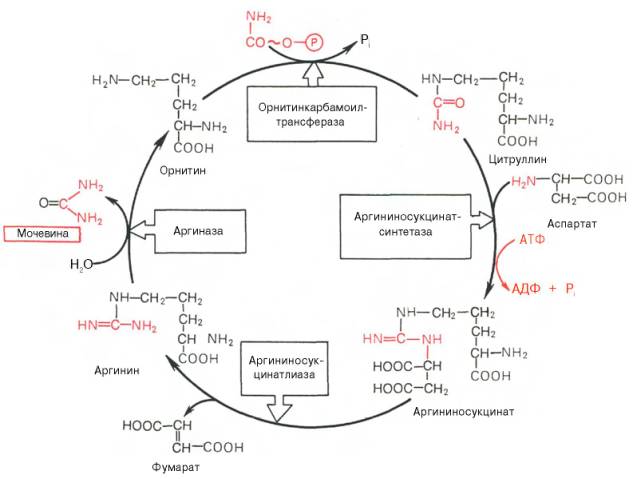
Реакция открыта у разных микроорганизмов и, возможно, используется скорее для ресинтеза АТФ, чем для синтеза карбамоилфосфата. На втором этапе цикла мочевинообразования происходит конденсация карбамоилфосфата и орнитина с образованием цитруллина; реакцию катализирует орнитин-карбамоилтрансфераза (КФ 2.1.3.3). На следующей стадии цитруллин превращается в аргинин в результате двух последовательно протекающих реакций. Первая из них, энергозави-симая,– это конденсация цитруллина и аспарагиновой кислоты с образованием аргининосукцината (эту реакцию катализирует аргининосукцинат-синтетаза). Аргининосукцинат распадается в следующей реакции на аргинин и фумарат при участии другого фермента – аргининосукцинатлиазы. На последнем этапе аргинин расщепляется на мочевину и орнитин под действием аргиназы. Необходимо подчеркнуть, что аргиназа содержится в печени тех животных, которые экскретируют с мочой мочевину как основной и конечный продукт азотистого обмена. В печени птиц, например, аргиназа отсутствует, поскольку птицы вместо мочевины выделяют мочевую кислоту. Орни-тиновый цикл мочевинообразования с учетом новых данных представлен на рис. Суммарная реакция синтеза мочевины без учета всех промежуточных продуктов может быть представлена в следующем виде:
Данная реакция сопровождается снижением свободной энергии (ΔG0 = –40 кДж), поэтому процесс всегда протекает в направлении синтеза мочевины. Следует указать, что синтез мочевины энергетически дорого обходится организму. На синтез одной молекулы мочевины требуется
Рис. Орнитиновый цикл синтеза мочевины в печени. затрата четырех высокоэнергетических фосфатных групп: две молекулы АТФ расходуются на синтез карбамоилфосфата и одна – на образование аргининоянтарной кислоты, при этом АТФ расщепляется на АМФ и РРi, который при гидролизе также образует две молекулы Рi. Из приведенной схемы процесса мочевинообразования нетрудно видеть, что один из атомов азота мочевины имеет своим источником свободный аммиак (через карбамоилфосфат); второй атом азота поступает из ас-партата. Аммиак образуется главным образом в процессе глутаматде-гидрогеназной реакции. В процессе пополнения запасов аспартата участвуют три сопряженные реакции: сначала фумарат под действием фумаразы присоединяет воду и превращается в малат, который окисляется при участии малатдегидрогеназы с образованием оксалоацетата; последний в реакции трансаминирования с глутаматом вновь образует аспартат. Учитывая известные фактические данные о механизмах обезвреживания аммиака в организме, можно сделать следующее заключение. Часть аммиака используется на биосинтез аминокислот путем восстановительного аминирования α-кетокислот по механизму реакции трансаминирования. Аммиак связывается при биосинтезе глутамина и аспарагина. Некоторое количество аммиака выводится с мочой в виде аммонийных солей. В форме креатинина, который образуется из креатина и креатинфосфата, выделяется из организма значительная часть азота аминокислот. Наибольшее количество аммиака расходуется на синтез мочевины, которая выводится с мочой в качестве главного конечного продукта белкового обмена в организме человека и животных. Подсчитано, что в состоянии азотистого равновесия организм взрослого здорового человека потребляет и соответственно выделяет примерно 15 г азота в сутки; из экскретируемого с мочой количества азота на долю мочевины приходится около 85%, креатинина – около 5%, аммонийных солей – 3%, мочевой кислоты – 1% и на другие формы – около 6%. В процессе эволюции живые организмы выработали различные типы азотистого обмена. Это аммониотелический тип, при котором главным конечным продуктом азотистого обмена является аммиак; он свойствен преимущественно рыбам. При уреотелическом типе обмена основным конечным продуктом обмена белков является мочевина; такой тип характерен для человека и животных. Урикотелический тип характерен для птиц и рептилий; главным конечным продуктом данного типа обмена является мочевая кислота.
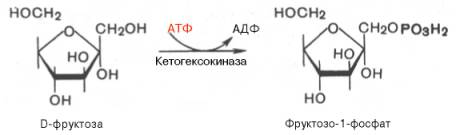
Фруктоза. Установлено, что фруктоза, присутствующая в свободном виде во многих фруктах и образующаяся в тонкой кишке из сахарозы, всасываясь в тканях, может подвергаться фосфорилированию во фруктозо-6-фосфат при участии фермента гексокиназы и АТФ:
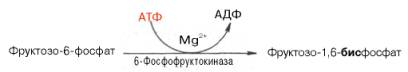
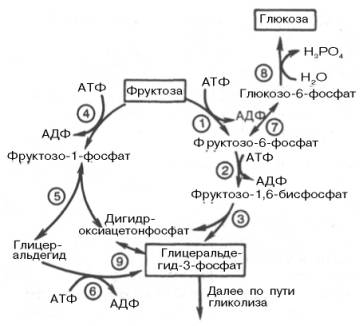
Эта реакция ингибируется глюкозой. Образовавшийся фруктозо-6-фос-фат либо превращается в глюкозу через стадии образования глюкозо-6-фосфата и последующего отщепления фосфорной кислоты (рис. 10.4), либо подвергается дальнейшим превращениям. Из фруктозо-6-фосфата под влиянием 6-фосфофруктокиназы и АТФ образуется фруктозо-1,6-бисфос-фат:
Далее фруктозо-1,6-бисфосфат может подвергаться дальнейшим превращением по пути гликолиза. Таков главный путь включения фруктозы в метаболизм мышечной ткани, почек, жировой ткани. В печени, однако, для этого существует другой путь. В ней имеется фермент фруктокиназа, который катализирует фосфорилирование фруктозы не по 6-му, а по 1-му атому углерода:
Эта реакция не блокируется глюкозой. Образовавшийся фруктозо-1-фосфат расщепляется затем под действием кетозо-1-фосфатальдолазы на диоксиацетонфосфат и D-глицеральдегид: Фруктозо-1-фосфат <=> Диоксиацетонфосфат + D-глицеральдегид. Образовавшийся D-глицеральдегид под влиянием соответствующей киназы (триокиназы) подвергается фосфорилированию до глицеральде-гид-3-фосфата. В этот же промежуточный продукт гликолиза переходит и дигидроксиацетонфосфат. Существует врожденная аномалия обмена фруктозы, или эссенциальная фруктозурия, которая связана с врожденным недостатком фермента фрук-токиназы, т.е. в организме не образуется фруктозо-1-фосфат. В результате обмен фруктозы возможен только путем фосфорилирования до фрук-тозо-6-фосфата, но эта реакция тормозится глюкозой, вследствие чего фруктоза накапливается в крови. «Почечный порог» для фруктозы очень низок, поэтому фруктозурия обнаруживается уже при концентрации фруктозы в крови 0,73 ммоль/л.
Рис. 10.4. Метаболизм фруктозы. 1 - гексокиназа; 2 - 6-фосфофруктоки-наза; 3 - фруктозобисфосфатальдолаза; 4 - кетогексокиназа; 5 - кетозо-1-фосфа-тальдолаза; 6 - триокиназа; 7 - глюко-зофосфатизомераза; 8 - глюкозо-6-фос-фатаза; 9 - триозофосфатизомераза.
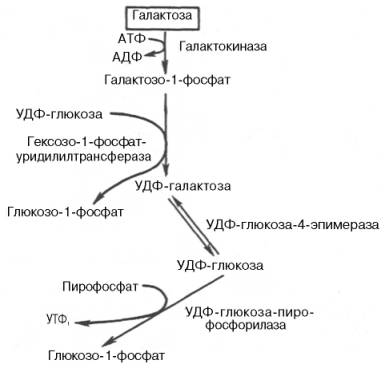
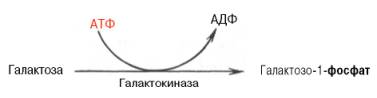
Рис. 10.5. Метаболизм галактозы. Галактоза. Основным источником галактозы является лактоза пищи, которая в пищеварительном тракте расщепляется до галактозы и глюкозы (рис. 10.5). Обмен галактозы начинается с превращения ее в галактозо-1-фосфат. Эта реакция катализируется галактокиназой с участием АТФ:
В следующей реакции в присутствии УДФ-глюкозы фермент гексо-зо-1-фосфатуридилилтрансфераза катализирует превращение галактозо-1-фосфата в глюкозо-1-фосфат, одновременно образуется уридиндифосфат-галактоза (УДФ-галактоза):
Образовавшийся глюкозо-1-фосфат в дальнейшем либо переходит в глюкозо-6-фосфат и далее подвергается уже известным превращениям, либо под влиянием фосфатазы образует свободную глюкозу, а УДФ-га-лактоза подвергается весьма своеобразной эпимеризации:
Затем УДФ-глюкоза-пирофосфорилаза катализирует расщепление УДФ-глюкозы с образованием глюкозо-1-фосфата:
О дальнейших превращениях глюкозо-1-фосфата см. ранее. Одно из патологических состояний, возникающих в результате нарушения обмена углеводов,– это рецессивно наследуемое заболевание га-лактоземия. При этом заболевании общее содержание моносахаридов в крови повышается главным образом за счет уровня галактозы, достигая 11,1–16,6 ммоль/л. Концентрация глюкозы в крови существенно не изменяется. Кроме галактозы, в крови накапливается также галактозо-1-фос-фат. Галактоземия приводит к умственной отсталости и катаракте хрусталика. Возникновение данной болезни у новорожденных связано с недостатком фермента гексозо-1-фосфатуридилилтрансферазы. С возрастом наблюдается ослабление этого специфического нарушения обмена углеводов.
Схема 2. Цикл трикарбоновых к-т и катаболич. р-ции. Двойными стрелками отмечены многостадийные р-ции; семиальдегиды к-т w-оксокислоты.
|
||||
|
Последнее изменение этой страницы: 2017-01-24; просмотров: 271; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.123.10 (0.008 с.) |