Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Современная классификация ферментов и их номенклатура
ФЕРМЕНТЫ Ферменты, или энзимы – это белковой природы, образующиеся и функционирующие во всех живых организмах. Слово фермент происходит от лат. fermentum – закваска, другое название ферментов – энзимы от греч. en zyme – в дрожжах. Впервые ферментативные процессы были открыты в бродильном производстве. Современная ферментология или энзимология – это наука о ферментах, их структурной организации. Она решает задачи изучения механизмов действия ферментов, путей регуляции ферментной активности. Такой интерес к биокатализаторам не случаен. Ферменты – это важнейшие компоненты клетки, без них невозможны синтез, распад и взаимопревращения в живых организмах. Через ферментный аппарат и регуляцию его активности происходит и регуляция скорости метаболических реакций. Изучение важно для биологии, медицины, фармации, многих областей народного хозяйства. Установлено, что многие заболевания человека связаны с нарушением деятельности ферментов, целый ряд ферментов является лекарственными препаратами. Общие и специфические свойства ферментов. Являясь катализаторами, то есть веществами, ускоряющими реакции, ферменты имеют ряд общих свойств с химическими небиологическими катализаторами. 1. Ферменты и входят в состав конечных Р и выходят из реакции в неизменном виде, они не расходуются в процессе катализа. 2. Ферменты не могут возбудить реакций, противоречащим законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них. 3. Ферменты, как правило, не смещают положения равновесия реакции, а лишь ускоряют его достижение. Вместе с тем ферменты обладают и специфическими свойствами: 1. По химическому строению ферменты являются белками (>99,9). 2. Эффективность ферментов на несколько порядков выше, чем небиологических катализаторов. Например: H2O2 ® H2O + ½ O2 а) если реакция протекает без катализатора, то Еа = 75,7 кдж/моль, пузырьки О2 почти не видны; б) если прибавить катализатор небиологический то Еа = 54,1 кдж/моль, пузырьки отчетливо видны; в) если прибавить биологический катализатор каталазу, то Еа = 18 кдж/моль, раствор просто «кипит». 3. Высокая специфичность – каждый фермент катализирует одну единственную реакцию или одну группу реакций, тогда как неорганические катализаторы действуют при различных типах реакций. 4. Ферменты катализируют реакции в «мягких» условиях: при нормальном Р, рН = 7,0. Для неорганических катализаторов присуща необходимость экстремальных значений рН, нагревание до очень высоких температур. Химическая природа и строение ферментов. Важным доказательством белковой природы ферментов явились работы Пастера (инактивация ферментов брожения при кипячении), Павлова (доказал белковую природу пепсина – фермента желудочного сока) и т.д. 1) важный признак белковой природы ферментов – их большая Mr. Например, у ДГ Mr = 4 ´106; 4,8 ´105 и т.д. 2) растворы ферментов имеют коллоидный характер – они не проходят через полунепроницаемую мембрану, осаждаются из растворов теми же реактивами, что и белки; 3) ферменты денатурируют и теряют свою активность под влиянием высокой температуры, УЗ, сильных щелочей и других факторов; 4) ферменты, как и белки, обладают амфотерными свойствами, электрофоретической подвижностью и рI. 5) как и белки, ферменты обладают высокой специфичностью; 6) наконец, прямым доказательством белковой природы ферментов явился искусственный синтез ферментов (рибонуклеаза, лизоцим), которые не отличаются по свойствам и биологической активности от природных аналогов.
В ферментах-протеидах белковая часть называется апоферментом, а небелковая – простетической группой. Общее название сложных ферментов – холофермент. Если простетическая группа слабо связана с белковой частью и легко диссоциирует, она называется коферментом. Кофермент может соединяться с разными белками, и именно белковая часть определяет специфичность действия сложных ферментов. Вместе с тем, без кофермента сложный фермент не может функционировать, так как кофермент, как правило, непосредственно контактирует с субстратом (S) и служит в качестве переносчика ē, атомов или группы атомов. Кофакторы, или коферменты это: 1) ионы Me – Mg2+, Ca2+, Cu2+, Mn2+ b lh/$ 2) витамины и их фосфорные эфиры – витамин Н (биотин)(в составе коферментов карбоксилирования), липоевая, фолиевая кислоты, В1 и др.; 3) мононуклеотиды ФМН, АТФ, ГТФ и т.д.; 4) большая часть коферментов – это динуклеотиды НАД, НАДФ, HS-KoA и др. При гиповитаминозах и авитаминозах недостаток витаминов ослабляет биосинтез многих ферментов и вызывает гипокоферменто з. Коферменты выполняют также важную роль в стабилизации и охране апоферментов. Последние без коферментов скорее разрушаются протеолитическими ферментами. Таким образом, сами по себе ни коферменты, ни апоферменты каталитической активностью не обладают, а только в комплексе друг с другом. Молекулы S-в чаще всего имеют небольшие размеры по сравнению с молекулами ферментов, поэтому при образовании Е-S-го комплекса в контакт с S вступает ограниченная часть аминокислот ППЦ, которая называется активным центром (АЦФ). У Е-протеидов в состав АЦФ входят также и простетические группы. Таким образом, активный центр фермента – это уникальная комбинация аминокислотных остатков, обеспечивающих непосредственное взаимодействие Е и S и прямое участие в акте катализа.
При сближении Е и S и образовании ЕS-комплекса нуклеофильные и электрофильные группы АЦФ, отдавая или принимая ē-ны, тем самым как бы «расшатывают» электронную структуру S, активируя его и ускоряя химическую реакцию. Есть ферменты, имеющие несколько АЦФ – уреаза–3; алкоголь ДГ–4; ацетилхолингетераза – 25-30 АЦФ у разных животных. Аллостерические центры ферментов. Кроме АЦФ, у ферментов имеются и аллостерические (греч. allos – другой) или инопространственные центры. Это место воздействия на ферменты разных регуляторных факторов. Взаимосвязь между АЦФ и АЛЦФ называется аллостерическими взаимодействиями. Важная особенность АЛЦФ – их более высокая по сравнению с АЦФ чувствительность к различным воздействиям. Например, при повышении температуры и применении рН раньше затормаживается функция АЛЦФ. В частности, при повышении температуры аллостерический центр гексокиназы теряет чувствительность к регуляторному воздействию инсулина и глюкокортикоидов, а функциональная активность ферментов сохраняется и продолжает фосфорилировать глюкозу за счет АТФ.
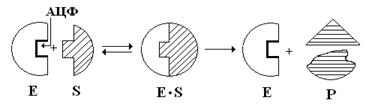
Регуляторное воздействие на аллостерический центр оказывают: различные метаболиты ферментативных реакций, гормоны и продукты их обмена, медиаторы НС и т.д. Они называются эффекторами или модификаторами. Их молекулы не сходны с молекулами S-в. Связываясь с аллостерическим центром, эффекторы изменяют ТС и ЧС ферментов, тем самым изменяют конфигурацию АЦФ, что приводит к повышению (активированию) или понижению (ингибированию) ферментативной активности. Изоферменты – это молекулярные формы ферментов, возникающие вследствие генетических различий в ПС ферментного белка. Это группа ферментов, которые присутствуют внутри одного вида (ЛДГ) или внутри одной клетки (аминотрансферазы), имеют одинаковый механизм действия, но отличаются по некоторым физико-химическим свойствам: электрофоретической подвижности, иммунобиологическим реакциям. Например, Номенклатура ферментов. Существует два типа названий ферментов: 1) рабочее, или тривиальное; 2) систематическое. Рабочее название – название S + тип реакции + окончание аза. Лактат + реакция дегидрогенизации + аза ®ЛДГ. Для некоторых ферментов оставлены их рабочие названия: пепсин, трипсин и т.д. Систематическое название – название обоих S + тип реакции + аза. Систематическое название дается только тем ферментам, структура которых полностью изучена. В одной клетке находится ~ 104 молекул ферментов, катализируется ~ 2000 разных реакций. В настоящее время известно около 1800 ферментов, в кристаллическом виде получено ~ 150 ферментов. Механизм действия ферментов Большую роль в развитии представлений о механизме действия ферментов сыграли классические работы Михаэлиса и Ментен, которые развили положения о Е-S-х комплексах. Согласно их представлениям (1915г.), ферменты обратимо соединяются со своим S, образуя нестойкий промежуточный продукт – Е-S-комплекс,
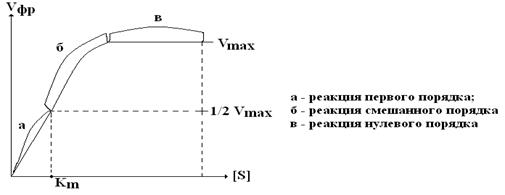
АЦФ, как правило, располагается в глубине молекулы Е. Математическая обработка реакции образование ЕS-комплекса позволила вывести уравнение, которое называется уравнением Михаэлиса-Ментен:
где Vфр – наблюдаемая скорость фр; Vmax – максимальная скорость фр при неполном насыщении фермента S-том; [S] – концентрация S; Км – константа Михаэлиса-Ментен. Графически уравнение Михаэлиса-Ментен имеет следующий вид:
При низкой [S] Vфр прямо пропорциональна [S] в каждый данный момент времени (реакция 1-го порядка). Из уравнения Михаэлиса-Ментен также следует, что при низком значении Км и высоком значении [S] Vфр является максимальной (в) и не зависит от [S] – это реакция нулевого порядка. Реакция нулевого порядка соответствует явлению, которое называется полным насыщением фермента субстратом. Гипербола, выражающая зависимость Vфр от [S], называется кривой Михаэлиса. Чтобы правильно определить активность ферментов, нужно добиться реакции нулевого порядка, то есть определять Vфр при насыщающих концентрациях S.
ЛЕКЦИЯ 7 ФЕРМЕНТЫ Ферменты, или энзимы – это белковой природы, образующиеся и функционирующие во всех живых организмах. Слово фермент происходит от лат. fermentum – закваска, другое название ферментов – энзимы от греч. en zyme – в дрожжах. Впервые ферментативные процессы были открыты в бродильном производстве. Современная ферментология или энзимология – это наука о ферментах, их структурной организации. Она решает задачи изучения механизмов действия ферментов, путей регуляции ферментной активности. Такой интерес к биокатализаторам не случаен. Ферменты – это важнейшие компоненты клетки, без них невозможны синтез, распад и взаимопревращения в живых организмах. Через ферментный аппарат и регуляцию его активности происходит и регуляция скорости метаболических реакций. Изучение важно для биологии, медицины, фармации, многих областей народного хозяйства. Установлено, что многие заболевания человека связаны с нарушением деятельности ферментов, целый ряд ферментов является лекарственными препаратами. Общие и специфические свойства ферментов. Являясь катализаторами, то есть веществами, ускоряющими реакции, ферменты имеют ряд общих свойств с химическими небиологическими катализаторами. 1. Ферменты и входят в состав конечных Р и выходят из реакции в неизменном виде, они не расходуются в процессе катализа. 2. Ферменты не могут возбудить реакций, противоречащим законам термодинамики, они ускоряют только те реакции, которые могут протекать и без них. 3. Ферменты, как правило, не смещают положения равновесия реакции, а лишь ускоряют его достижение. Вместе с тем ферменты обладают и специфическими свойствами: 1. По химическому строению ферменты являются белками (>99,9). 2. Эффективность ферментов на несколько порядков выше, чем небиологических катализаторов. Например: H2O2 ® H2O + ½ O2 а) если реакция протекает без катализатора, то Еа = 75,7 кдж/моль, пузырьки О2 почти не видны; б) если прибавить катализатор небиологический то Еа = 54,1 кдж/моль, пузырьки отчетливо видны; в) если прибавить биологический катализатор каталазу, то Еа = 18 кдж/моль, раствор просто «кипит». 3. Высокая специфичность – каждый фермент катализирует одну единственную реакцию или одну группу реакций, тогда как неорганические катализаторы действуют при различных типах реакций. 4. Ферменты катализируют реакции в «мягких» условиях: при нормальном Р, рН = 7,0. Для неорганических катализаторов присуща необходимость экстремальных значений рН, нагревание до очень высоких температур. Химическая природа и строение ферментов. Важным доказательством белковой природы ферментов явились работы Пастера (инактивация ферментов брожения при кипячении), Павлова (доказал белковую природу пепсина – фермента желудочного сока) и т.д. 1) важный признак белковой природы ферментов – их большая Mr. Например, у ДГ Mr = 4 ´106; 4,8 ´105 и т.д. 2) растворы ферментов имеют коллоидный характер – они не проходят через полунепроницаемую мембрану, осаждаются из растворов теми же реактивами, что и белки; 3) ферменты денатурируют и теряют свою активность под влиянием высокой температуры, УЗ, сильных щелочей и других факторов; 4) ферменты, как и белки, обладают амфотерными свойствами, электрофоретической подвижностью и рI. 5) как и белки, ферменты обладают высокой специфичностью; 6) наконец, прямым доказательством белковой природы ферментов явился искусственный синтез ферментов (рибонуклеаза, лизоцим), которые не отличаются по свойствам и биологической активности от природных аналогов.
В ферментах-протеидах белковая часть называется апоферментом, а небелковая – простетической группой. Общее название сложных ферментов – холофермент. Если простетическая группа слабо связана с белковой частью и легко диссоциирует, она называется коферментом. Кофермент может соединяться с разными белками, и именно белковая часть определяет специфичность действия сложных ферментов. Вместе с тем, без кофермента сложный фермент не может функционировать, так как кофермент, как правило, непосредственно контактирует с субстратом (S) и служит в качестве переносчика ē, атомов или группы атомов. Кофакторы, или коферменты это: 1) ионы Me – Mg2+, Ca2+, Cu2+, Mn2+ b lh/$ 2) витамины и их фосфорные эфиры – витамин Н (биотин)(в составе коферментов карбоксилирования), липоевая, фолиевая кислоты, В1 и др.; 3) мононуклеотиды ФМН, АТФ, ГТФ и т.д.; 4) большая часть коферментов – это динуклеотиды НАД, НАДФ, HS-KoA и др. При гиповитаминозах и авитаминозах недостаток витаминов ослабляет биосинтез многих ферментов и вызывает гипокоферменто з. Коферменты выполняют также важную роль в стабилизации и охране апоферментов. Последние без коферментов скорее разрушаются протеолитическими ферментами. Таким образом, сами по себе ни коферменты, ни апоферменты каталитической активностью не обладают, а только в комплексе друг с другом. Молекулы S-в чаще всего имеют небольшие размеры по сравнению с молекулами ферментов, поэтому при образовании Е-S-го комплекса в контакт с S вступает ограниченная часть аминокислот ППЦ, которая называется активным центром (АЦФ). У Е-протеидов в состав АЦФ входят также и простетические группы. Таким образом, активный центр фермента – это уникальная комбинация аминокислотных остатков, обеспечивающих непосредственное взаимодействие Е и S и прямое участие в акте катализа.
При сближении Е и S и образовании ЕS-комплекса нуклеофильные и электрофильные группы АЦФ, отдавая или принимая ē-ны, тем самым как бы «расшатывают» электронную структуру S, активируя его и ускоряя химическую реакцию. Есть ферменты, имеющие несколько АЦФ – уреаза–3; алкоголь ДГ–4; ацетилхолингетераза – 25-30 АЦФ у разных животных. Аллостерические центры ферментов. Кроме АЦФ, у ферментов имеются и аллостерические (греч. allos – другой) или инопространственные центры. Это место воздействия на ферменты разных регуляторных факторов. Взаимосвязь между АЦФ и АЛЦФ называется аллостерическими взаимодействиями. Важная особенность АЛЦФ – их более высокая по сравнению с АЦФ чувствительность к различным воздействиям. Например, при повышении температуры и применении рН раньше затормаживается функция АЛЦФ. В частности, при повышении температуры аллостерический центр гексокиназы теряет чувствительность к регуляторному воздействию инсулина и глюкокортикоидов, а функциональная активность ферментов сохраняется и продолжает фосфорилировать глюкозу за счет АТФ.
Регуляторное воздействие на аллостерический центр оказывают: различные метаболиты ферментативных реакций, гормоны и продукты их обмена, медиаторы НС и т.д. Они называются эффекторами или модификаторами. Их молекулы не сходны с молекулами S-в. Связываясь с аллостерическим центром, эффекторы изменяют ТС и ЧС ферментов, тем самым изменяют конфигурацию АЦФ, что приводит к повышению (активированию) или понижению (ингибированию) ферментативной активности. Изоферменты – это молекулярные формы ферментов, возникающие вследствие генетических различий в ПС ферментного белка. Это группа ферментов, которые присутствуют внутри одного вида (ЛДГ) или внутри одной клетки (аминотрансферазы), имеют одинаковый механизм действия, но отличаются по некоторым физико-химическим свойствам: электрофоретической подвижности, иммунобиологическим реакциям. Например, Современная классификация ферментов и их номенклатура Согласно классификации, разработанной Международной комиссией по ферментам (1961г.) все ферменты делят на шесть классов. Классы делятся на подклассы, а последние – на подподклассы, внутри которых ферменту присваивается свой порядковый номер. Например, ЛДГ имеет шифр. 1.1.1.27. 1- название класса – оксидоредуктазы – указывает тип ферментной реакции; 2-я цифра показывает номер подкласса; подкласс уточняет действие фермента, так как указывает в общих чертах на природу химической группы S. Подподкласс – уточняет природу атакуемой химической связи S или природу акцептора. № 27 – порядковый № ЛДГ в подподклассе. 1) Оксидоредуктазы – катализируют реакции окисления-восстановления – содержат 17 подклассов и ~ 480 Е. Например: ЛДГ. 2) Трансферазы – катализируют реакции переноса различных групп от одного S (донор) к другому (акцептор). 8 подклассов в зависимости от вида переносимых групп и ~ 500 Е. Например: фермент холинацетилтрансфераза – катализирует перенос остатка уксусной кислоты на холин ® ацетилхолин. 3) Гидролазы – катализируют разрыв связей в S с присоединением воды. Содержат 11 подклассов и ~ 460 Е. К гидролазам относятся пищеварительные ферменты, а также ферменты, входящие в состав лизосом и других органоидов клетки, где они способствуют распаду крупных молекул на более мелкие. 4) Лиазы – катализируют реакции разрыва связей в S без присоединения воды или окисления. Содержат 4 подкласса и ~ 230 Е – участвуют в промежуточных реакциях синтеза (синтазы) или распада (дегидратазы). 5) Изомеразы – катализируют превращение изомеров друг в друга. От типа реакции изомеризации – различают мутазы (рацемазы). Содержат 5 подклассов и ~ 80 Е. 6) Лигазы (синтетазы) – катализируют реакции соединения двух молекул S с использованием Е фосфатных связей. Источником ферментов является АТФ и др. Содержат 5 подклассов, ~ 80 Е (например, гексокиназа, фосфофруктокиназа). Номенклатура ферментов. Существует два типа названий ферментов: 1) рабочее, или тривиальное; 2) систематическое. Рабочее название – название S + тип реакции + окончание аза. Лактат + реакция дегидрогенизации + аза ®ЛДГ. Для некоторых ферментов оставлены их рабочие названия: пепсин, трипсин и т.д. Систематическое название – название обоих S + тип реакции + аза. Систематическое название дается только тем ферментам, структура которых полностью изучена. В одной клетке находится ~ 104 молекул ферментов, катализируется ~ 2000 разных реакций. В настоящее время известно около 1800 ферментов, в кристаллическом виде получено ~ 150 ферментов.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 439; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.23.124 (0.01 с.) |



 существует в виде пяти изоферментов. Хотя они катализируют одну и ту же реакцию, отличаются по своей Кт. У них одинаковая Mr (134.000) и по 4 ППЦ с Mr 33.500. Пять изоферментов соответствую пяти различным комбинациям двух разных типов ППЦ, названных M – (muscle) и H– (heart) цепями. Изофермент М4 – находится в мышечной ткани, содержит идентичные 4М-цепи; Н4 – находится в сердце, содержит идентичные 4Н-цепи. Остальные три изофермента – это различные сочетания М3Н; М2Н2; МН3. Два типа цепей – М и Н, кодируются двумя различными генами, сочетание ППЦ находится под генетическим контролем. Наличие изоферментов и изменение их соотношения в организме – один из способов регуляции ферментов.
существует в виде пяти изоферментов. Хотя они катализируют одну и ту же реакцию, отличаются по своей Кт. У них одинаковая Mr (134.000) и по 4 ППЦ с Mr 33.500. Пять изоферментов соответствую пяти различным комбинациям двух разных типов ППЦ, названных M – (muscle) и H– (heart) цепями. Изофермент М4 – находится в мышечной ткани, содержит идентичные 4М-цепи; Н4 – находится в сердце, содержит идентичные 4Н-цепи. Остальные три изофермента – это различные сочетания М3Н; М2Н2; МН3. Два типа цепей – М и Н, кодируются двумя различными генами, сочетание ППЦ находится под генетическим контролем. Наличие изоферментов и изменение их соотношения в организме – один из способов регуляции ферментов. который в конце реакции распадается на ферменты и продукты реакции (Р). Фактически в природе идет ступенчатое превращение S через целый ряд промежуточных реакций: ES1→ ES2→ ES3 … → E + P. Схематически преобразование S в Р можно представить таким образом:
который в конце реакции распадается на ферменты и продукты реакции (Р). Фактически в природе идет ступенчатое превращение S через целый ряд промежуточных реакций: ES1→ ES2→ ES3 … → E + P. Схематически преобразование S в Р можно представить таким образом: