Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ГЛАВА 2. Анатомия и гистология проводящей системыСтр 1 из 10Следующая ⇒
АРИТМИИ СЕРДЦА
Механизмы, диагностика, лечение
Под редакцией В. Дж. Мандела
Москва, Медицина, 1996.
ТОМ 1 ГЛАВА 2. Анатомия и гистология проводящей системы
Р. X. Андерсон, С. Йен Хо и А. И. Бекер (R. H. Anderson, S. Yen Но and A. E. Becker)
Приведенные в этой главе анатомические и гистологические данные большей частью основываются на первых описаниях проводящей системы, представленных Tawara [1], Keith и Flack [2, 3], а также их уточнениях, сделанных Monckeberg [4] и Koch [5, 6]. Это и неудивительно: ведь методология тех ранних исследований, микроскопия серийных срезов не претерпели за прошедшее время каких-либо изменений. А потому и результаты исследований вряд ли будут различаться. Действительно, с момента открытия ткани проводящей системы описания ее морфологии прекрасно согласуются между собой. Разногласия, возникшие в последние годы, являются в основном результатом интерпретации морфологических данных в свете электрофизиологических наблюдений [7, 8], т. е. более поздних свидетельств, которые редко бывают однозначными [?]. К сожалению, микроскопическое изучение той или иной клетки не позволяет сделать определенных выводов о ее функции.
Синусовый узел Морфология
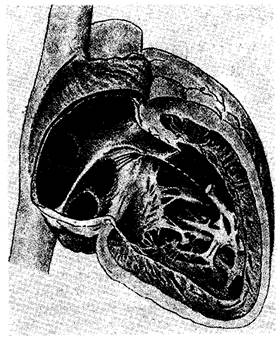
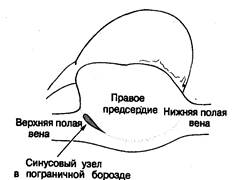
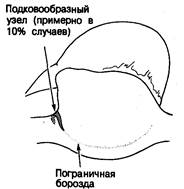
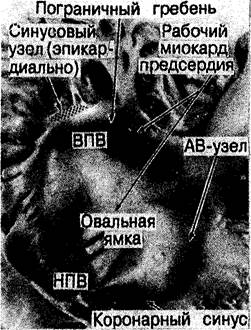
Кардиологи предполагали существование «ultimum moriens» еще до описания его морфологического субстрата, осуществленного Keith и Flack [3]. Wenckebach [3] красочно описывал свое отплытие от берегов Шотландии, когда он посоветовал Keith изучать гистологию ultimum moriens, считая, что это может оказаться плодотворным, особенно в свете открытий Tawara [1], касающихся атриовентрикулярного узла и подтвержденных Keith [2]. Результатом такого гистологического исследования явилось открытие синусового узла, выполняющего роль водителя ритма сердца, что было доказано путем изящного сопоставления анатомических и электрофизиологических данных, проведенного Lewis и соавт. [11]. Keith и Flack в своей первой публикации описали латеральное расположение узла в пограничной борозде. Эти данные были подтверждены Koch [5], также описавшим вариации протяженности «хвоста» синусового узла вдоль пограничной борозды в направлении устья нижней полой вены (рис. 2.1). Латеральное положение узла было в дальнейшем подтверждено большинством исследователей [12—14]. Исключением был Hadson [15], считавший, что синусовый узел располагается подковообразно по отношению к месту соединения верхней полой вены и гребня ушка правого предсердия. Наши данные [16] в значительной степени подтверждают мнение тех, кто наблюдал латеральное расположение синусового узла (рис. 2.2), хотя в отдельных случаях мы отметили подковообразное строение этой структуры (рис. 2.3).
Рис. 2.1. Локализация синоатриального узла и взаиморасположение атриовентрикулярного узла и треугольника Коха (рисунок из работы W. Koch „Weitere Mitteilungen uber den Sinusknoten des Herzens", опубликованной в „Verk. Dtsch. Pathol. Ges." 1909, 13,85).
Рис. 2.2. Латеральное расположение синусового узла (схематическое изображение сердца при хирургическом доступе).
Рис. 2.3. Более редкое расположение синусового узла.
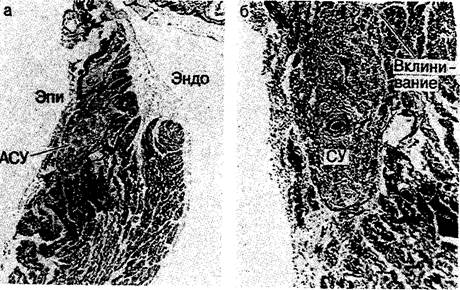
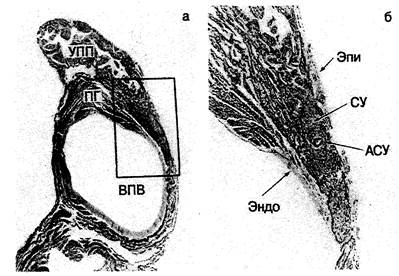
Рис. 2.4. Микрофотографии, показывающие взаиморасположение синусового узла (СУ), стенки верхней полой вены (ВПВ), пограничного гребня (ПГ), а также эпикардиальной (Эпи) и эндокардиальной (Эндо) поверхностей соединения ВПВ с правым предсердием. а — при малом увеличении: узел (между стрелками) на срезе в плоскости, перпендикулярной его продольной оси и пограничной борозде; его ткань окружает четко определяющуюся артерию синусового узла (АСУ); б — при большом увеличении: вклинивание переходных клеток в мускулатуру предсердия.
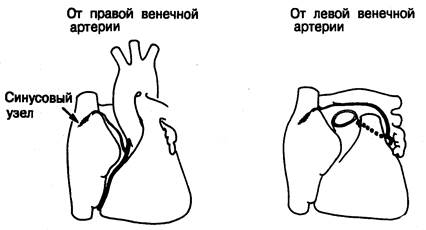
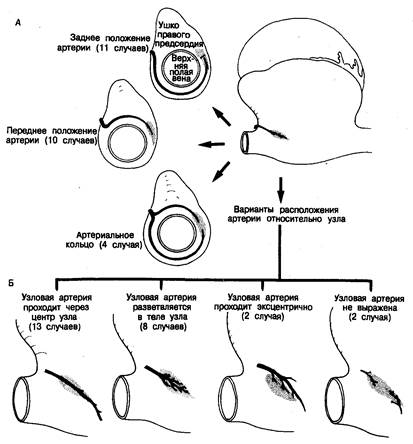
Как показал Truex [12], точные очертания узла варьируют в зависимости от плоскости среза. На срезах, сделанных перпендикулярно к пограничной борозде, видно, что непосредственно под эпикардом узел вклинивается в место стыка стенки верхней полой вены и пограничного гребня (рис. 2.4). Основание клина синусовой ткани обычно направлено вперед, к гребню ушка предсердия, а его острие — назад, к нижней полой вене (см. рис. 2.2). Серийные срезы, полученные нами, обнаруживали различную протяженность узловой ткани. В сердце младенцев хвост узла обычно длиннее, чем у взрослых. Изредка встречается вклинивание синусового узла в гребень ушка предсердия в направлении межпредсердного мышечного пучка (рис. 2.5). Синусовый узел обычно связан с собственной хорошо выраженной артерией, которая подходит к нему по стенке предсердия; в 55 % случаев она отходит от правой венечной артерии, а в остальных случаях—от левой венечной артерии [14]. James [14], описавший это (в сердце человека), отмечает, что артерия может затем огибать устье верхней полой вены по часовой стрелке (или против). Наши серийные данные подтверждают и развивают это наблюдение. В некоторых случаях артерии входят в узел с обеих сторон, образуя артериальное кольцо вокруг места впадения верхней полой вены (см. рис. 2.8, а). Мы также отметили большую вариабельность отхождения узловой артерии [17], что ранее наблюдалось McAlpine [18]. Хотя узловая артерия отходит от правой или левой венечной артерии и обычно располагается очень близко к ее началу (рис. 2.6), она может также отходить латерально от правой коронарной артерии (рис. 2.7, а) или дистально — от огибающей артерии (рис. 2.7, б). Эти данные имеют большое значение для хирургов, так как они показывают, что точное расположение синусового узла и его артерии невозможно предсказать безошибочно. Вся область соединения верхней полой вены с правым предсердием должна рассматриваться как зона риска. Необходимо также выявить и тщательно исследовать аномальные «маршруты», проходящие через стенки предсердий. В дополнение к вариабельности хода узловой артерии может различаться и ее расположение по отношению к ткани синусового узла. Только в небольшом проценте случаев узловая артерия полностью проходит через тело узла. В других случаях она может разветвляться внутри узла, проходить через узел эксцентрично или быть неразличимой (рис. 2.8, Б). Эти данные плохо согласуются с представлением о механизме обратной связи в работе синусового узла и его артерии [19].
Рис. 2.5. Микрофотографии, показывающие расположение синусового узла (СУ) по отношению к месту впадения верхней полой вены (ВПВ) и ушку правого предсердия (УПП). а — при малом увеличении; прямоугольником выделен участок, представленный на рис. 2-5, б при большом увеличении; б — узел располагается между пограничным гребнем (ПГ) и мышечным слоем ВПВ. Эпи — эпикард; Эндо — эндокард; АСУ — артерия синусового узла.
Рис. 2.6. Место отхождения артерии синусового узла от проксимальной части правой или левой венечной артерии.
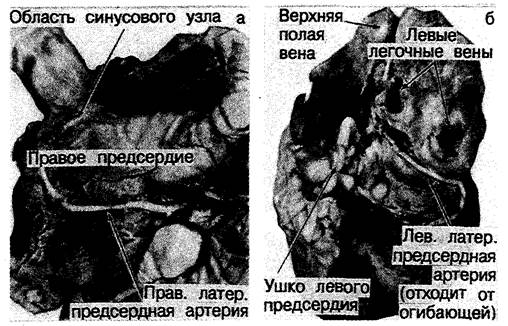
Рис. 2.7. На фотографии двух анатомированных сердец показана артерия синусового узла, отходящая от правой латеральной артерии (а) и левой латеральной артерии (б).
Рис. 2.8. Варианты взаиморасположения синусового узла и его артерии, выявленные при помощи метода серийных срезов (А и Б).
Эмбриогенез
Существуют различные точки зрения на развитие синусового узла. Некоторые исследователи отстаивают раннее развитие синусового узла [20, 21], другие же считают, что он становится морфологически различимым относительно поздно [22, 23]. По мнению одних, синусовый узел является производным правосторонней части особой парной структуры,.связанной с обоими рогами венозного синуса [24, 25], по мнению других, он представляет собой одностороннюю структуру, связанную с правым рогом венозного синуса [26]. Наши собственные исследования показали, что на самых ранних стадиях эмбрионального развития в области впадения верхней полой вены в предсердие можно выделить гистологически отличный участок (рис. 2.9). Локализация этого участка примерно соответствует положению зрелого синусового узла, который у эмбриона имеет более протяженную границу. Он не занимает всю область синоатриального соединения (рис. 2.10). Мы определили такую гистологически отличимую структуру только вблизи устья верхней полой вены. В области левого рога венозного синуса такой ткани нет. На ранних этапах развития синусовый узел имеет наибольшие относительные размеры. По мере роста сердца область, занимаемая синусовым узлом, уменьшается относительно объема остальной ткани предсердия. С самых ранних стадий развития клетки узла погружены в соединительную ткань. Объем соединительной ткани внутри узла поначалу невелик, но к концу внутриутробного развития [27] он явно возрастает.
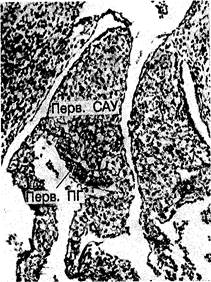
Рис. 2.9. Микрофотография, показывающая участок впадения верхней полой вены в правое предсердие у человеческого плода длиной 15 мм. Различия между клетками, формирующими синоатриальный узел (Пере. САУ), и клетками, формирующими пограничный гребень (Пере. ПГ), уже очевидны.
Рис. 2.10. Расположение первичного синусового узла, показанного на рис. 2.9. Зачаток узла определяется только в области впадения верхней полой вены (ВПВ) в правое предсердие. НПВ — нижняя полая вена; КС — коронарный синус.
Гистология
Клетки, составляющие синусовый узел, гистологически отличимы от клеток рабочего миокарда предсердий и могут распознаваться даже при небольшом увеличении (см. рис. 2.5 и 2.6). Хорошими ориентирами при идентификации синусового узла являются также выраженная узловая артерия, определяемая в большинстве случаев, и соединительнотканный матрикс. Клетки синусового узла мельче клеток рабочего миокарда предсердия. Они группируются в переплетенные пучки, причем вся сеть клеток погружена в развитый фиброзный матрикс (см. рис. 2.5, б). На границе синусового узла, обращенной к миокарду устья верхней полой вены и пограничного гребня, определяется переходная зона между клетками узла и рабочего миокарда предсердий. На некоторых участках переход от тканей синусового узла к миокарду предсердия выражен достаточно четко (см. рис. 2.5, б). На других участках тяжи клеток узла вдаются на некоторое расстояние в миокард предсердия, соединяясь с последним узкими переходными зонами. В этих вклинивающихся зонах перекрывание клеток синусового узла и предсердия может интерпретироваться как присутствие клеток предсердия в пределах узла [14]. Вклинивающиеся участки наиболее часто встречаются на границе синусового узла и пограничного гребня, но их точное количественное распределение еще только предстоит установить. Мы работали в основном с тканями эмбрионов и младенцев, и нам редко приходилось наблюдать «большие бледные» клетки предсердия, иногда именуемые «клетками Пуркинье» [14]. Функция и само наличие этих клеток в предсердии весьма спорны, и использование термина «клетки «Пуркинье» для их описания лишь усложняет проблему. По мнению Truex [12], «рекомендуется ограничить употребление термина «клетки Пуркинье», который следует использовать только по отношению к специфическим клеткам желудочков, впервые описанным Пуркинье. Некорректное применение этого термина в отношении больших клеток предсердия не только неправомерно с точки зрения семантики, но и приписывает им функцию водителя ритма, пока никем не установленную».
Истинный клеточный состав синусового узла может быть установлен с помощью ультраструктурных методов в хорошо зафиксированном материале под контролем светового микроскопа. Последнее особенно важно, так как позволяет исследователю удостовериться в том, что он работает действительно с тканью синусового узла. Данные критерии соблюдаются сегодня только в отношении тканей животных. Тщательное исследование, проведенное Tranum-Jensen [28], показало, что синусовый узел кролика состоит в основном из так называемых типичных клеток узла. Эти клетки располагаются хаотично, имеют веретенообразную форму, а иногда разветвления с тонкими, заостренными концами. Они характеризуются слабым развитием сократительного аппарата и случайным распределением митохондрий. Саркоплазматический ретикулум развит хуже, чем в миокарде предсердий, а система Т-тубул отсутствует. Однако Т-ту булы, как указывает Tranum-Jensen, не всегда встречаются и в рабочих кардиомиоцитах предсердия; следовательно, «специализированные клетки» предсердий не могут быть выделены на основе наличия или отсутствия Т-тубул. По краям синусового узла кролика Tranum-Jensen наблюдал переходные клетки, отличающиеся от типичных клеток узла большим количеством хорошо организованных миофибрилл наряду с более высоким содержанием межклеточных соединений типа нексусов. Что касается бледных клеток, или «вставочных светлых клеток» («intercalated clear cells»), описанных в синусовом узле человека [29], Tranum-Jensen, исходя из собственного опыта, счел их наличие артефактом,
Иннервация
Общеизвестно, что синусовый узел у животных можно отличить от рабочего миокарда по его богатой адренергической и холинергической иннервации [см. обзор Yamauchi (1973)]. Известно также, что существуют значительные видовые различия в характере иннервации синусового узла; следовательно, результаты, полученные в эксперименте на животных, не могут быть непосредственно перенесены на человека. Наши исследования на сердце эмбриона человека выявили раннее формирование богатой нервной сети, содержащей холинэстеразу; отмечено также высокое по сравнению с миокардом предсердий содержание холинэстеразы в клетках синусового узла (рис. 2.11).
В настоящее время для полноты картины недостает данных об адренергической иннервации и ее развитии в сердце человека. В эксперименте на животных установлено, что развитие адренергического компонента иннервации сильно запаздывает относительно холинергического компонента [31].
Межузловое проведение
Полемика по вопросу об анатомическом субстрате для проведения импульсов между синусовым и атриовентрикулярным узлами ведется уже столько лет, сколько насчитывает и сама история изучения проводящей системы. Некоторые исследователи [8] полагают, что Wenkebach [10] описал межузловой тракт. Действительно, он наблюдал тяж миокардиальных фибрилл, соединяющий мышечные слои верхней полой вены и ушка правого предсердия, но это было еще до открытия синусового узла. В то время Wenckebach считал, что этот тяж фибрилл должен проводить импульс от «ultimum moriens» к миокарду предсердия и что его разрушение должно приводить к синоатриальной блокаде. По словам Lewis [32], когда Keith и Flack [3] точно описали морфологию синусового узла, Wenkebach понял, что обнаруженный им тяж не имеет значения для синоатриальной блокады. Впервые мысль о гистологически различимых путях проведения между узлами высказал Thorel [33, 34]. Он утверждал, что нашел тракт, состоящий из «клеток Пуркинье», проходящий вдоль пограничного гребня и связывающий синусовый и атриовентрикулярный узлы. Интерес к этому сообщению был настолько велик, что оно обстоятельно обсуждалось на сессии Немецкого общества патологов в 1910 г. [35]. В заключении, принятом на этом собрании, говорилось, что Thorel не привел однозначного доказательства существования гистологически определяемого проводящего пути. По мнению Aschoff [36], Monckeberg [37] и Koch [38], ткань между узлами является рабочим миокардом предсердия и не содержит гистологически различимых трактов. Во избежание дальнейших разногласий они предложили требовать от исследователей, заявляющих о выявлении предсердных проводящих путей, таких же доказательств гистологической специфичности, какие существуют для атриовентрикулярного проводящего пути. Несмотря на это, Condorelli [39], Franco [40] и некоторые другие авторы описывали предсердные пути проведения, используя, как и Thorel, весьма слабые гистологические критерии; впрочем, их предположения не по лучили всеобщего признания. Действительным побуждением к поиску гистологически специализированных предсердных путей послужило установление того факта, что не все клетки предсердия имеют одинаковые электрофизиологические характеристики [41]. Истолковывая эти данные как безусловное электрофизиологическое доказательство существования специализированных путей, James [8] заявил, что проблема состоит не в констатации наличия проводящих путей, а в определении их точной локализации. На основании исследований методами полусерийных срезов и анатомирования различных предсердных мышечных пучков он описал «специализированные пути» — передний, средний и задний, — соединяющие синусовый и атриовентрикулярный узлы. На наш взгляд, в качестве трех указанных выше специализированных путей James дал описание практически всего миокарда межпредсердной перегородки и пограничного гребня.
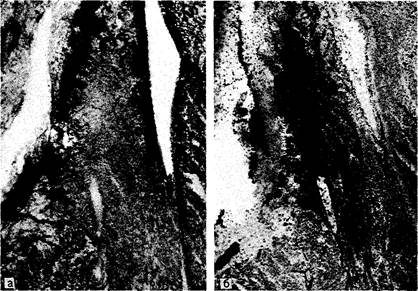
Рис. 2.11. Синусовый узел человеческого плода в середине периода эмбриогенеза на микрофотографиях срезов, сделанных в плоскости, перпендикулярной его продольной оси (сравните с рис. 2.4). а — стандартно окрашенный срез, на котором узел можно отличить от миокарда предсердия по характерному окрашиванию; б — срез, обработанный с целью выявления холинэстеразной активности; специализированные клетки узла являются холинэстеразоположительными и обильно снабжены холинэстеразосодержащими нервными волокнами.
Таким образом, неразрешимый вопрос о морфологии «специализированных межузловых путей» в сущности удивительно прост. Проходят ли в области межпредсердной перегородки и пограничного гребня пути, гистологически отличимые от остального миокарда предсердия, или же собственно миокард на этих участках отличается от остальной части миокарда предсердия? Насколько нам известно, никто до сих пор на основе морфологических наблюдений не доказал, что в межпредсердной перегородке и пограничном гребне проходят узкие тракты, каким-либо образом сравнимые с атриовентрикулярным пучком и его ответвлением. Проблема специализированных путей попросту заключается в выборе критерия специализации. Главным критерием, по James [8], является то, что во всех трех описанных путях, полностью охватывающих межпредсердную перегородку и пограничный гребень, велик процент клеток Пуркинье, выделяющих эти пути из остальной части миокарда предсердия. Мы уже ссылались на комментарии Truex [12], касающиеся природы этих так называемых клеток Пуркинье. Здесь уместно процитировать также его высказывание по поводу внутрипредсердных проводящих путей [12]: «В настоящее время интенсивный поиск анатомических доказательств наличия или отсутствия активно обсуждаемых в литературе внутриузловых трактов в предсердии оказался весьма утомительным и трудоемким делом. Действительно, мы провели исследования бесчисленного количества синоатриальных узлов и клеток миокарда предсердий у млекопитающих, но, увы, не смогли выделить специфические проводящие пути, о существовании которых было широко заявлено... Мы пришли к выводу, что клеточная связь между синоатриальным и атриовентрикулярным узлами обеспечивается в основном пучками, состоящими из обычных клеток миокарда предсердия. Позднее аналогичное заключение было сделано Lev и Bharati [42]. Несколько раньше такое же мнение высказал Chuaqui [43, 44] на основании анализа обширной литературы и данных собственных стереомикроскопических исследований. Таким образом, большинство современных исследователей в отличие от James [45] разделяют ранние взгляды немецких ученых. Наши исследования (в основном на сердце плодов и младенцев) согласуются с точкой зрения большинства ученых. Небольшой размер изучавшихся образцов позволил нам выделить целиком правое предсердие, включая межпредсердную перегородку и пограничный гребень, как единый блок миокардиальной ткани. На полученных срезах синусовый и атриовентрикулярный узлы отчетливо различаются по своим гистологическим характеристикам. Они однозначно свидетельствуют о гистологической специализации (рис. 2.12). Остальная часть предсердия (кроме кольца специализированной ткани вокруг атриовентрикулярного узла; см. ниже) не обнаруживает морфологической или гистохимической специализации. По данным световой микроскопии, межпредсердная перегородка и пограничный гребень состоят исключительно из рабочего миокарда предсердия. В исследованном нами материале редко встречались большие бледные клетки, напоминавшие так называемые клетки Пуркинье. В том случае, когда они присутствовали, их находили и в тканях ушка правого предсердия, и в левом предсердии. Таким образом, мы в значительной степени подтвердждаем мнение Aschoff [36], Monckeberg [37], Koch [38], Chuaqui [43, 44], Truex [12], а также Lev и Bharati [42] о том, что не существует гистологически различимых трактов из специализированной проводящей ткани между синусовым и атриовентрикулярным узлами.
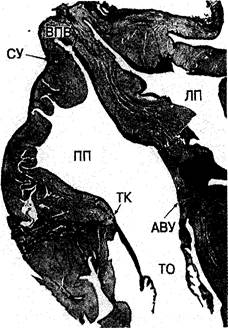
Рис. 2.12. Срез правого предсердия через синусовый узел (СУ) и атриовентрикулярный узел (АВУ). Обе эти структуры легко распознаются даже при малом увеличении. Однако соединяющую узлы мышечную массу нельзя отличить от остального миокарда предсердия при световой микроскопии. Определяется участок ткани кольца (ТК) в месте вхождения миокарда предсердия в трикуспидальное отверстие (ТО). ВПВ — верхняя полая вена; ПП — правое предсердие, ЛП — левое предсердие.
Рис. 2.13. Правое предсердие анатомически представляет собой мешок с множеством отверстий. Несложное геометрическое строение миокарда предсердия в полной мере рассчитано на предпочтительное проведение между узлами, которое определенно существует [46]. ВПВ — верхняя полая вена; НПВ — нижняя полая вена.
Ткань, проводящая импульсы, относится скорее к межузловому миокарду предсердия. Тем не менее следует подчеркнуть, что, хотя нам и не удается гистологически идентифицировать «специализированные межузловые пути», это само по себе вовсе не исключает ни предпочтительного проведения сердечного импульса через определенные участки миокарда предсердий, ни возможности существования в рабочем миокарде клеток со специфическими электрофизиологическими свойствами. Существование предпочтительного проведения точно установлено, но его характер может быть истолкован упрощенно, исходя из геометрии мышечных пучков правого предсердия [46—48] (рис. 2.13). Поведение тех или иных клеток в миокарде предсердия представляет отдельную проблему и может не иметь отношения к проведению внутри предсердия. Значение этих данных выясняется лишь после осуществления экспериментов с маркированием клеток и электронно-микроскопических исследований меченой ткани. Проведенные недавно подобные эксперименты показали, что обычные клетки миокарда предсердия способны генерировать как «рабочий», так и «специализированный» потенциалы действия [49].
Анатомия
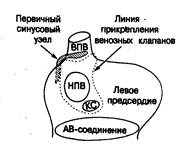
Основные анатомические ориентиры предсердного компонента специализированной области АВ-соединения хорошо описаны Koch [5, 6]. Он показал, что атриовентрикулярный узел нужно искать в направлении переднего края треугольника, образованного продолжением клапана нижней полой вены (евстахиева клапана, или сухожилия Tobaro) [52], основанием перегородочной створки трикуспидального клапана и устьем коронарного синуса (см. рис. 2.14). На вершине этого треугольника сухожилие Todaro соединяется с центральным фиброзным телом. Непосредственно позади данного соединения находится участок проникновения атриовентрикулярного пучка (пучка Гиса) в желудочки. Пройдя в ткань желудочков, ствол пучка ответвляется на гребне мышечной части межжелудочковой перегородки непосредственно под межжелудочковым компонентом мембранозной части. Специализированная проводящая ткань левого желудочка проходит непосредственно субэндокардиально по септальной поверхности выходящего тракта левого желудочка под некоронарной створкой аортального клапана. Правая ножка АВ-пучка отходит от общего ствола пучка интрамиокардиально. В нормально сформированном сердце хорошим ориентиром при определении ее позиции служит медиальная сосочковая мышца. Анатомические ориентиры проводящих тканей имеют огромное значение в кардиохирургии. У большинства людей треугольник Коха становится хорошо различимым при натягивании клапана нижней полой вены. Во всяком случае в фиксированном сердце обычно можно увидеть проксимальную часть левой ножки АВ-пучка, спускающуюся по левожелудочковой поверхности межжелудочковой перегородки.
Развитие
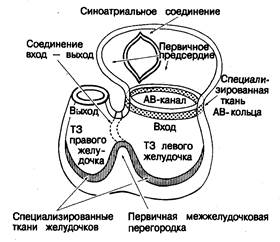
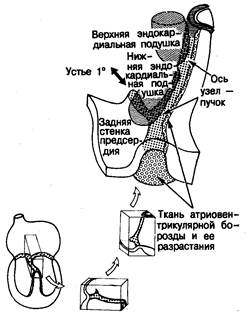
Знание эмбриогенеза области атриовентрикулярного соединения в значительной мере облегчает понимание ее анатомической структуры и клеточной архитектоники. Наше представление о развитии АВ-соединения базируется на изучении сердца плода [53] и случаев полной врожденной поперечной блокады сердца [54]. На самой ранней стадии развития миокард предсердий непрерывно переходит в миокард желудочков по всей окружности первичного атриовентрикулярного канала, причем миокард атриовентрикулярного кольца обладает гистологической специфичностью (рис. 2.15). Это кольцо особенно хорошо видно в отверстии формирующегося трикуспидального клапана. Внутри желудочков выделяется субэндокардиальный слой.трабекулярных зон, отличный от компактного слоя миобластов. Зачаток (примордиум) ответвляющейся части АВ-пучка находится на гребне мышечной части первичной межжелудочковой перегородки и соединяется с субэндокардиальной сетью в обоих желудочках (см. рис. 2.15). Проксимальная часть АВ-пучка Гиса в этот период развития имеет большую протяженность и связана с частью межжелудочковой перегородки, формирующейся между входными отделами желудочков. В самой задней своей части проксимальный сегмент АВ-пучка разветвляется и смыкается с каждой стороны со специализированной тканью первичного атриовентрикулярного кольца (рис. 2.16). Таким образом, развитие неветвящейся и ветвящейся частей АВ-пучка связано с различными зонами первичной сердечной трубки: ветвящаяся часть развивается в области соединения входного и выходного отделов желудочков, а неветвящаяся — на входной части межжелудочковой перегородки [54]. Однако в нормальном сердце проводящий ствол формируется как непрерывное образование, так что разветвления желудочкового проводящего пучка соединяются через входную часть межжелудочковой перегородки с задней областью атриовентрикулярного соединения (см. рис. 2.16). Таково расположение частей проводящей системы перед началом формирования зрелой (дефинитивной) межпредсердной перегородки. Таким образом, на этом этапе зачаток по своему строению непохож на зрелое сердце — он скорее напоминает сердце с дефектами атриовентрикулярной части межжелудочковой перегородки [55— 57]. На ранней стадии развития эндокардиальные подушки (помогающие разграничить область атриовентрикулярного соединения) находятся на эндокардиальной стороне формирующегося ствола проводящей ткани. Соединительная ткань, выполняющая предсердно-желудочковую (венечную) борозду, находится на эпикардиальной его стороне и, разрастаясь, окружает развивающийся проводящий пучок (рис. 2.17). Таким образом, из тканей венечной борозды, эндокардиальных подушек и проводящей ткани формируется «сэндвич», который сохраняется и в зрелом сердце. На этой стадии существует очень длинная неветвящаяся часть АВ-пучка, проходящая вдоль входного отдела межжелудочковой перегородки, которая контактирует только с миокардом задней стенки предсердий. В начале формирования дефинитивной межпредсердной перегородки миокард предсердий в значительной степени изолирован тканью эндокардиальных подушек от ствола проводящей системы, идущего по входной части межжелудочковой перегородки (рис. 2.18, А). По мере развития и роста плода происходит постепенная инволюция эндокардиальных подушек.
Рис. 2.15. Предполагаемое распределение тканей в пределах первичной сердечной трубки непосредственно после процессов петлеобразования и формирования желудочковых трабекулярных зон (ТЗ).
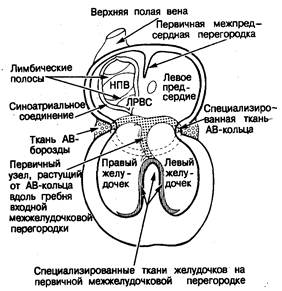
Рис. 2.16. В результате развития входной части межжелудочковой перегородки специализированная ткань атриовентрикулярного кольца соединяется со специализированными тканями, сформировавшимися из первичного компонента мышечной межжелудочковой перегородки. ЛРВС — левый рог венозного синуса; HUB — нижняя полая вена.
Это позволяет нижнему краю межпредсердной перегородки войти в контакт с проводящим пучком, располагающимся на гребне входной части межжелудочковой перегородки; при этом проксимальная часть исходно длинного неветвящегося сегмента АВ-пучка превращается в зрелый, компактный атриовентрикулярный узел (рис. 2.18, Б). Вновь сформированный узел по-прежнему находится непосредственно под эпикардом и отделен от миокарда перегородки входного отдела желудочков выростами жировой ткани атриовентрикулярной борозды (рис. 2.18, В). Компактная зона зрелого АВ-узла и проникающая часть АВ-пучка имеют общий источник развития, который может быть назван «осью узел — пучок» (nodal-bundle axis) (см. рис. 2.17). Положение границы между АВ-узлом и проникающей частью пучка Гиса зависит от степени инволюции эндокардиальных подушек. Это зона, где изолирующая ткань центрального фиброзного тела (происходящего частично из подушек) отделяет миокард предсердий от оси узел — пучок. Поскольку при формировании АВ-узла межпредсердная перегородка растет вниз к стволу проводящей ткани, зрелый узел становится межпредсердной структурой [58]. Короче говоря, компактная зона зрелого АВ-узла и одноименный пучок развиваются из одного и того же источника. Промежуточная зона между этими структурами и миокардом предсердий имеет иное происхождение. Собственно АВ-узел в зрелом сердце сохраняет свое эмбриональное субэпикардиальное положение.
Рис. 2.17. Пучок проводящей ткани, развившейся из входной части перегородки (ось узел — пучок), становится средним слоем сэндвича, образованного эндокардиальными подушками (изнутри сердечной трубки) и тканью атриовентрикулярной борозды (снаружи сердечной трубки). Фрагменты (внизу) иллюстрируют последовательность перехода от ориентации на рис. 2.15 и 2.16 к положению, показанному на рис. 2.14.
Иннервация
Как и в случае синусового узла, в характере иннервации АВ-соединения существуют значительные межвидовые различия, причем даже гораздо более выраженные. АВ-соединение у кролика получает обильную иннервацию как адренергического, так и холинергического типа [68]. У морской свинки эта область богато иннервирована холинэстеразосодержащими нервными волокнами, но адренергическая иннервация у нее отсутствует, что может быть продемонстрировано с помощью флюоресцентных методов [68]. У человека же, несмотря на то что переходная клеточная зона АВ-соединения к середине внутриутробного развития имеет холинэстеразоположительную иннервацию, проводящие ткани желудочков (хотя они и являются холинэстеразоположительными), полностью лишены холинергической иннервации [53]. Существующие морфологические данные не позволяют предполагать, что специализированная область АВ-соединения у человека имеет холинергическую или адренергическую иннервацию. Для разрешения этой проблемы необходимы дальнейшие морфологические и ультраструктурные исследования. До их осуществления результаты, полученные в эксперименте на животных, должны экстраполироваться на человека лишь с очень большой осторожностью. Эти ограничения в равной мере относятся и к характеру иннервации специализированных тканей желудочков, который также обнаруживает существенные межвидовые различия [53, 66, 68].
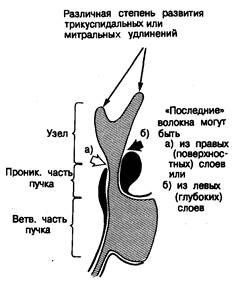
Внутриузловые обходные пути
Волокна, описанные James [7], лучше рассматривать как внутриузловые обходные пути. Их присутствие ограничивается предсердной частью специализированной области АВ-соединения. Поскольку эти пути, как указывает James, должны обнаруживаться в нормальном сердце, с позиций анатомии трудно причислить их к источнику предвозбуждения. Видимо, возможны только косвенные аргументы, как, например, отсутствие у пациентов с вариантом предвозбуждения, характеризующимся укороченным Р—Q и нормальным QRS, добавочных предсердно-пучковых связей. Существует множество потенциальных вариантов обходных путей в пределах предсердной части специализированной области АВ-соединения (рис. 2.41). В нормальном сердце наблюдается значительная вариация архитектоники «последнего» предсердного волокна, способного контактировать с узлопучковой осью, прежде чем стать проникающим пучком [50]. В большинстве случаев такие волокна относятся к поверхностным переходным предсердным волокнам. В некоторых случаях они берут свое начало в глубоких слоях левой стороны межпредсердной перегородки. Другие варианты отмечаются при рассмотрении морфологии компактной зоны АВ-узла и ее заднего удлинения. В некоторых случаях основная ось направлена к митральному клапану и левой стороне перегородки, в других же — доминирует протяженность узла в направлении трикуспидального клапана. Существующая в норме слоистая структура самого узла создает предпосылки для различных вариантов обходных путей. Возможная роль этих морфологических вариаций как субстрата предвозбуждения с нормальным Р— R — коротким QRS может быть выяснена только в результате всестороннего исследования нормальных сердец и сравнения их с сердцами больных с предварительно установленной данной формой предвозбуждения.
Рис. 2.41. Некоторые варианты обходных путей, обусловленные вариабельностью нормального строения специализированной области атриовентрикулярного соединения.
Врожденная блокада сердца
Lev [155] выделяет два основных варианта полной врожденной блокады сердца;.один из них наблюдается при врожденных аномалиях развития, второй —в нормальном сердце. Врожденная блокада сердца, обусловленная аномалиями развития, чаще всего встречается при врожденных изменениях транспозиции и атриовентрикулярных дефектах перегородки, для которых характерно разделение правого и левого отверстий («ostium primum ASD). Хотя полная блокада может отмечаться уже при рождении, значительно чаще наблюдается прогрессирующая аритмия, начинающаяся с блокады первой степени и приводящая к полной блокаде. Наши гистологические исследования [140] показывают, что такое прогрессирование может быть связано с усиливающимся фиброзом (склерозом) атриовентрикулярного пучка, который расположен в очень подвижной (по сравнению с нормой) части сердца. Высокая степень фиброза проводящих тканей желудочков может также связываться с их определенной подверженностью даже самым легким травмам, ведь известно, что блокада нередко возникает при введении наркоза или в начале торакотомии [156].
Рис. 2.51. Гистологические варианты полной блокады сердца.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 732; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.69.255 (0.088 с.) |