
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение газового состоянияСодержание книги
Поиск на нашем сайте
Состояние газа определяется зависимостью между давлением p, объемом V и температурой T. Аналитическая зависимость между этими двумя параметрами имеет наиболее простой вид для идеального газа. Это уравнение Клайперона. Для одного кмоля имеем
где Поскольку объем Для единицы массы газа уравнение Клайперона имеет вид:
где v – удельный объем, величина обратная плотности или
Здесь газовая постоянная R в отличии от Из (4) и (5) следует
Физический смысл R аналогичен
При давлениях и температурах обычных для транспорта газа законы (4) и (5) идеального газа должны применяться с поправкой на влияние Ван-дер-ваальсовых сил (природный газ сжимается больше, чем это следует для идеального газа). Реальное поведение газа позволяет учесть так называемый коэффициент сжимаемости Z, который входит в скорректированное уравнение Клайперона
Коэффициент Z зависит от давления, температуры и состава газа. Определить Z можно по эмпирическим формулам, например
или по специальным номограммам в зависимости от так называемых приведенных температуры и давления
где Ткр - критическая температура, при которой и выше которой при повышении давления нельзя сконденсировать пар; ркр – критическое давление, при котором и выше которого повышением температуры нельзя испарить сжиженный газ.
Эти параметры также являются физическими характеристиками газа, зависящими от его состава. Для смеси газов Ткр и ркр определяются по правилу аддитивности
1.29. Необходимость подготовки газа к магистральному транспорту
Природный газ, получаемый с промыслов, содержит посторонние примеси: твердые частицы (песок и окалину), конденсат тяжелых углеводородов,
водяные пары и часто сероводород, углекислый газ и инертные газы. Присутствие твердых частиц в газе приводит к быстрому износу соприкасающихся с газом деталей компрессоров. Твердые частицы засоряют и портят арматуру газопровода и контрольно-измерительные приборы; скапливаясь на отдельных участках газопровода, они сужают его поперечное сечение. Жидкие частицы, оседая в пониженных участках трубопровода, также вызывают уменьшение площади его поперечного сечения. Они, кроме того, оказывают корродирующее действие на трубопровод, арматуру и приборы. Влага в определенных условиях приводит к образованию гидратов, выпадающих в газопроводе в виде твердых кристаллов. Гидратные пробки могут полностью закупорить трубопровод. Сероводород — весьма вредная примесь. В количествах, больших 0,01 мг на 1л воздуха рабочей зоны, он ядовит. При промышленном использовании газа содержащийся в нем сероводород отрицательно сказывается на качестве выпускаемой продукции. В присутствии влаги сероводород вызывает сильную коррозию металлов. Углекислый газ вреден главным образом тем, что он снижает теплоту сгорания газа. Перед поступлением в магистральный газопровод газ должен быть осушен и очищен от вредных примесей. Кроме того, газ подвергают одоризации, т.е. вводят в него компоненты, придающие ему резкий и неприятный запах. Одоризация позволяет более быстро обнаружить утечки газа. Подготовка газа к транспорту проводится на специальных установках, находящихся на головных сооружениях газопровода. Газ после подготовки к транспортировке должен соответствовать требованиям отраслевого стандарта на природный газ, транспортируемый по магистральным газопроводам, с учетом климатических условий.
|
|||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 545; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.92.2 (0.006 с.) |

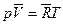 (4)
(4) - объем одного кмоля;
- объем одного кмоля;  - газовая постоянная.
- газовая постоянная. (5)
(5)


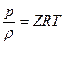
 , где T – в 0С; р – в кгс/см2
, где T – в 0С; р – в кгс/см2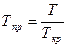 и
и 
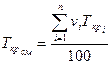 ;
; 



