
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физико-химические свойства белков. Растворимость белков в воде.
Большинство белков гидрофильны. Однако белковые молекулы имеют очень большие размеры, поэтому белки не могут образовывать истинных растворов, а только коллоидные. Внешнее проявление этого - это эффект Тиндаля (или конус Тиндаля). Эффект Тиндаля вызывается рассеянием тонкого пучка света при прохождении через белковый раствор. Несмотря на большую величину, многие белковые молекулы не осаждаются в водных растворах. Осаждению белковых молекул препятствуют факторы стабилизации белкового раствора. ФАКТОРЫ СТАБИЛИЗАЦИИ БЕЛКА В РАСТВОРЕ. 1) ГИДРАТНАЯ ОБОЛОЧКА - это слой молекул воды, определенным образом ориентированных на поверхности белковой молекулы. Поверхность большинства белковых молекул заряжена отрицательно, и диполи молекул воды притягиваются к ней своими положительно заряженными полюсами (смотрите рисунок).
Свойства воды гидратной оболочки а) Температура кипения выше 1000С. б) Температура замерзания ниже 0ОС. в) В воде гидратной оболочки не растворяются различные соли и другие гидрофильные вещества. г) Окружая каждую молекулу белка, гидратная оболочка не дает этим белковым молекулам сблизиться, соединиться и выпасть в осадок. 2) ЗАРЯД БЕЛКОВОЙ МОЛЕКУЛЫ. Поверхность большинства белковых молекул заряжена потому, что в каждой молекуле белка есть свободные заряженные СОО- и NH3+ группы. Изоэлектрическая точка (ИЭТ) большинства белков организма находится в слабокислой среде. Это означает, что у таких белков количество кислотных (СООН) групп больше количества основных групп (NH3). рН плазмы крови около 7,36 - это выше ИЭТ большинства белков, поэтому в плазме крови белки имеют отрицательный заряд.
СПОСОБЫ ОСАЖДЕНИЯ БЕЛКОВ Делятся на две группы: 1) Способы осаждения нативного белка 2) Способы осаждения денатурированного белка
Чтобы осадить белок из раствора, надо лишить его обоих факторов стабилизации: и заряда, и гидратной оболочки.
ОСАЖДЕНИЕ НАТИВНЫХ БЕЛКОВ Чтобы сохранить нативность белковой молекулы, ее заряд можно устранить только одним способом: приблизить рН среды к изоэлектрической точке белка (ИЭТ), а для большинства белков нашего организма ИЭТ находится в слабокислой среде. Другой фактор стабилизации - гидратную оболочку можно устранить разными способами. Наиболее типичным примером осаждения нативного белка является ВЫСАЛИВАНИЕ.
а) ВЫСАЛИВАНИЕ - это осаждение белков высокими концентрациями нейтральных солей щелочных и щелочноземельных металлов, поскольку такие соли очень гидрофильны и обладают в высоких концентрациях водоотнимающими свойствами. Чаще это NaCl, Na2SO4, (NH4)2SO4, CaCl2. По мере добавления таких солей к раствору белка они сначала растворяюся в свободной воде, а затем, при дальнейшем повышении концентрации соли, конкурируют с белком за обладание водой, которая входит в состав гидратных оболочек. Белки менее гидрофильные, которые плохо удерживают воду гидратной оболочки, теряют ее раньше. Более гидрофильные белки требуют большей концентрации соли для высаливания. Поэтому с помощью высаливания можно разделить белки с разной степенью гидрофильности. Таким способом, например, можно разделить альбумины и глобулины плазмы крови. При высаливании сохраняется нативность белковых молекул. Если осадить белки с помощью высаливания, а затем уменьшить концентрацию солей, например, методом диализа, то белок опять растворится. Осаждения белков без потери ими нативности можно достичь также с помощью водоотнимающих средств.
б) ПРИМЕНЕНИЕ ВОДООТНИМАЮЩИХ СРЕДСТВ. Такими средствами являются растворители, которые смешиваются с водой в любых соотношениях. Чаще всего это ацетон, этиловый спирт. Эти вещества отнимают гидратные оболочки белков, и белки выпадают в осадок, если они лишены заряда. Но, в отличие от высаливания, осадок сразу (немедленно!) должен быть отделен от растворителя. Если растворитель и белок будут длительно находиться в контакте, то могут произойти необратимые изменения структуры белковой молекулы (денатурация).
|
||||
|
Последнее изменение этой страницы: 2016-12-28; просмотров: 370; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.134.165 (0.005 с.) |
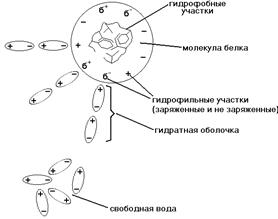 Чем больше гидрофильных свойств у белковой молекулы, чем больше в ее составе и на ее поверхности аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка и тем больше в ней слоев. Вода гидратной оболочки обладает особыми свойствами: она не является свободной, а связана с белковой молекулой. Это - “связанная” вода. Она принадлежит белку, и поэтому имеет особые свойства.
Чем больше гидрофильных свойств у белковой молекулы, чем больше в ее составе и на ее поверхности аминокислот с полярными (гидрофильными) радикалами, тем сильнее выражена и прочнее удерживается гидратная оболочка и тем больше в ней слоев. Вода гидратной оболочки обладает особыми свойствами: она не является свободной, а связана с белковой молекулой. Это - “связанная” вода. Она принадлежит белку, и поэтому имеет особые свойства.


