
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон сохранения массы веществ: «Масса всех веществ, которые вступают в химическую реакцию, равна массе всех продуктов реакции».2. Молярная масса вещества M выражается в г/моль. Она численно равна относительной молекулярной массе этого вещества 3. Количество вещества где n – количество вещества, моль; m – масса вещества, г; M – молярная масса, г/моль или где V – объем вещества, V 4. Масса исходного вещества Объем исходного вещества 5. Молярный объем любого газа при нормальных условиях (н.у.) равен 22,4 л/моль.
Алгоритм решения задач Прочитайте текст задачи. 2. Запишите условие и требование задачи с помощью общепринятых обозначений. Составьте уравнение реакции. Подчеркните формулы веществ, о которых идет речь в условии задачи. 5. Надпишите над подчеркнутыми формулами исходные данные. Рассчитайте молярные массы веществ, о которых идет речь в условии задачи. Рассчитайте количество данного по условию задачи вещества. Определите соотношение веществ в данной реакции (по коэффициентам). Составьте пропорцию, рассчитайте количество определяемого вещества. Используя формулу (3), вычислите массу исходного вещества. Используя формулу (4), вычислите объем исходного вещества. Запишите ответ. Примеры решения задач Задача №1. Какая масса воды образуется при сгорании 1 г глюкозы
Решение. Составим уравнение данной реакции:
Запишем информацию, которую дает это уравнение:
1 моль 6 моль 180 г 6 х 18 = 108 г Следовательно: при сгорании 180 г при сгорании 1 г Отсюда: Ответ: при сгорании 1 г глюкозы образуется 0,6 г воды.
Задача №2. Какая масса магния Mg вступает в реакцию с серной кислотой Решение. Запишем уравнение реакции и ту информацию, которую оно дает:
1 моль 1 моль 24 г 22,4 л 22,4 л 5,6 л Отсюда:
Ответ: 5,6 л
Если в условии задачи даются массы или объемы двух исходных веществ, то начинать решение этой задачи следует с выяснения того, какое исходное вещество дано в избытке, а какое – в недостатке.
Задача №3. Смешано 7,3 г Уравнение реакции: Решение. Определяем, какое вещество находилось в избытке, какое в недостатке. Для этого рассчитаем данное число молей
Уравнение реакции показывает, что 1 моль 1 моль 0,2 моль
Рассчитаем молярную массу
Рассчитаем, сколько граммов
Ответ: образуется 10.7 г
Задания для самостоятельной работы Решите представленные задачи, используя алгоритм решения.
1. Составьте уравнение реакции горения магния и вычислите массу оксида магния 2. В реакцию с водой вступило 28 г оксида кальция 3. Рассчитайте, какая масса кислорода образуется при разложении 54 г воды. 4. Рассчитайте массу оксида меди 5. В реакцию с азотной кислотой 6. Рассчитайте объем водорода (н.у.), образующегося при разложении 54 г воды. 7. Какой объем водорода (н.у) потребуется для полного восстановления меди из оксида меди 8. Составьте уравнение реакции горения фосфора (при этом получается оксид фосфора (V) Контрольные вопросы: 1. Как формулируется закон сохранения массы веществ? 2. Чем объясняется сохранение массы веществ в химических реакциях? 3. Что такое химическое уравнение? 4. Как называются числа перед формулами веществ в химических уравнениях? 5. Что показывают коэффициенты перед формулами веществ в уравнениях химических реакций? Рекомендуемая литература: 1.1 – 1.5, 2.1 -2.9
Практическое занятие № 2
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 420; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.019 с.) |
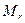 (для молекул)
(для молекул) 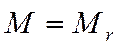 , (для атомов)
, (для атомов) 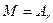 .
.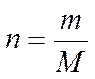 , (1)
, (1)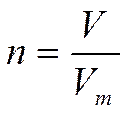 , (2)
, (2) - молярный объем, л/моль.
- молярный объем, л/моль.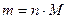 . (3)
. (3) . (4)
. (4) , если реакция протекает по схеме:
, если реакция протекает по схеме:
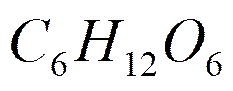 +
+ 
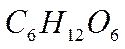 + 6
+ 6 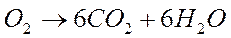
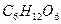 + 6
+ 6 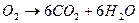
 ;
;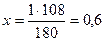
 , если в результате реакции выделяется 5,6 л водорода
, если в результате реакции выделяется 5,6 л водорода  при н.у.?
при н.у.?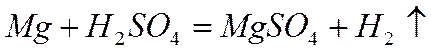
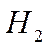 выделяется, если в реакцию вступают 24 г
выделяется, если в реакцию вступают 24 г 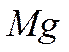 ;
; выделяется, если в реакцию вступают х г
выделяется, если в реакцию вступают х г 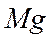 .
.
 выделяется, если в реакцию вступают 6 г
выделяется, если в реакцию вступают 6 г  .
.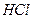 с 4,0 г
с 4,0 г  . сколько г
. сколько г 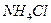 образуется?
образуется?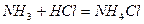
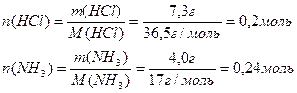
 значит 0,2 моль
значит 0,2 моль 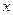 моль
моль 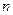 (
(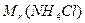 =
= 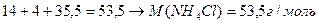 .
.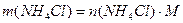 (
(
 , который получится при сгорании 6 г металла.
, который получится при сгорании 6 г металла.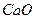 . Рассчитайте массу образовавшегося вещества.
. Рассчитайте массу образовавшегося вещества. , образующегося при разложении 49 г гидроксида меди
, образующегося при разложении 49 г гидроксида меди 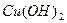 .
. вступило 20 г гидроксида натрия
вступило 20 г гидроксида натрия 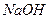 . Рассчитайте массу образовавшейся соли.
. Рассчитайте массу образовавшейся соли.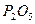 ) и вычислите, хватит ли 10 г кислорода на сжигание 6,2 г фосфора.
) и вычислите, хватит ли 10 г кислорода на сжигание 6,2 г фосфора.


