
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Экспериментальные и расчетные данные для процесса цинкования
Обработка экспериментальных данных Часть 1. Определение электрохимического эквивалента меди
1. Запишите уравнения процессов, протекающих на аноде и катоде, а также суммарную реакцию. 2. Рассчитайте изменение массы катода в результате эксперимента по формуле ∆ m эксп= m кон – m нач, г. 3. Вычислите опытную величину электрохимического эквивалента меди по уравнению k Э(опыт) = 4. Рассчитайте молярную массу эквивалента меди по формуле (1) М Э(Cu) = 5. Оцените теоретическую величину электрохимического эквивалента меди по уравнению (13) k Э(теор) = 6. Вычислите относительную погрешность каждого опыта П = 7. Расчетные данные занесите в табл. 2, заполните метрологическую карту средств измерения и сформулируйте выводы.
Часть 2. Газометрический метод определения выхода продуктов электролиза по току
1. Запишите уравнения процессов, протекающих на аноде и катоде, а также суммарную реакцию. 2. Поскольку водород и кислород в эвдиометрах собирают над водным раствором, то по закону Дальтона измеренное при помощи барометра давление в лаборатории Р равно сумме давлений чистого водорода Р
Тогда расчет парциального давления водорода и кислорода следует вести по формулам
Значения 3. Определите объемы водорода и кислорода при н.у., используя выражение объединенного газового закона V V где Т ° – температура при н.у., равная 273 К; Р° – парциальное давление при н.у., равное 101325 Па.; Т – температура в лаборатории, К. 4. Вычислите теоретические объёмы газов при н.у. по закону Фарадея [формула (12)] V V где
5. Определите коэффициент выхода по току для водорода и кислорода по формуле (10)
6. Расчетные данные внесити в таблицу 3, заполните метрологическую карту средств измерения и сформулируйте выводы.
Часть 3. Электрохимическое цинкование
1. Запишите уравнения процессов, протекающих на аноде и катоде, а также суммарную реакцию. 2. Рассчитайте изменение массы катода в результате эксперимента по формуле ∆ m эксп= m кон – m нач, г. 3. Вычислите опытную величину электрохимического эквивалента цинка по уравнению k Э(опыт) = 4. Рассчитайте молярную массу эквивалента цинка по формуле (1) М Э(Zn) = 5. Оцените теоретическую величину электрохимического эквивалента цинка по уравнению (13) k Э(теор) = 6. Вычислите относительную погрешность каждого опыта П = 7. Вычислите теоретическую массу цинкового покрытия по формуле (11) ∆ m теор 8. Коэффициент выхода по току для обоих опытов рассчитайте по уравнению (10)
9. Расчетные данные внести в табл. 4, заполните метрологическую карту средств измерения и сформулируйте выводы.
Контрольные задания Вариант 1
1. Какую массу алюминия можно получить при электролизе расплава Al2O3, если в течении 1ч пропускать ток силой 20000 А при выходе по току 85%? 2. Составьте схему электролиза водного раствора сульфата кадмия на угольных электродах при рН=2 и концентрации соли 0,01 моль/л.
Вариант 2
1. Сколько времени следует пропускать ток силой 5А через раствор NaCl для получения 20 г NaOH? Напишите уравнение реакций. 2. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора K2SO4.
Вариант 3
1. Никелевые электроды погружены в 1М раствор NiSO4. В результате электролиза через 1 ч масса одного из электролизов уменьшилась на 1,00 г. Чему равна сила тока? Напишите уравнение реакций. 2. Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора NaNO3.
Вариант 4
1. Составьте схему электролиза водного раствора бромида железа (III) на угольных электродах, если рН=5, а концентрация соли равна 0,001 моль/дм3. 2. При электролизе растворов CuCl2 на аноде выделилось 500 мл газа (н.у.). Определите массу меди выделившейся на катоде.
Вариант 5
1. Составьте схему электролиза 0,01 моль/ дм3 раствора сульфата германия (II) на угольных электродах при рН=2. 2. При электролизе водного раствора SnCl2 на аноде выделилось 4,4 дм3 хлора (н.у.). Вычислите массу выделившегося на катоде олова.
Вариант 6
1. Составьте схему электролиза водного раствора гидроксида цинка на угольных электродах при рН=9 и с (Zn2+)=0,001моль/ дм3. 2. Вычислите объем кислорода (н.у.), который выделится при пропускании тока силой 6А в течении 30 мин через водный раствор КОН.
Вариант 7
1. Составьте схему электролиза водного раствора иодида кобальта (II) на графитовых электродах при рН=8 и концентрации ионов кобальта 0,003 моль/ дм3. 2. При прохождении через раствор соли трехвалентного металла тока силой 1,5А в течении 30 мин на катоде выделилось 1,071 г металла. Вычислите атомную массу металла. Вариант 8
1. Составьте схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный. 2. Электролиз раствора нитрата серебра проводили при силе тока 2 А в течении 4 ч. Сколько граммов серебра выделилось на катоде? Вариант 9
1. Опишите, процессы протекающие на катоде и аноде при электролизе водного раствора сульфата никеля с концентрацией ионов никеля 0,1моль/ дм3 при рН=4 на графитовых электродах. 2. Сколько электричества надо пропустить через раствор, чтобы получить 1 кг гидроксида натрия при электролизе хлорида калия? Выход по току 90 %.
Вариант 10
1. При электролизе раствора нитрата серебра в течение 50 мин при силе тока 3А на катоде выделилось 9,6 г серебра. Определите выход серебра в процентах от теоретического. 2. Составьте схемы электролиза и напишите уравнения электродных процессов протекающих при электролизе расплава и раствора ВaCl2
Вариант 11
1. В течении какого времени следует пропускать ток силой 5 А через 1 дм3 раствора NaCl, чтобы получить 20 г щелочи. Напишите уравнения реакций. 2. Составьте схему электролиза водного раствора сульфата железа (II) на графитовых электродах при рН=5 и концентрации ионов железа 0,02 моль/ дм3.
Вариант 12
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 405; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.107.101 (0.008 с.) |
 , г/Кл.
, г/Кл. , г/моль.
, г/моль. , г/Кл.
, г/Кл. , %
, % или кислорода Р
или кислорода Р  и насыщенного водяного пара Р
и насыщенного водяного пара Р 
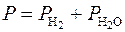 , Па
, Па , Па
, Па , Па
, Па , Па
, Па при различных температурах приведены в приложении 3.
при различных температурах приведены в приложении 3. (Н2) =
(Н2) =  , см3
, см3 , см3
, см3 (Н2) =
(Н2) =  , см3
, см3 , см3
, см3 - эквивалентный объем водорода при н.у., который равен 11200 см3/моль;
- эквивалентный объем водорода при н.у., который равен 11200 см3/моль;  - эквивалентный объем кислорода при н.у., который равен 5600 см3/моль.
- эквивалентный объем кислорода при н.у., который равен 5600 см3/моль. %
%  %
% , г/моль.
, г/моль. , г/Кл.
, г/Кл. , %
, % , г.
, г. .
.


