
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условия и характер течения окислительно-восстановительного процесса.Содержание книги
Поиск на нашем сайте Зверев В. Б-23
Самостоятельная работа №5 Условия и характер течения окислительно-восстановительного процесса. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно. Эти реакции могут быть использованы для получения электрического тока. Равным образом процессы окисления и восстановления могут протекать под действием электрического тока. В этих двух случаях окислительно-восстановительные реакции относят к электрохимическим процессам. Если в реакционной смеси присутствуют как исходные вещества, так и образуемые ими при протекании ОВР продукты реакции или, иначе говоря, два окислителя и два восстановителя, то направление реакции определяется тем, какой из окислителей в данных условиях в соответствии с уравнением Нернста окажется более сильным. Любая запись уравнения ОВР предполагает определенный выбор окислителя в левой части уравнения. Если в стандартных условиях этот окислитель сильнее, реакция пойдет в прямом направлении, если нет – в обратном. Процесс передачи электронов от окислителя к восстановителю является самопроизвольным и обратимым, при этом система в целом остается электрически нейтральной. 2.Как зависит ход окислительно-восстановительного процесса от реакции среды? Приведите пример. Чаще всего тот или иной окислитель или восстановитель является таковым только в определенной среде (кислой или щелочной). Сам процесс протекает более или менее энергично в зависимости от степени ее кислотности (щелочности). Иногда влияние характера среды может быть столь значительным, что обусловливает изменение самого направления процесса. Например, взаимодействие по схеме
в щелочной среде идет направо, в кислой – налево. Для создания в растворе кислой среды чаще всего пользуются серной кислотой (НСl и HNO3 применяют реже, так как первая из них способна окисляться, а вторая сама является окислителем, и поэтому в обоих случаях иногда могут протекать различные побочные реакции). Для создания щелочной среды служит обычно NaOH или КОН. Вещество, при помощи которого создается определенная среда, не всегда входит в окончательное уравнение реакции. В каком соотношении находятся стандартная электроподвижного сила гальванического элемента с константой равновесия реакции, что происходит в нем? Электрической характеристикой электрода является потенциал, а гальванического элемента (электрохимической цепи) электродвижущая сила (ЭДС), равная алгебраической сумме скачков потенциала, возникающих на границе раздела фаз, входящих в состав цепи. ЭДС электрохимической цепи соответствует Зверев В. Б-23 разности потенциалов правого (положительного) и левого (отрицательного) электродов и всегда положительна. ЭДС гальванического элемента (I) равна:
где где Ео – стандартная ЭДС гальванического элемента. Тогда
Следует помнить, что активность чистого твердого вещества принимается равной единице. Уравнение носит название уравнения Нернста для ЭДС гальванического элемента. Пусть в гальваническом элементе протекает обратимая химическая реакция Максимальная полезная работа гальванического элемента при стандартных условиях равна где z – число электронов, участвующих в элетродных реакциях (одинаковое для обоих электродов), F – постоянная Фарадея. По уравнению изотермы Вант-Гоффа: Зверев В. Б-23
3)Реакции внутримолекулярного окисления-восстановления, в которых степень окисления разных атомов изменяется внутри одной и той же молекулы. Чаще всего это происходит из-за термического разложения вещества. Например: 2Hg+2O –2 = 2Hg0 + O20 N –3H4N+5O3 = N2+1O + 2H2O. Зверев В. Б-23 Самостоятельная работа №6 Что такое металлиды? Металлиды — металлические соединения, интерметаллические фазы, промежуточные фазы, химические соединения металлов между собой. К М. примыкают соединения переходных металлов с неметаллами (Н, В, С, N и др.). В таких соединениях металлическая связь. М. получают прямым взаимодействием их компонентов при нагревании, путём реакций обменного разложения и др. Образование М. наблюдается при выделении избыточного компонента из твёрдых растворовили как результат упорядочения в расположении атомов компонентов твёрдых растворов. Какими методами можно определить состав образованного металлида? Состав М. обычно не отвечает формальной валентности их компонентов и может изменяться в значительных пределах. Это объясняется тем, что в М. ионная и связи встречаются редко, а преобладает металлическая связь.
Зверев В. Б-23 Самостоятельная работа №7 Что такое коррозия? Коррозия — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика, дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной.
Зверев В. Б-23
Самостоятельная работа №5 Условия и характер течения окислительно-восстановительного процесса. В отличие от реакций ионного обмена окислительно-восстановительные реакции (ОВР) в водных растворах протекают, как правило, не мгновенно. Эти реакции могут быть использованы для получения электрического тока. Равным образом процессы окисления и восстановления могут протекать под действием электрического тока. В этих двух случаях окислительно-восстановительные реакции относят к электрохимическим процессам. Если в реакционной смеси присутствуют как исходные вещества, так и образуемые ими при протекании ОВР продукты реакции или, иначе говоря, два окислителя и два восстановителя, то направление реакции определяется тем, какой из окислителей в данных условиях в соответствии с уравнением Нернста окажется более сильным. Любая запись уравнения ОВР предполагает определенный выбор окислителя в левой части уравнения. Если в стандартных условиях этот окислитель сильнее, реакция пойдет в прямом направлении, если нет – в обратном. Процесс передачи электронов от окислителя к восстановителю является самопроизвольным и обратимым, при этом система в целом остается электрически нейтральной. 2.Как зависит ход окислительно-восстановительного процесса от реакции среды? Приведите пример. Чаще всего тот или иной окислитель или восстановитель является таковым только в определенной среде (кислой или щелочной). Сам процесс протекает более или менее энергично в зависимости от степени ее кислотности (щелочности). Иногда влияние характера среды может быть столь значительным, что обусловливает изменение самого направления процесса. Например, взаимодействие по схеме
в щелочной среде идет направо, в кислой – налево. Для создания в растворе кислой среды чаще всего пользуются серной кислотой (НСl и HNO3 применяют реже, так как первая из них способна окисляться, а вторая сама является окислителем, и поэтому в обоих случаях иногда могут протекать различные побочные реакции). Для создания щелочной среды служит обычно NaOH или КОН. Вещество, при помощи которого создается определенная среда, не всегда входит в окончательное уравнение реакции.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 262; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |



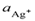 и
и 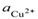 – активности ионов Ag+ и Cu2+ в растворах их солей. Обозначим
– активности ионов Ag+ и Cu2+ в растворах их солей. Обозначим 
 .
.





