
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вибір способу концентруванняСодержание книги Поиск на нашем сайте
ВСТУП
Для розрахунку технологічних параметрів випарної установки та конструктивних розмірів апаратів необхідні основні фізико-хімічні властивості розчину NaCl. Випарюванню піддається водний розчин хлорида натрію. Хлорид натрію відомий у побуті під назвою кухонної солі, основним компонентом якої він є. Хлорид натрію в значній кількості міститься в морській воді, створюючи її солоний смак. Зустрічається в природі у вигляді мінералу Галіт (кам'яна сіль). Чистий хлорид натрію має вигляд безбарвних кристалів, але з різними домішками його колір може приймати блакитний, фіолетовий, рожевий, жовтий або сірий відтінок. Помірно розчиняється у воді, розчинність мало залежить від температури наведена в таблиці 1.2. Таблиця 1.1.
Розчинність хлориду натрію істотно знижується в присутності хлороводню, гідроксиду натрію, солей - хлоридів металів. Розчиняється в рідкому аміаку, вступає в реакції обміну. Густина водних розчинів хлориду натрію наведена в таблиці 2.2. Таблиця 1.2.
Фізичні властивості хлорида натрію наведена в таблиці 1.3.
Таблиця1.3.
Вода – одна із самих поширених на Землі речовин. Вона входить до складу багатьох мінералів, знаходиться в ґрунті, являється обов’язковим компонентом усіх живих організмів. Вода – одна з кращих розчинників, розчиняє більшість полярних та дисоціюючи на іони речовин. Воду, яку використовують промислові підприємства, прийнято називати технічною. Її використовують, головним чином, як охолоджуючий агент, транспортуючий середовища для сипких матеріалів, як розчинник та інше. В цілому в усіх галузях промисловості 70-75% від загальної витрати води її використовують як холодоагент по циркуляційній схемі.[6] ЗАГАЛЬНА ЧАСТИНА Вибір способу концентрування Відомі наступні можливі методи концентрування розчинів: перегонка, виморожування, екстракція, випарювання. Перегонка один з найбільш розповсюджених методів розділення рідких однорідних сумішей, що складаються з двох або більшого числа компонентів. У широкому розумінні перегонка являє собою процес, що включає часткове випаровування суміші з наступною конденсацією пари, що утворюється, здійснюваних однократно або багаторазово. У результаті конденсації одержують чистий випарений компонент (рідину), склад якої відрізняється від складу вихідної суміші. За допомогою перегонки розділяють суміші, усі компоненти яких леткі, тобто володіють визначеним, хоча і різним тиском пари. Поділ перегонкою засновано на різній леткості компонентів суміші при одній і тій же температурі. У розглянутому випадку необхідно здійснювати концентрування водного розчину NaCl, один з компонентів якого не має леткості (NaCl). Отже процес перегонки в даному випадку не підходить. Екстракцією називають процес вилучення одного або декількох компонентів з розчинів або твердих тіл за допомогою виборчих розчинників (екстрагентів). Екстракція в системах рідина-рідина являє собою дифузійний процес, що протікає за участю двох взаємно нерозчинних або обмежено розчинних рідких фаз, між якими розподіляється екстрагована речовина (або кілька речовин). Екстракція незамінна для поділу суміші речовин, чуттєвих до підвищених температур. Тому що в розглянутому випадку речовина не має особливостей, наведених вище, то процес екстракції для даного випадку не є оптимальним. Випарюванням називається концентрування розчинів практично нелетких або малолетких речовин у рідких летких розчинниках, шляхом видалення частини леткого розчинника. Випарюванню піддають розчини твердих речовин (водні розчини лугів, солей та ін.), а також висококиплячі рідини, що мають при температурі випарювання досить малий тиск насиченої пари, деякі мінеральні й органічні кислоти, багатоатомні спирти та ін. При випарюванні звичайно здійснюється часткове видалення розчинника з всього об'єму розчину при його температурі кипіння. Тому випарювання принципово відрізняється від випаровування, що, як відомо, відбувається з поверхні розчину при будь-яких температурах нижче температури кипіння. У ряді випадків розчин, що випарюється, піддають наступній кристалізації у випарних апаратах, спеціально пристосованих для цих цілей. Тепло, необхідне для випарювання можна підводити будь-якими теплоносіями, що застосовують при нагріванні. Тепло, необхідне для випарювання розчинів, звичайно підводиться через стінку, що відокремлює теплоносія від розчину. У деяких виробництвах концентрування розчинів здійснюють при безпосередньому контакті розчину, що випарюється, з топковими газами або іншими газоподібними теплоносіями. В даному випадку розглядається процес концентрування водного розчину NaCl, який не має леткості, то для здійснення цього процесу доцільно вибрати процес випарювання. Процеси випарювання виконують під вакуумом, при підвищеному й атмосферному тисках. Вибір тиску зв'язаний із властивостями розчину, що випарюється, і можливістю використання тепла вторинної пари. Вакуум-випарка дозволяє знизити температуру кипіння розчину і застосовується для випарювання чуттєвих до високої температури розчинів (наприклад розчинів органічних речовин), а також висококиплячих розчинів, коли температура агента, що нагріває, не дає можливості вести процес під атмосферним тиском. Використання вакууму дозволяє також збільшити різницю температур між агентом, що нагріває, і киплячим розчином, а отже, зменшити поверхню теплообміну. При випарюванні під тиском вище атмосферного можна використовувати вторинну пару, як для випарювання, так і для інших нестатків. Однак випарювання під надлишковим тиском сполучено з підвищенням температури кипіння розчину. Тому даний спосіб застосовується для випарювання розчинів термічно стійких речовин. Крім того для випарювання під тиском необхідно застосовувати гріючі агенти з більш високою температурою. Отже, цей спосіб випарювання для розглянутого випадку не є оптимальним. При випарюванні під атмосферним тиском вторинна пара, що утвориться, не використовується і звичайно викидається в атмосферу. Такий спосіб випарювання є найбільш простим і доступним, але неекономічним, тому застосовувати його в даному проекті недоцільно.[2,8] Теоретичні основи процесу
Фізична сутність процесу випарювання це перетворення частини розчинника, або усього розчинника в пару, якщо випарюють однокомпонентну систему. Випарювання відбувається із усієї маси рідини при температурі кипіння і відповідному тиску з поверхні рідини при будь-якій температурі. З точки зору молекулярно-кінетичної теорії при випарюванні та випаровуванні має місце видалення частини молекул, які знаходяться в стані теплового руху із простору, що займає рідина. Молекули, які виділяються із рідини, заповнюють паровий простір і утворюють насичену пару. Частина цих молекул знову повертається в рідину, а частина залишається в паровому просторі і таким чином встановлюється динамічна рівновага, в результаті чого кількість молекул над рідиною і тиск насиченої пари досягають визначеної величини при даній температурі. Під час кипіння рідини пара виділяється не тільки з поверхні, а й з парових бульбашок, які утворюються в самій рідині і цей процес стає основним, оскільки утворені бульбашки становляться центрами пароутворення. Парові бульбашки зароджуються на поверхні теплообміну, їх утворенню сприяють також гази, які знаходяться в рідині. При нагріванні гази починають виділятися з рідини, утворюючи велику кількість бульбашок, в які випаровується рідина. Умовами утворення парових бульбашок є рівність тисків всередині бульбашки та зовнішнього тиску рідини, що її оточує. Щоб здійснити процес випарювання до рідини необхідно передати тепло від теплоносія, що можливо тільки при наявності температурного перепаду між ними. У випарній установці існує так званий загальний і корисний температурний напір, що відрізняються один від одного на величину температурних втрат (депресій), між якими існує наступний зв'язок. Загальний температурний напір (загальна різниця температур) – це різниця між температурою гріючої пари, яка подається в випарний апарат і температурою конденсації вторинної пари в конденсаторі [8]: ∆tзаг =Тг.п. – Тк (2.1) де ∆tзаг – загальна різниця температур, К; Тг.п. – температура гріючої пари,0С; Тк – температура конденсації вторинної пари в конденсаторі,0С. Корисний температурний напір (корисна різниця температур) в окремому випарному апараті визначається як різниця температури конденсації гріючої пари і киплячого розчину, визначається за формулою [8] ∆tк = Тг.п. – tкип. розчину. (2.2) Загальний корисний температурний напір (корисна різниця температур) в випарній установці в загальному плані – це загальна різниця температур з вирахуванням температурних втрат, визначається за формулою [8] ∆tк = ∆tзаг – SDвт, (2.3) де SDвт т – сума температурних втрат: SDвт = D' + D'' + D''', (2.4) де D' – температурна депресія,0С; D'' – гідростатична депресія,0С; D''' – гідродинамічна депресія,0С. Температурна депресія. Як відомо, що при одній і тій же температурі тиск пари над чистим розчинником набуває більшого значення, ніж тиск пари над розчином, і відповідно при одному і тому ж тиску температура кипіння чистого розчинника менша температури кипіння розчину. Різницю між температурами кипіння розчину і чистого розчинника називають температурною, або фізико-хімічною депресією. D' = tкип. розчину – tкип. розчинника. (2.5)
Крім фізико-хімічної, або температурної депресії існують ще гідростатична і гідродинамічна депресія. Всі ці депресії знижують корисний температурний напір у випарному апараті. Гідростатична депресія. Температура tкип.– це середня температура кипіння розчину в трубах: tкип. = tкін. - Dtг.еф., (2.6)
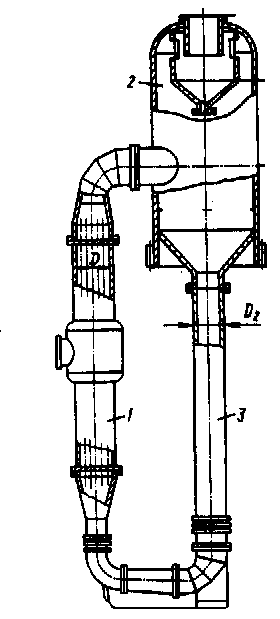
де Dtг.еф. – гідростатична депресія, або підвищення температури кипіння розчину внаслідок гідростатичного тиску стовпа рідини в апараті (гідростатичний ефект); tкін. температура кипіння розчину в сепараторі, при якій випарений (кінцевий) розчин виводиться з апарата. На температуру кипіння впливає висота стовпа рідини. Якщо рідина кипить всередині вертикальної кип'ятильної трубки, то температура кипіння в верхній частині трубки буде нижча, ніж внизу, де до зовнішнього тиску додається гідростатичний тиск. Гідростатична депресія – це різниця температури кипіння розчину в нижній частині кип’ятильних трубок, що знаходиться під тиском гідростатичного стовпа рідини Н в апараті, і температури кипіння на поверхні верхньої трубної решітки гріючої камери (tкін. в сепараторі). Наявність цієї депресії пов'язана з тим, що для утворення сферичних парових бульбашок у товщі рідини необхідно забезпечити у середині їх тиск, рівний тискові, утвореному висотою стовпа рідини. Гідродинамічна депресія виникає внаслідок втрати тиску (і температури) на подолання гідравлічних опорів у трубах – тертя та місцевих опорів в паропроводі при переході вторинної пари із корпусу в корпус установки і сполучних трактах апаратів. Особливо істотна гідродинамічна депресія у випарних апаратах зі спадаючою плівкою рідини, що працюють при невеликих температурних напорах. Величину гідродинамічної депресії приймають за практичними даними в межах 0,5 – 1,50С. Важливим питанням при розрахунку випарних апаратів є визначення температури пари над киплячим розчином. Її можна прийняти рівною температурі насичення при тиску в апараті, або ж рівною температурі рідини, згідно з результатами експериментальних досліджень.[1,2] За первинним теплоносієм – на апарати з паровими, газовими і рідинними теплоносіями, а також з електрообігрівом. Для даного процесу найбільше підходить апарат з паровим обігрівом, тому що при цьому забезпечується високе значення коефіцієнта теплопередачі поряд із простотою регулювання параметрів процесу та невисокою вартістю. 3. За сполученням стадій нагрівання і пароутворення – на апарати, у яких ці стадії сполучені та апарати з винесеною зоною пароутворення або з винесеною гріючою камерою. Для даного випадку застосуємо останній тип – апарат з винесеною гріючою камерою, для запобігання відкладень на поверхні нагрівання. 4. За способом організації руху розчину – на апарати з природною і примусовою циркуляцією. Природна циркуляція може здійснюватися в об'ємі апарата, або забезпечуватися спеціальними циркуляційними трубами. Примусова циркуляція організується за допомогою насосів, мішалок або подачі пари (газу). У даному випадку найбільше підходить природна циркуляція, тому що розчин не утворює кристалів і має невелику в'язкість. 5. За напрямком руху пари і рідини – на апарати, у яких рідина рухається знизу нагору, або ж зверху вниз. Остання обставина сприятливо позначається на режимі теплообміну, тому що рух пари і плівки в одному напрямку сприяє збільшенню швидкості руху плівки і турбулізацій. На основі аналізу, враховуючи середню продуктивність установки, достатньо значне значення концентрації та в’язкості випарюваного розчину, з метою інтенсифікації процесу випарювання приймаємо випарний апарат безперервної дії з винесеною гріючою камерою та солевідділенням. Ескіз випарного апарата показано на рис.2.2. В апараті такої конструкції при розміщенні гріючої камери за межами корпусу створюється можливість підвищити інтенсивність випарювання як за рахунок різниці густин парорідинної емульсії в циркуляційній трубі і кип’ятильних трубках, так і за рахунок збільшення висоти самих кип’ятильних труб, довжина яких часто досягає 7 м. Він працює при більш інтенсивній природній циркуляції завдяки тому, що циркуляційна труба не обігрівається, а підіймальні та спускові ділянки циркуляційного контуру мають значну висоту. Розбавлений розчин надходить під нижню трубну решітку гріючої камери 1 і, піднімаючись по кип’ятильним трубкам і випарюється. Гріюча пара подається в міжтрубний простір гріючої камери 1, конденсується і віддає тепло стінкам кип’ятильних трубок. За рахунок цього тепла розчин кипить в кип’ятильних трубках. Утворена парорідинна емульсія надходить в сепаратор 2, в якому вторинна пара відділяється від киплячого розчину і виводиться із сепаратора. Звільнений від вторинної пари киплячий розчин опускається по циркуляційній трубі 3, яка не обігрівається, змішується з початковим розбавленим розчином, і циркуляція повторюється знову. При концентруванні розчинів хлориду натрію від початкової концентрації 10 до 25% мас. до установки приймаємо випарний апарат із природною циркуляцією і винесеною гріючою камерою, тип 1, виконання 2. Апарат складається з гріючої камери з кип'ятильними трубками з d = 38x2 мм і висотою Н = 4 м [5], та парового (сепараційного) простору.
Випарний апарат з природною циркуляцією та винесеною граючою камнрою
Рис. 2.2. 1 - гріюча камера, 2 - сепаратор, 3 - циркуляційна труба; Матеріал корпусу і деталей випарного апарата знаходиться в лужному середовищі киплячого розчину хлориду натрію. Для апаратів, що працюють в такому середовищі рекомендована в посібнику [6] сталь таких марок: 1Х13, 2Х13, Х17, Х28, Х18Н10Т. Приймаємо низьколеговану сталь 2Х13, стійку в агресивному середовищі. ТЕХНОЛОГІЧНИЙ РОЗРАХУНОК Вибір тиску вторинної пари У вибраній схемі вторинна пара використовується для підігрівання розчину до температури tп = 400С, тому її температура повинна бути на 8 – 100 вище за кінцеву температуру нагрівання розчину [4]: Твт.п. = tп + (8 – 100)
Твт.п. = 40 + 10 = 50 0С. Відповідно до температури пари за таблицею LVII [4] знаходимо її тиск, Рвт.п. = 0,01258 МПа. Таблиця 3.1 Зведений тепловий баланс випарної установки
Розходження балансу:
КОНСТРУКТИВНИЙ РОЗРАХУНОК Вихідні дані для розрахунку: Витрата початкового розбавленого розчину, Gп = 2,2 кг/с; Температура кипіння розчину tк = 66,20С; Корисна різниця температур Dtкор = 53,40С; Температура гріючої пари, Тг.п. = 119,60С; Температура вторинної пари, Тв.п. =500С.
Таблиця 4.2. ГІДРАВЛІЧНИЙ РОЗРАХУНОК
Розрахунок гідравлічного опору необхідний для визначення витрат енергії на переміщення рідини або пари і вибір машин для цього. Загальні втрати тиску у випарному апараті складають:
DP = DPs + DPст + DPвт (5.1)
де DPs - тиск, необхідний для подолання сил поверхневого натягу, Па; DPст – гідростатичний тиск стовпа рідини, Па; DPвт – втрата напору за рахунок тертя і місцевих опорів у трубному просторі, Па. DPs визначаємо згідно виразу
де s - поверхневий натяг розчину, s = 0,0609 Н/м, [3]; dв – внутрішній діаметр кип'ятильної трубки dв= 0,034 м; DPст – гідростатичний тиск стовпа рідини:
DPст = rр*g*H (5.3)
DPст = 1165*9,81*4 = 45714,6 Па;
де rр – густина 25% розчину NaCl; rр = 1165 кг/м3; Н – висота труб гріючої камери, Н = 4 м; DPвт – втрата напору за рахунок тертя і місцевих опорів у трубному просторі, визначаємо згідно виразу:
де l - коефіцієнт гідравлічного тертя визначається в залежності від режиму руху; Sz - сума коефіцієнтів місцевих опорів. Режим руху розчину в трубках визначаємо за критерієм Рейнольдса:
де wоб – швидкість підйому бульбашок, м/с; d0 – діаметр бульбашки киплячої рідини, м, приймаємо d0 = 0,005 м, rр - густина розчину, кг/м3; mр – в'язкість розчину, Па*с, mр = 0,824*10-3 Па*с. Швидкість підйому бульбашок визначаємо за формулою
Тоді значення критерію Рейнольдса в трубках складе:
Режим руху ламінарний, отже l визначаємо за формулою, що рекомендується для ламінарного режиму Сума коефіцієнтів місцевих опорів складе:
де
Число труб гріючої камери:
де dср – середній діаметр труби, dср = (38+43)/2 = 36 мм; Н – висота труб. Тоді:
Тоді:
Загальний гідравлічний опір випарного апарата складе:
DP = 7,16 + 45714,6+ 35,1 = 45756,86 Па.
СПИСОК ЛІТЕРАТУРИ
1. Краткая химическая энциклопедия, т.ІІ "Советская Энциклопедия". – М. – 1964. – 746 с. 2. Касаткин А.Г. Основные процессы и аппараты химической технологии. – М.: Химия, 1971. – 783 с. 3. Дытнерский Ю.И. Основные процессы и аппараты химической технологии. – М.: Химия, 1991. – 496 с. 4. Павлов К.Ф., РоманковП.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. – Л.: Химия, 1987. – 576 с. 5. Зайцев И.Д., Асеев Т.Г. Физико-химические свойства бинарных и многокомпонентных неорганических веществ. –М.: Химия, 1988. – 416 с. 6. Иоффе И.А. Проэктирование процессов и аппаратов химической технологии. – Л.: Химия, 1991. – 345 с. 7. ЛащинскийА.А. Конструирование сварных химических аппаратов. Справ очник. – Л.: Машиностроение, 1981. – 381 с. 8. Методичні вказівки до оформлення курсового проекту з курсу “Основні процеси та апарати хімічної технології” для студентів IV – V курсів усіх спеціальностей і форм навчання. – Дніпропетровськ: УДХТУ, 2001. – 28 с.
РЕФЕРАТ Рис. 6; таб. 8; арк.
Ключові слова: УСТАНОВКА, ВИПАРЮВАННЯ, ОДНОКОРПУСНА ВИПАРНА УСТАНОВКА, РІЗНИЦЯ ТЕМПЕРАТУР, ДЕПРЕСІЯ ТЕМПЕРАТУРИ, ПАР, ТЕХНОЛОГІЧНИЙ РОЗРАХУНОК.
В головній частині обговорюються загальні відомості про процес випарювання, фізико-хімічні основи й технологічна схема процесу. Прийнято однокорпусну випарну установку для концентрування розчину хлориду натрію потужністю 2,2 кг/с. Вибрані основні технологічні параметри процесу концентрування розчинів.
Прийнята принципова конструкція кожухотрубного теплообмінника - підігрівача. На основі технологічного розрахунку визначено коефіцієнти тепловіддачі в підігрівачу та теплові наванатення. Визначені основні конструкційні розміри теплообмінника.
ВСТУП
Для розрахунку технологічних параметрів випарної установки та конструктивних розмірів апаратів необхідні основні фізико-хімічні властивості розчину NaCl. Випарюванню піддається водний розчин хлорида натрію. Хлорид натрію відомий у побуті під назвою кухонної солі, основним компонентом якої він є. Хлорид натрію в значній кількості міститься в морській воді, створюючи її солоний смак. Зустрічається в природі у вигляді мінералу Галіт (кам'яна сіль). Чистий хлорид натрію має вигляд безбарвних кристалів, але з різними домішками його колір може приймати блакитний, фіолетовий, рожевий, жовтий або сірий відтінок. Помірно розчиняється у воді, розчинність мало залежить від температури наведена в таблиці 1.2. Таблиця 1.1.
Розчинність хлориду натрію істотно знижується в присутності хлороводню, гідроксиду натрію, солей - хлоридів металів. Розчиняється в рідкому аміаку, вступає в реакції обміну. Густина водних розчинів хлориду натрію наведена в таблиці 2.2. Таблиця 1.2.
Фізичні властивості хлорида натрію наведена в таблиці 1.3.
Таблиця1.3.
Вода – одна із самих поширених на Землі речовин. Вона входить до складу багатьох мінералів, знаходиться в ґрунті, являється обов’язковим компонентом усіх живих організмів. Вода – одна з кращих розчинників, розчиняє більшість полярних та дисоціюючи на іони речовин. Воду, яку використовують промислові підприємства, прийнято називати технічною. Її використовують, головним чином, як охолоджуючий агент, транспортуючий середовища для сипких матеріалів, як розчинник та інше. В цілому в усіх галузях промисловості 70-75% від загальної витрати води її використовують як холодоагент по циркуляційній схемі.[6] ЗАГАЛЬНА ЧАСТИНА Вибір способу концентрування Відомі наступні можливі методи концентрування розчинів: перегонка, виморожування, екстракція, випарювання. Перегонка один з найбільш розповсюджених методів розділення рідких однорідних сумішей, що складаються з двох або більшого числа компонентів. У широкому розумінні перегонка являє собою процес, що включає часткове випаровування суміші з наступною конденсацією пари, що утворюється, здійснюваних однократно або багаторазово. У результаті конденсації одержують чистий випарений компонент (рідину), склад якої відрізняється від складу вихідної суміші. За допомогою перегонки розділяють суміші, усі компоненти яких леткі, тобто володіють визначеним, хоча і різним тиском пари. Поділ перегонкою засновано на різній леткості компонентів суміші при одній і тій же температурі. У розглянутому випадку необхідно здійснювати концентрування водного розчину NaCl, один з компонентів якого не має леткості (NaCl). Отже процес перегонки в даному випадку не підходить. Екстракцією називають процес вилучення одного або декількох компонентів з розчинів або твердих тіл за допомогою виборчих розчинників (екстрагентів). Екстракція в системах рідина-рідина являє собою дифузійний процес, що протікає за участю двох взаємно нерозчинних або обмежено розчинних рідких фаз, між якими розподіляється екстрагована речовина (або кілька речовин). Екстракція незамінна для поділу суміші речовин, чуттєвих до підвищених температур. Тому що в розглянутому випадку речовина не має особливостей, наведених вище, то процес екстракції для даного випадку не є оптимальним. Випарюванням називається концентрування розчинів практично нелетких або малолетких речовин у рідких летких розчинниках, шляхом видалення частини леткого розчинника. Випарюванню піддають розчини твердих речовин (водні розчини лугів, солей та ін.), а також висококиплячі рідини, що мають при температурі випарювання досить малий тиск насиченої пари, деякі мінеральні й органічні кислоти, багатоатомні спирти та ін. При випарюванні звичайно здійснюється часткове видалення розчинника з всього об'єму розчину при його температурі кипіння. Тому випарювання принципово відрізняється від випаровування, що, як відомо, відбувається з поверхні розчину при будь-яких температурах нижче температури кипіння. У ряді випадків розчин, що випарюється, піддають наступній кристалізації у випарних апаратах, спеціально пристосованих для цих цілей. Тепло, необхідне для випарювання можна підводити будь-якими теплоносіями, що застосовують при нагріванні. Тепло, необхідне для випарювання розчинів, звичайно підводиться через стінку, що відокремлює теплоносія від розчину. У деяких виробництвах концентрування розчинів здійснюють при безпосередньому контакті розчину, що випарюється, з топковими газами або іншими газоподібними теплоносіями. В даному випадку розглядається процес концентрування водного розчину NaCl, який не має леткості, то для здійснення цього процесу доцільно вибрати процес випарювання. Процеси випарювання виконують під вакуумом, при підвищеному й атмосферному тисках. Вибір тиску зв'язаний із властивостями розчину, що випарюється, і можливістю використання тепла вторинної пари. Вакуум-випарка дозволяє знизити температуру кипіння розчину і застосовується для випарювання чуттєвих до високої температури розчинів (наприклад розчинів органічних речовин), а також висококиплячих розчинів, коли температура агента, що нагріває, не дає можливості вести процес під атмосферним тиском. Використання вакууму дозволяє також збільшити різницю температур між агентом, що нагріває, і киплячим розчином, а отже, зменшити поверхню теплообміну. При випарюванні під тиском вище атмосферного можна використовувати вторинну пару, як для випарювання, так і для інших нестатків. Однак випарювання під надлишковим тиском сполучено з підвищенням температури кипіння розчину. Тому даний спосіб застосовується для випарювання розчинів термічно стійких речовин. Крім того для випарювання під тиском необхідно застосовувати гріючі агенти з більш високою температурою. Отже, цей спосіб випарювання для розглянутого випадку не є оптимальним. При випарюванні під атмосферним тиском вторинна пара, що утвориться, не використовується і звичайно викидається в атмосферу. Такий спосіб випарювання є найбільш простим і доступним, але неекономічним, тому застосовувати його в даному проекті недоцільно.[2,8] Теоретичні основи процесу
Фізична сутність процесу випарювання це перетворення частини розчинника, або усього розчинника в пару, якщо випарюють однокомпонентну систему. Випарювання відбувається із усієї маси рідини при температурі кипіння і відповідному тиску з поверхні рідини при будь-якій температурі. З точки зору молекулярно-кінетичної теорії при випарюванні та випаровуванні має місце видалення частини молекул, які знаходяться в стані теплового руху із простору, що займає рідина. Молекули, які виділяються із рідини, заповнюють паровий простір і утворюють насичену пару. Частина цих молекул знову повертається в рідину, а частина залишається в паровому просторі і таким чином встановлюється динамічна рівновага, в результаті чого кількість молекул над рідиною і тиск насиченої пари досягають визначеної величини при даній температурі. Під час кипіння рідини пара виділяється не тільки з поверхні, а й з парових бульбашок, які утворюються в самій рідині і цей процес стає основним, оскільки утворені бульбашки становляться центрами пароутворення. Парові бульбашки зароджуються на поверхні теплообміну, їх утворенню сприяють також гази, які знаходяться в рідині. При нагріванні гази починають виділятися з рідини, утворюючи велику кількість бульбашок, в які випаровується рідина. Умовами утворення парових бульбашок є рівність тисків всередині бульбашки та зовнішнього тиску рідини, що її оточує. Щоб здійснити процес випарювання до рідини необхідно передати тепло від теплоносія, що можливо тільки при наявності температурного перепаду між ними. У випарній установці існує так званий загальний і корисний температурний напір, що відрізняються один від одного на величину температурних втрат (депресій), між якими існує наступний зв'язок. Загальний температурний напір (загальна різниця температур) – це різниця між температурою гріючої пари, яка подається в випарний апарат і температурою конденсації вторинної пари в конденсаторі [8]: ∆tзаг =Тг.п. – Тк (2.1) де ∆tзаг – загальна різниця температур, К; Тг.п. – температура гріючої пари,0С; Тк – температура конденсації вторинної пари в конденсаторі,0С. Корисний температурний напір (корисна різниця температур) в окремому випарному апараті визначається як різниця температури конденсації гріючої пари і киплячого розчину, визначається за формулою [8] ∆tк = Тг.п. – tкип. розчину. (2.2) Загальний корисний температурний напір (корисна різниця температур) в випарній установці в загальному плані – це загальна різниця температур з вирахуванням температурних втрат, визначається за формулою [8] ∆tк = ∆tзаг – SDвт, (2.3) де SDвт т – сума температурних втрат: SDвт = D' + D'' + D''', (2.4) де D' – температурна депресія,0С; D'' – гідростатична депресія,0С; D''' – гідродинамічна депресія,0С. Температурна депресія. Як відомо, що при одній і тій же температурі тиск пари над чистим розчинником набуває більшого значення, ніж тиск пари над розчином, і відповідно при одному і тому ж тиску температура кипіння чистого розчинника менша температури кипіння розчину. Різницю між температурами кипіння розчину і чистого розчинника називають температурною, або фізико-хімічною депресією. D' = tкип. розчину – tкип. розчинника. (2.5)
Крім фізико-хімічної, або температурної депресії існують ще гідростатична і гідродинамічна депресія. Всі ці депресії знижують корисний температурний напір у випарному апараті. Гідростатична депресія. Температура tкип.– це середня температура кипіння розчину в трубах: tкип. = tкін. - Dtг.еф., (2.6)
де Dtг.еф. – гідростатична депресія, або підвищення температури кипіння розчину внаслідок гідростатичного тиску стовпа рідини в апараті (гідростатичний ефект); tкін. температура кипіння розчину в сепараторі, при якій випарений (кінцевий) розчин виводиться з апарата. На температуру кипіння впливає висота стовпа рідини. Якщо рідина кипить всередині вертикальної кип'ятильної трубки, то температура кипіння в верхній частині трубки буде нижча, ніж внизу, де до зовнішнього тиску додається гідростатичний тиск. Гідростатична депресія – це різниця температури кипіння розчину в нижній частині кип’ятильних трубок, що знаходиться під тиском гідростатичного стовпа рідини Н в апараті, і температури кипіння на поверхні верхньої трубної решітки гріючої камери (tкін. в сепараторі). Наявність цієї депресії пов'язана з тим, що для утворення сферичних парових бульбашок у товщі рідини необхідно забезпечити у середині їх тиск, рівний тискові, утвореному висотою стовпа рідини. Гідродинамічна депресія виникає внаслідок втрати тиску (і температури) на подолання гідравлічних опорів у трубах – тертя та місцевих опорів в паропроводі при переході вторинної пари із корпусу в корпус установки і сполучних трактах апаратів. Особливо істотна гідродинамічна депресія у випарних апаратах зі спадаючою плівкою рідини, що працюють при невеликих температурних напорах. Величину гідродинамічної депресії приймають за практичними даними в межах 0,5 – 1,50С. Важливим питанням при розрахунку випарних апаратів є визначення температури пари над кипл
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 396; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.54.100 (0.016 с.) |

 , що не перевищує 5%.
, що не перевищує 5%. (5.2)
(5.2)
 (5.4)
(5.4) , (5.5)
, (5.5)
 (5.6)
(5.6)
 ,
,
 (5.7)
(5.7) - сума коефіцієнтів місцевих опорів при вході розчину в труби, для одної труби
- сума коефіцієнтів місцевих опорів при вході розчину в труби, для одної труби  = 0,2 [4].
= 0,2 [4]. - сума коефіцієнтів місцевих опорів при виході розчину із труби, для одної труби
- сума коефіцієнтів місцевих опорів при виході розчину із труби, для одної труби  = 1 [4].
= 1 [4]. (5.8)
(5.8) труб
труб ,
,





