
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-востановительное титрирование. Пермангонатометрия и иодометрия: титранты и индикаторы.Содержание книги
Поиск на нашем сайте
33.1. Методы редоксометрии основаны на реакциях окисления-восстановления. Разработано очень много методов. Их классифицируют в соответствии с применяемым стандартным (рабочим, титрантом) раствором. 33.2. Наиболее часто применяются следующие методы: Перманганатометрия -метод, который основан на окислительной способности рабочего раствора перманганата калия KМnO4. Титрование ведется без индикатора. Применяется для определения только восстановителей при прямом титровании.В основе перманганатометрии лежит реакция окисления различных восстановителей рабочим раствором перманганата калия, т.е. ионом MnO4-. Окисление перманганатом калия можно проводить в кислой, нейтральной и в щелочной среде.В сильнокислой среде перманганат-ионы (МnО4-) обладают высоким окислительно-восстановительным потенциалом, восстанавливаясь до Мn2+, и их применяют для определения многих восстановителей:МnО4- + 8Н+ + 5е =Мn2+ + 4Н2О В щелочной среде МnО4- восстанавливается до манганат иона:МnО4- + е = МnО42- В нейтральной или слабощелочной среде перманганат ион восстанавливается до марганцовистой кислоты MnO(OH)2 или до MnO2:МnО4- + 2Н2О + 3е = МnО2v + 4ОН- Раствор КМnО4 относится к титрантам с установленным титром. В связи с этим перед использованием его в анализе в качестве титранта раствор КМnО4. 33.3. Иодометрия - метод, в котором рабочим титрованным раствором служит раствор свободного иода в КI. Метод позволяет определять как окислители, так и восстановители. Индикатором служит крахмал.Иодометрический метод титриметрического анализа основан на реакции:I2 + 2e = 2I- В качестве титранта при определении окислителей применяется раствор тиосульфата натрия, который взаимодействует с выделившимся йодом (заместитель) в эквивалентном количестве. Na2S2O3-тиосульфат Электронные потенциалы и механизмы их возникновения. Уравнения Нериста для вычисления электродных потенциалов. 34.1. Электронные потенциалы – скачок потенциала, возникающий на границе раздела металл - раствор его соли. Механизм возникновения электродных потенциалов, их количественное определение, процессы, которые сопровождаются возникновением электрического тока или вызваны электрическим током, изучаются особым разделом химии – электрохимией. 34.2. Уравнения Нериста - уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар:
Окислительно-востановительные системы. Окислитено-востановительные потенциалы, механизм их воздействия, биологическое значение. Потенциометрия. 35.1. Биологическое значение ОВП – важными процессами в животных организмах являются реакции ферментативного окисления веществ-субстратов: углеводов, жиров, аминокислот. В результате этих процессов организмы получают большое количество энергии. Окислительно-восстановительный потенциал. Основными процессами, обеспечивающими жизнедеятельность любого организма, являются окислительно-восстановительные реакции, т.е. реакции, связанные с передачей или присоединением электронов. Энергия, выделяемая в ходе этих реакций, расходуется на поддержание гомеостаза (жизнедеятельности организма) и регенерацию клеток организма, т.е. на обеспечение процессовжизнедеятельности организма соответственно в настоящем и будущем. 35.2. Окислительно-восстановительный потенциал (редокс-потенциал) — мера способности химического веществаприсоединять электроны (восстанавливаться) ОВС – электрохимические системы, содержащие окислительную и восстановительную форму одного и того же вещества или нескольких веществ. Потенциометрия – это совокупность физико-химических методов исследования, в основе которых лежит измерение электродвижущей силы цепей, составленных из индикаторного электрода и электрода сравнения. Жидкости и ткани организма как проводники второго рода. Удельная и эквивалентная электропроводимость, их изменения с разведением раствора. Эквивалентная электропроводимость при бесконечном разведении. Абсолютная скорость движения и подвижность ионов. Закон Кольрауша о независимой подвижности ионов. Гидратация ионов.
36.1. Закон Кольрауша – предельная молярная электрическая проводимость раствора электролита равна сумме молярных подвижностей анионов и катионов, входящих в состав этого электролита. 36.2. Жидкости и ткани организма человека относятся к проводникам второго рода, поэтому прохождение через них электрического тока связано с перемещением положительно заряженных частиц (катионов) к отрицательному полюсу - катоду, а отрицательно заряженных частиц (анионов) - к положительному полюсу - аноду. В биологических тканях возникает ток проводимости. Подойдя к тому или иному полюсу, ионы восстанавливают свою наружную электронную оболочку и превращаются в атомы, обладающие высокой химической активностью. Этот процесс носит название терапевтического электролиза. Электропроводность растворов электролитов обусловлена перемещением ионов в электрическом поле (в отличие от электронной проводимости проводников первого рода). Электропроводность - математическая оценка способности раствора проводить электрический ток, зависит в основном от степени минерализации исследуемого раствора и его температуры. В качестве количественной меры способности раствора электролита проводить электрический ток используют обычно удельную электропроводность κ (каппа) - величину, обратную удельному сопротивлению (т.е. величину, обратную сопротивлению столба раствора между электродами площадью 1 см2, находящимися на расстоянии 1 см): χ=1/ρ, Ом-1см-1 Удельная электропроводимость - численно равна проводимости вещ-ва заключенного в объеме между двумя электродами, стоящими друг от друга на расстоянии l=1, и с S=1 м2 χ=1/R*l/S Зависит от концентрации вещ-ва в растворе.
|
||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 414; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.33.15 (0.008 с.) |


 — электродный потенциал,
— электродный потенциал,  — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;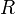 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K); — абсолютная температура;
— абсолютная температура; — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;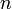 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе; и
и  — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.


