
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внешнеорбитальные и внутриорбитальные комплексыСодержание книги
Поиск на нашем сайте
Для катионов d- элементов характерны октаэдрические комплексы. При их образовании возможны два типа гибридизации: d2sр3 и sр3d2, в зависимости от того, какие d-орбитали комплексообразователя доступны для лиганд. Гибридизация d2sр3 осуществляется в том случае, если в образовании σ связей участвуют s и р орбитали внешнего уровня и две d-орбитали предпоследнего уровня. Этот вид гибридизации называется внутренней гибридизацией, а образующиеся комплексы внутриорбитальными. Например: [Cr(NH3)6]3+ Cr3+ [Cr(NH3)6]3+
При внутренней гибридизации лиганды прочно связаны с комплексообразователем, поэтому внутриорбитальные комплексы отличаются высокой устойчивостью. Если на образование σ-связей комплексообразователь поставляет только орбитали внешнего внешнего уровня, то осуществляется sр3d2 гибридизация. Её называют внешней, а образующиеся комплексы внешнеорбитальными. Такие комплексы образуют d- элементы с полностью заселёнными d подуровнями. Например: [Cd(Cl)6]4- Cd2+
[Cu(Cl)6]4-
Энергия связей, образованных при внешней гибридизации орбиталей комплексообразователя ниже, чем при внутренней гибридизации, поэтому внешнеорбитальные комплексы обладают меньшей прочностью по сравнению с внутриорбитальными. Если у катиона d- элемента d подуровень заселен неспаренными электронами, то тип гибридизации определяется природой лиганда. Лиганды, обладающие достаточной электронодонорной способностью, могут «вытеснить» электроны с двух орбиталей d подуровня и заставить их спариться на остальных двух орбиталях. При этом нарушается правило Гунда. Такой способностью обладают, например: цианид-ионы, поэтому они образуют внутриорбитальные комплексы. Например: [Fe(CN)6]4-: Fe2+ [Fe(CN)6]4- Если же лиганд не обладает достаточной электронодонорной способностью, то образуется внешнеорбитальный комплекс, например: [Fe(Н2О)6]2+ [Fe(Н2О)6]2+ Число неспаренных электронов в процессе комплексообразования в этом случае не меняется.
Представления о строении металлоферментов и других биокомплексных соединений (гемоглобин, цитохромы, кобаламины). Главную роль в жизнедеятельности живых организмов играют бионеорганические соединения с макроциклическими лигандами. В таких лигандах донорные атомы связаны в единое кольцо – цикл. Наиболее распространены тетрадентатные макроциклы – порфирины. Лигандами являются атомы азота, которые располагаются по углам квадрата и жестко скоординированы в пространстве. Поэтому они образуют прочные координационные соединения даже с катионами щелочно - земельных металлов. Например, если в качестве центрального атома выступает ион магния, то в результате образуется активный центр хлорофилла, а если используются ионы Fe2+, образуется активный центр гемоглобина. Порфириновые комплексы железа и кобальта входят в состав гемоглобина, каталазы, цитохромов, витамина В12. Все эти комплексы имеют октаэдрическую конфигурацию. Дефицит этих веществ в организме приводит к серьезным заболеваниям.
Устойчивость комплексных соединений в растворах Ионы внешней сферы соединены с комплексом ионной связью, поэтому в водных растворах они легко отщепляются: [Fe(Н2О)6]SO4 ↔ SO42- + [Fe(Н2О)6]2+. Этот процесс называется первичной диссоциацией. Внутренняя сфера в зависимости от прочности также способна диссоциировать на комплексообразователь и лиганды: [Fe(Н2О)6]2+ ↔ Fe2+ + 6 Н2О – это вторичная диссоциация. Она аналогична диссоциации слабых электролитов и характеризуется константой равновесия: Крав. = константа равновесия может служить мерой прочности комплекса: чем менее стоек комплекс, тем больше концентрация простых ионов или молекул Fe2+ и Н2О, тем больше численное значение константы. Поэтому константу равновесия, называют константой нестойкости комплекса. Величина, обратная константе нестойкости, называется константой устойчивости: Куст.=
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 206; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.17.137 (0.007 с.) |

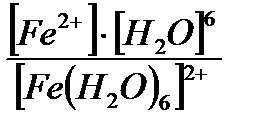
 =
=  .
.


