
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Простейшие стехиометрические расчеты
Общие методические указания Среди дисциплин, составляющих базовую подготовку специалистов и бакалавров, важное место занимает химия—наука, изучающая общие свойства и формы движения материи. С успехами химии и смежных с ней наук связано появление новых источников энергии, создание синтетических материалов, расширение сырьевой базы. Знание химии необходимо не только для понимания основ создания новых материалов и технологических процессов, но и для сохранения здоровья людей. Безответственное отношение к этим вопросам, отсутствие элементарной «химической культуры» уже сегодня пагубно отразилось на окружающей среде и поставило человечество на край экологической пропасти. Химия является одним из основных компонентов, составляющих методологическую базу подготовки специалистов в области естественных и технических наук. Основной составляющей учебного процесса для студента-заочника является самостоятельная работа с литературой. В обязательный план входит посещение лекций, выполнение трех контрольных заданий, написание реферата, индивидуальные и групповые консультации, выполнение лабораторного практикума, сдача зачета по лабораторному практикуму, сдача экзамена по всему курсу. Работа с учебником и методической литературой. Учебники и методическую литературу студент получает в библиотеке института, филиала или учебно-консультационного пункта, к которому он прикреплен. Курс общей и неорганической химии изучают в соответствии с разделами программы. Контрольные задания. При изучении курса «Химия» студент выполняет две контрольные работы. Выполнение работы начинается с проработки главы учебника и усвоения теоретического материала,затем студент приступает к выполнению контрольных задач по этой теме из контрольных заданий. Решение задач и ответы на вопросы должны быть обоснованы с использованием основных теоретических положений. При решении числовых задач приводится весь ход решения и математического преобразования. Контрольная работа выполняется в отдельной тетради с полями 40 мм. Номера и условия задач переписываются в порядке, указанном в контрольной работе. В конце работы приводится список использованной литературы, наименование учебника и года издания. Работа подписывается студентом с указанием даты и представляется на кафедру «Общая химия»для рецензирования. Если контрольная работа не зачтена, то неверно решенные задачи исправляются студентом в этой же тетради на чистых листах, а не в рецензируемом тексте, согласно требованиям, предъявляемым к оформлению контрольных задач. Контрольная работа, выполняется по своему варианту, который указывает преподаватель. КОНТРОЛЬНЫЕ ЗАДАНИЯ Задания для выполнения контрольной работы 1. Определить массу гидросульфата натрия, образующегося при нейтрализации раствора серной кислоты, содержащегося 8 г гидроксида натрия. 2. Некоторое количество металла, эквивалентная масса которого равна 28 г/моль, вытесняет из кислоты 0,7 л водорода, измеренного при нормальных условиях. Определить массу металла. 3. Сколько литров водорода (н.у) потребуется для восстановления 112 г оксида металла, содержащего 71,43% металла? Определить эквивалент металла. 4. Вычислить эквивалент металла 0,5 г которого вытеснили из кислоты 184 мл водорода при 210С и 101325 Па. 5. При взаимодействии 6 г металла с кислотой при (н.у) выделилось 2,8 л водорода. Определить исходный металл и его эквивалент. 6. Определить эквивалент металла и его атомную массу, если 1,215 г его вытесняют из серной кислоты 1,12 литров водорода (н.у). Валентность металла в соединении равна 2. 7. Найти эквивалент металла, если 2 г его взаимодействуют с 3,27 г фосфорной кислоты H3PO4, а 6 г этого металла вытесняют из H3PO4 такой объем кислорода, сколько его вытесняют 2,7 г алюминия. 8. Определить эквивалент двухвалентного металла, если из 48,15 г его оксида можно получить 88,65 г его нитрата. 9. В результате реакции 2,19 г металла с водородом образовалось 2,51 г гидрида MeH. Определить эквивалент металла. 10. При взаимодействия 1,5 г металла с водным раствором щелочи при 270С и 1 атм.выделилось 0,923 л водорода. Определить исходный металл и его эквивалент. Строение атома. Атом – наименьшая частица химического элемента – носитель всех его химических свойств. Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов. Ядро составляет основу атома и определяет индивидуальность элементов. В ядро атомов всех элементов (исключение При всех химических процессах ядра атомов элементов, входящих в состав реагирующих веществ, не изменяются. Изменение при этом претерпевают только электронные оболочки. Химическая энергия, таким обладающая элементарным отрицательным электрическим зарядом, равным 1,602*10-19 Кл. Масса покоя электрона мала и составляет 1/1837,14 массы протона. Как показала квантовая механика, электрон наряду со свойствами вещества (частица) обладает и свойствами электромагнитного поля. Таким образом, в свойствах электрона, в законах его движения проявляется неразрывность двух качественно различных форм существования материи: вещества и поля. Электрону, как любому микрообъекту, присуща двойственная корпускулярно-волновая природа. Движение электрона в атоме носит вероятностно – волновой характер. Околоядерное пространство, в котором с наибольшей вероятностью может находиться электрон, называется атомной орбиталью (АО). АО, как любая геометрических фигура, характеризуется тремя параметрами (координатами), получившими название квантовых чисел (n, l, ml). Они определяют размер (n), форму (l) и ориентацию (ml) атомной орбитали в пространстве. Занимая ту или иную АО, электрон образует электронное облако (электронную орбиталь). Формы электронных облаков аналогичны АО (рис.1). электронное облако характеризуется четырьмя квантовыми числами (n, l,ml, ms). Набором этих чисел можно полностью охарактеризовать состояние любого электрона в атоме. Главное квантовое число n определяет основную характеристику
электрона в атоме – его энергию и энергетический уровень. Она определяет также размеры АО. Для электронов, находящихся в невозбужденных атомах, n принимает значение от 1 до 7 (соответственно номеру периода в периодической системе элементов Д.М.Менделеева). совокупность электронов в атоме, обладающих одинаковым значением n, называют электронным слоем, эти слои обозначают: n 1 2 3 4 5 6 7 K L M N O P Q Орбитальное квантовое число l указывает на различие в энергии связи электронов, находящихся в пределах одного энергетического уровня. Электроны данного энергетического уровня группируются в подуровни. Орбитальное квантовое число определяет форму электронных орбиталей атома (рис. 1), l принимает целочисленные значения от 0 до n – 1. Для n=1 l=0; для n = 2 l = 0,1; для n = 3 l = 0,1,2; для n = 4 l = 0,1,2,3. Число подуровней в каждом энергетическом уровне равно его главному квантовому числу (табл.1). Больше четырех подуровней не заполняется, так как значение l = 0,1,2,3 описывают электроны в атомах всех известных элементов. АО, для которых l = 0, 1, 2, 3, соответственно называют s -, p -, d -, f -орбиталями, а электроны, занимающие эти орбитали, - соответственно s -, p -, d -, f - электронами. Магнитное квантовое число ml характеризует магнитный момент и пространственное расположение электронных облаков (рис.1). Число возможных значений магнитного квантового числа при заданном l равно 2l+1. l = 0, ml = 0 l = 1, ml = -1, 0, +1 l = 2 ml = -2, -1, 0, +1, +2 l = 3, ml =-3, -2, -1, 0, +1, +2, +3 Спиновое квантовое число ms характеризует движение электрона вокруг своей оси. Оно имеет +1/2 и -1/2. Энергетические состояния электрона схематически обозначают в виде квантовых (энергетических) ячеек, электроны в этих ячейках обозначают стрелками. Распределение электронов в атомах элементов по АО определяется принципом Паули, принципом наименьшей энергии и правилом Хунда. 1. Принцип Паули: в атоме не может быть двух и более электронов, имеющих одинаковый набор всех четырех квантовых чисел. Так как АО характеризуется тремя квантовыми числами: n, l, ml, то в ней могут находиться не более двух электронов с противоположными спинами. Согласно принципу Паули, максимальное число электронов на уровне N = 2n2 (табл 1). 2. Принцип наименьшей энергии. Правило Клечковского: последовательность размещения электронов по АО в невозбужденном атоме должна отвечать наибольшей связи их с ядром, т.е. электрон должен обладать наименьшей энергией. Согласно этому правилу электроны заполняют уровни и подуровни в такой последовательности (шкала энергий):
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 5f14 5d2-10 6p6 7s2 6d1 5f14 6d2-10 7p5,
где s, p, d, f – энергетические подуровни, цифры впереди букв означают энергетический уровень, в котором находятся данные электроны, а индекс наверху справа показывает число электронов на данном подуровне. Как следует из шкалы энергий, сначала заполняется 4s – подуровень, а затем 3d; 5s – подуровень, а затем 4d. Такая последовательность заполнения уровней и подуровней обусловлена принципом наименьшей энергии и правилом Клечковского: так как энергия электрона в основном определяется значениями главного квантового числа n и орбитального l, то сначала заполняются те подуровни, для которых сумма значений n +1 равны,то сначала идет заполнение подуровня с меньшим значением n. Отсюда следует, что после 3 p – подуровня заполняется 4 s – подуровень (n +l = 4 + 0=4), затем 3 d – подуровень (n + l = 3 +2 = 5), 4p (n +l=4+1=5) и 5 s -подуровень (n+l=5+0=5). Правило Хунда: орбитали в пределах данного подуровня заполняются сначала электрону, т.е каждый электрон располагается в отдельной квантовой ячейке в виде неспаренного электрона. Иными словами, при данном значении l электроны располагаются так, что суммарное спиновое число их (∑ms) максимально. Суммарный спин спаренных электронов равен нулю. Например, если три р-орбитали (px, py, pz) надо заполнить тремя p-электронами, то они должны распределяться по одному в каждой отдельной орбитали (ячейке). Схематически распределение электронов по квантовым ячейкам будет следующим: или
∑mss = + 1/2 +1/2 +1/2 = +3/2 или ∑mss = -1/2 – 1/2 – 1/2 = - 3/2 Строение электронных оболочек атомов тесно связано с периодической системой элементов Д.М.Менделеева. Номер периода равен количеству энергетических уровней (электронная оболочка атомов элементов 2-го периода имеет два энергетических уровня. 3-го периода – три, 4-го периода – четыре и т.д.). Всего 7 энергетических уровней и соответственно 7 периодов. Длина периодов определяется максимальной емкостью уровней: 2, 8, 18, 32 электрона. В 1-м периоде – 2 элемента; во 2-м и 3-м – 8 элементов; в 4-м и 5-м – 18 элементов; в 6-м – 32 элемента; 7 й период не закончен. В зависимости от того, на какой энергетический подуровень в атоме поступает последний электрон, элементы делятся на s-, p-, d- и f- элементы. При этом s - элементы составляют I и II главные подгруппы периодической системы (а также H и He); p -элементы составляют III, IV, V, VI, VII и VIII главные подгруппы периодической системы; d -элементы составляют побочные подгруппы периодической системы. У s - и p -элементов валентные электроны находятся на внешнем энергетическом уровне, у d - элементов – на s -подуровне внешнего энергетического уровня и предвнешнего незавешенного d-подуровня, f -элементы в коротко периодном варианте периодической таблицы выделены отдельно. На основании рассмотренных положений можно представить распределение электронов в атоме записывается в виде электронных формул. Чтобы составить электронную формулу атома любого элемента, следует знать номер данного элемента в периодической системе и перечисленные выше положения. Электронная формула фосфора будет составляться следующим образом: фосфор находится в 3-м периоде, порядковый номер 15, значит, 15электронов будут располагаться на трех энергетических уровнях (15Р 1s22s22p63s23p3).
Электронная структура атома может быть изображена в виде размещения электронов в квантовых ячейках (атомных орбиталях). Для атомов фосфора электронографическая схема выглядет так: s n = 1 p n = 2 d n = 3
Пример. Сколько протонов и нейтронов содержат ядра изотопов ванадия Решение. Порядковый номер элемента в периодической системе совпадает с величиной заряда ядра, т.е индекс внизу слева символа элемента указывает на количество протонов в ядре, следовательно, в ядрах изотопов ванадия имеется 23 протона. Число нейтронов равняется разности между массовым числом (индекс вверху слева символа) и порядковым номером элемента, следовательно, в ядрах изотопа Электронные формулы отображают распределение электронов в атоме по энергетическим уровням и подуровням. При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котром он будет обладать наименьшей энергией. Так как число электронов в атоме элемента равно заряду ядра, т.е его порядковому номеру в таблице Д.И.Менделеева, то элемента №23 – ванадия электронная формула, согласно шкале энергий, будет 23V 1s22s22p63s23p6 4s23d3 23V 1s22s22p63s23p6 3p34s2 Электронографические схемы отражают распределение электронов атомов по квантовым (энергетическим) ячейкам. В каждой квантовой ячейке может быть не более двух электронов с противоположными спинами (принцип Паули). Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда).
s n = 1 p n =2
d n = 3 f n = 4 Последний, 23-й электрон атома ванадия занимает d – орбиталь, следовательно, ванадий относится к d- электронному семейству. Задания для выполнения контрольной работы. Задание 1.1 Для приведенных в варианте (табл. 1.1) 4- х химических элементов определить: 1.1.1 Группу и период, в которых находится данный элемент в периодической таблице Д.И.Менделеева. 1.1.2 Электронную формулу атома элемента и указать, к какому семейству относится данный элемент. 1.1.3 Валентные электроны и перечислить все теоретически возможные степени окисления для нормального и возбужденного состояния атома. Привести примеры соединений, в которых данный элемент имеет разные степени окисления.
Таблица 1.1
Химическая связь. Примеры решения типовых задач Пример 1. Задание 3.1. Для двух, указанных по варианту молекул с позиций метода валентных связей показать образование молекул и ответить на следующие вопросы: 3.1.1 Каков тип гибридизации центрального атома в молекуле и валентный угол между связями? 3.1.2 Сколько 3.1.3. Определить полярность связей и полярность молекулы в целом. 3.1.4. Какова пространственная структура молекулы? Для ответа на вопросы задания рассмотрим молекулу CdI2. 3.1.1.Сначала определяем тип гибридизации центрального атома. Для этого выписываем валентные элекроны центрального атома 48Cd. 5s 4d Затем электроны переводим в возбужденное состояние
5s
5p
4d
Отмечаем, что у Cd имеются две внешние орбитали: s и р. Представим s- и р -орбитали на рис. 2.1.
Рис.2.1 Далее «проводим» валентные электроны 53I. Так как I – p - элемент, то на рис. 2.1 к электронам Cd подрисовываем гантелеобразные p- орбитали йода,получаем схему молекулы CdI2 (рис. 2.2)
Как видно из рис. 2.2 силы отталкивания между электронными орбиталями на участках I и II сильно различаются. С одной р- орбиталью йода кадмий связывается с помощью s -орбитали, а с другой - с помощью p -орбитали. Связи отличаются по форме и энергии. Такая молекула не будет устойчивой. Для образования устойчивой молекулы в центральном атоме происходит процесс гибридизации валентных орбиталей, который показан на рис 2.3.
Гибридизация – это процесс,в результате которого происходит перестройка валентных орбиталей центрального атома и образование смешанных гибридных орбиталей, одинаковых по форме и энергии. Таким образом, s + р = 2sp; по аналогии: s + р + р = 3sp2; s + р + + р + р + р = 4sp. Гибридные орбитали центрального атома - это заряженные поля и, отталкиваясь, они располагаются под определенным углом (валентный угол), чтобы образовалась устойчивая молекула: при гибридизации типа sp валентный угол составляет 180 sp2 - 120 sp3 - 109 Расположение гибридных орбиталей согласно этим валентным углам показано в табл. 2.1.
Таблица 2.1
В соответствии с данными табл. 2.1 в молекуле Cdl2 реализуется sp-гибридизация, и валентный угол составляет 1800. Чтобы изобразить молекулу в целом, остается показать перекрывание полученных гибридных орбиталей центрального атома с валентными орбиталями боковых атомов. В случае рассматриваемой молекулы CdI2 боковым атомом является 53I. Так как это р -элемент, то его валентные наружные электроны имеют орбиталь в виде гантели. В случае, если это будет s -элемент, форма орбитали имеет вид шара. "Подводя" валентные орбитали йода к гибридным орбиталям кадмия, получаем схему молекулы CdI2 (рис. 2.4). I Cd I
3.1.2. Отметим наличие σ- и π-связей в молекуле. Если область перекрывания находится на оси связи, связь о типа (сигма тип), если область перекрывания не находится на оси связи, а расположена по обе стороны от оси связи - это – пи тип (пи тип) (рис. 2.5).
В случае CdI2 в молекуле две ковалентные связи сигма – типа. Определим полярность. Полярность связана с наличием диполя, обусловленного оттягиванием валентных электронов в сторону более электроотрицательного атома (Приложение 1). В случае молекулы CdI2 более электроотрицательным элементом является йод. Поэтому связь Cd-I является полярной. Однако в целом молекула неполярна, так как при наличии двух диполей оттягивание электронов идет в обе стороны одинаково, и дипольные моменты взаимно компенсируются. 3.1.3. Разберем вопрос о пространственной структуре молекулы. Пространственная структура молекулы связана с типом гибридизации центрального атома и расположением боковых атомов вокруг центрального атома (табл. 2.2).
Как видно из табл. 2.2 при sp 3 гибридизации может реализоваться тетраэдрическая форма, пирамидальная или угловая в зависимости от числа боковых атомов (4, 3, 2 - соответственно). Из рис. 2.4 следует, что молекула CdI2 имеет линейную форму. Рассмотрим еще одну молекулу OF2. Выписываем валентные электроны центрального атома - кислорода. 2p 2s
Далее надо перевести в возбужденное состояние. Однако, так как во втором слое нет свободных (пустых) орбиталей, эту операцию пропускаем. Если в качестве центрального атома будет похожий элемент, но находящийся в третьем периоде, то для таких простых молекул, которые предлагаются в задании не следует при возбуждении переводить электроны с 3 s и 3 p на 3d,так как на это необходимы большие затраты энергии. Определяем тип гибридизации. Для этого производим «сложение»: s + p + p +p =4 sp3. при этом не следует писать 2s или 2p, так как речь идет не об электронах (на 2s подуровне), а их действительно 2, а об орбиталях, т.е пространства вероятного нахождения электронов. Рисуем четыре оси и гибридные облака. Подводим валентные орбитали F (это – p- элемент). Получаем угловую молекулу с теоретическим валентным углом 1090 (рис.2.7)
Рис. 2.7 Отдельные связи О-F - полярные, молекула в целом тоже полярна, так как в вершине угла заряд со знаком "+", а в противоположной стороне "
Основные понятия о химической кинетике. Примеры решения типовых задач Пример 1. Напишите выражение зависимости скорости прямой и обратной реакции от концентрации реагирующих веществ для следующих процессов. Как изменится скорость прямой и обратной реакции, если увеличить давление в системе в 3 раза? а) 2SO3 (r) 2SO2 (r) + O2 (r), б)FeO (тв) + CO (r) Fe (тв) + CO2(r). Решение: а) Система гомогенная, тогда: Vпрямая = K [SO3]2- ; Vобратная = k [SO2]2- · [O2]. При увеличении давления в 3 раза концентрация веществ также увеличиваются в 3 раза. Тогда скорость прямой реакции Vпрямой = k [3SO3]2 возрастает в 9 раз, а обратной – Vобратной = k [3SO2]2-·[3O2] возрастет в 27 раз; б) система гетерогенная, тогда: Vпрямой = k [CO], Vобратной = k [CO2]. При увеличении давления в 3 раза скорость прямой реакции Vпрямой = k [3CO] увеличится в 3 раза, а также обратной – Vобратной = k [3CO2] – в 3 раза. Пример 2. Определите порядок и молекулярность реакции. Напишите выражения для определения скорости реакции а) H2O2 (ж) = О2(r) + 2H (r), б) S (тв) + O2(r) = SO2 (r). Решение. Порядок реакции определяется суммой величин показателей степени при значениях концентраций исходных веществ в кинетическом уравнении: а) V1 = k 1[H2O2]; б) V2 = k 2[O2]. Поэтому обе реакции первого порядка. Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. Реакция а) одномолекулярная, б) двухмолекулярная. Выражение для определения скорости реакции первого порядка
Пример 3. При 800С некоторая реакция заканчивается за 16 мин. Сколько потребуется времени для проведения той же реакции: а) при 1200С, б) при 600С? Температурный коэффицент реакции Решение. а) Таким образом, скорость реакции при повышении температуры от 800 до 1200С возрастает в 16 раз, а следовательно, для проведения реакции потребуется в 16 раз меньше времени, то есть 1 мин. б) Пример 4. В системе происходит обратимая реакция. Запишить выражение для константы равновесия. Как надо изменить: а) температуру, б) давление, в) концетрацию исходных веществ, чтобы сместить равновесие вправо 1) 2SO3 (r) 2SO2 (r) + O2 (r), H = 384 кДж, 2) 2CO (r) CO2 (r) + C (тв), Н = -173 кДж? Решение. Реакция 1 гомогенная, эндотермическая, В соответствии с принципом Ле Шателье для смещения равновесия в сторону эндотермической реакции температуру необходимо повысить. Давление в системе для смещения равновесия вправо надо понизить. В результате понижения давления скорости прямой и обратной реакции замедляется, так как уменьшается концентрация всех веществ в системе. Но в соответствии с принципом Ле Шателье при понижении давления равновесия смещается в сторону образования большего числа молей газообразных веществ, то есть в сторону повышения давления. Концетрацию SO3 надо повысить, а SO2 и O2 выводить из системы для смещения равновесия вправо. Реакция 2 гетерогенная, экзотермическая, Для смещения равновесия в сторону экзотермической реакции необходимо понизить температуру. Давление в системе для смещения равновесия вправо надо повысить, так как при повышении давления равновесие смещается в сторону образования меньшего числа молей газообразных веществ, то есть в сторону понижения давления в системе. Концетрацию СО надо повышать, а СО2 выводить из системы для смещения равновесия вправо. Растворы электролитов Примеры решения типовых задач Пример 1. Найдите массу AlCl3, необходимую для приготовления 2 л (2*10-3 м3) раствора с массовой долей хлорида алюминия равной 12%. Плотность раствора 1090 кг/м3. Вычислите молярну концентрацию эквивалента, молярную концентрацию, молярность и титр раствора. Решение. 1.Определяем молярную массу и молярную массу эквивалента AlCl3 М(AlCl3) = 133,34 г/моль, Э(AlCl3) = 2.Находим массу AlCl3, необходимую для приготовления 2 л его раствора с массовой долей 12 %. Массовая доля Масса раствора равна произведению объема раствора (V) на его плотность ( М = 2*10-3*1090 кг/м3 = 2,18 кг. В 100 кг раствора содержится 12 кг AlCl3 В 2,18 кг раствора содержится х кг AlCl3
3.Находим молярную концентрацию раствора. Молярная концентрация раствора СМ показывает количество растворенного вещества, содержащего в 1 л раствора. В 2 л раствора содержится 261,6 г AlCl3. В 1 л раствора содержится х г AlCl3,
Молярная концентрация равна 4.Находим молярную концентрацию эквивалента. Молярная концентрация эквивалента (нормальная концентрация) раствора показывает число молярных масс эквивалентов растворенного вещества, содержащихся в 1 л раствора.
5.Нахолим молярность раствора. Молярность раствора Сm (моль/кг) показывает количество растворенного вещества, находящееся в 1 кг растворителя. Масса воды равна 2180 г – 261,6 г = 1918,4 г. Количество AlCl3 равно В 1918,4 г H2O растворено 1,96 моль AlCl3. В 1000 г H2O растворено х моль AlCl3,
6.Находим титр раствора. Титр раствора Т показывает массу (г) растворенного вещества, содержащегося в 1 мл раствора. В 1 л раствора содержится 130,8 г AlCl3.
Пример 2. Напишите уравнение электролитической диссоциации муравьиной кислоты и найдите концентрации ионов Н+ и НСОО- в моль /л в растворе, молярность которого равна 0,01, если константа диссоциации К дисс = 1,8*10-4 Решение. HCOOH H+ + HCOO- Cион = C* α *n, где С – молярная концентрация электролита; α – степень диссоциации; n – число ионов данного вида. Степень диссоциации приближенно находим из выражения упрощенного закона Оствальда
сн = снсоо = 0,01*1,34*10-1 = 1,34*10-3. Пример 3. Вычислите водородный показатель (pH) раствора и концентрации Н+ и ОН- раствора гидроксида калия, содержащего 0,056 г КОН в 100 мл раствора (α = 1). Решение. Находим концентрацию раствора КОН в молях. Молярная масса КОН равна 56 г.
Находим, сколько молей КОН содержится в 1 л раствора. В 100 мл раствора содержится 0,001 моль КОН. В 1000 мл раствора содержится х моль КОН, х = 0,01 моль Концентрация КОН (сКОН) равна 0,01 моль/л. Концентрация ОН- - ионов равна сКОН = 0,01 моль/л. рОН раствора рассчитываем по формуле
Для расчета I = 1/2 ∑ci * zi2 = 1/2 (cK*zK2 + cOH * zOH2 ) = 1/2 (0,01 * 12 + 0,01* 12) = 0,01. Из табл. П 6 находим рН = рКВ – рОН = 14 – 2,05 = 11,95. Пример 4. Составьте молекулярные и ионное уравнения гидролиза солей: а) нитрата аммония NH4NO3; б) сульфита лития Li2SO3; в) ацетата алюминия Al(CH3COO)3; напишите выражение для контастанты гидролиза и оцените рН среды. Решение. а) При растворении в воде соль NH4NO3 диссоциирует NH4NO3 NH4+ + NO3-. Ионы воды (Н+ и ОН-) в малодиссоциирующее соединения связывает ион NH4+, образуя молекулы слабого основания NH4ОН. Ионное уравнение гидролиза NH4NO3 NH4+ + H2O NH4OH + H+.
где Уравнение гидролиза в молекулярной форме NH4NO3 + H2O NH4OH + HNO3. Реакция среды кислая, рН < 7. б) Сульфит лития при растворении в воде диссоциирует Li2SO3 2Li+ + SO32-. Ионы SO32- связывают H+ - ионы воды ступенчато, образуя кислые ионы HSO3- и молекулы слабой кислоты H2SO3. Практически гидролиз соли ограничивается первой ступенью SO32- + H2O HSO3- + OH-, Li2SO3 + H2O NaHSO3 + NaOH.
Рекция раствора щелочная, рН > 7. в) Соль ацетата алюминия диссоциирует, образуя ионы Al(CH3COO)3 Al+3 + 3CH3COO- Ионы Al+3 и ион CH3COO- взаимодействуют с ионами воды, образуя малорастворимые соединения Al(OH)3 и взаимодействии слабой кислоты и слабого основания, гидролизуются необратимо и полностью. Al(CH3COO)3 + 3H2O = Al(ОН3) + 3 CH3COO.
pH раствора Al(CH3COO)3 зависит от соотношения | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |
 ) входят протоны и нейтроны, которые могут взаимно превращаться друг друга. Протон (р) – элементарная частица с массой покоя 1,00728 и положительным зарядом, по абсолютной величине равным заряду электрона. Число протонов в ядре характеризует его заряд и принадлежность атома данному химическому элементу. Нейтрон (n) также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса покоя нейтрона составляет 1,00867. Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами. Как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин.
) входят протоны и нейтроны, которые могут взаимно превращаться друг друга. Протон (р) – элементарная частица с массой покоя 1,00728 и положительным зарядом, по абсолютной величине равным заряду электрона. Число протонов в ядре характеризует его заряд и принадлежность атома данному химическому элементу. Нейтрон (n) также представляет собой элементарную частицу, но не обладающую электрическим зарядом; масса покоя нейтрона составляет 1,00867. Сумма числа протонов и числа нейтронов, содержащихся в ядре атома, называется массовым числом атома (ядра). Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами. Как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин. Рис. 1. Формы электронных облаков (орбиталей)
Рис. 1. Формы электронных облаков (орбиталей)
 ? Составьте электронную формулу атома ванадия, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент?
? Составьте электронную формулу атома ванадия, подчеркните валентные электроны. Распределите электроны этого атома по квантовым ячейкам. К какому электронному семейству относится этот элемент? находится 27 нейтронов (50 – 23 = 27), а
находится 27 нейтронов (50 – 23 = 27), а  - 29 нейтронов (52 – 23 = 29).
- 29 нейтронов (52 – 23 = 29). связей содержит молекула?
связей содержит молекула?

 Рис. 2.3
Рис. 2.3

 Рис. 2.4
Рис. 2.4
 π - тип
Рис. 2.5
π - тип
Рис. 2.5

 ". Происходит оттягивание электронов в сторону F, т.е. образуется диполь.
". Происходит оттягивание электронов в сторону F, т.е. образуется диполь.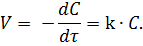
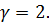
 отсюда V120/ V80 = 24 = 16.
отсюда V120/ V80 = 24 = 16.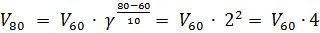 . Отсюда V60/V80 = 1/4, то есть скорость реакции при понижении температуры от 800 до 600С уменьшится в 4 раза, а времени потребуется для проведения данной реакции в 4 раза больше – 64 мин.
. Отсюда V60/V80 = 1/4, то есть скорость реакции при понижении температуры от 800 до 600С уменьшится в 4 раза, а времени потребуется для проведения данной реакции в 4 раза больше – 64 мин.


 44,45 г/моль.
44,45 г/моль. показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора. ).
).
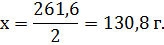

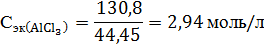

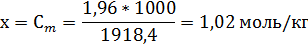
 .
.

 ,
, определяем ионную силу раствора
определяем ионную силу раствора (0,90 * 0,01) = 2,05.
(0,90 * 0,01) = 2,05.
 - константа диссоциации NH4ОН.
- константа диссоциации NH4ОН.




