Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Корригирующее воздействие – изменение интенсивности деятельности органов или всего организма.Содержание книги
Поиск на нашем сайте
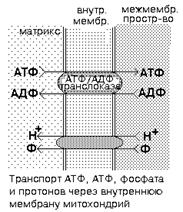
Известно, что через мембрану митохондрии могут свободно проникать только небольшие незаряженные молекулы, а также гидрофобные молекулы. Энергия, которая выделяется при переносе электронов по цепи МтО, приводит к переносу протонов (Н+) из матрикса митохондрии в межмембранное пространство. Поэтому на внутренней мембране митохондрий образуется градиент концентраций протонов: в межмембранном пространстве Н+ становится много, а в матриксе остается мало. Образуется разность потенциалов 0.14V - наружная часть мембраны заряжена положительно, а внутренняя - отрицательно. Накопившиеся в межмембранном пространстве Н+ стремятся выйти обратно в матрикс по градиенту их концентраций, но митохондриальная мембрана для них непроницаема. Единственный обратный путь в матрикс для протонов - через протонный канал фермента АТФ-синтетазы, которая встроена (built-in) во внутреннюю мембрану митохондрий. При движении протонов по этому каналу в матрикс их энергия используется АТФ-синтазой для синтеза АТФ. Синтезируется АТФ в матриксе митохондрий.
После синтеза АТФ переносится в цитоплазму путем облегчённой диффузии по градиенту концентраций, поскольку основные процессы, в которых АТФ потребляется, протекают в цитоплазме. Как происходит транспорт АТФ из митохондрий в цитоплазму? Для этого используется специфический для АТФ транспортный белок - АТФ/АДФ-транслоказа. Это интегральный белок, локализован во внутренней мембране митохондрий.
Во внутренней мембране митохондрий есть белок-переносчик - АТФ/АТФ-транслоказа, который имеет 2 центра связывания: со стороны матрикса для АТФ, снаружи - для АДФ. При изменении конформации АТФ/АДФ-транслоказы АДФ переносится в матрикс, а АТФ - в межмембранное пространство, а затем - в цитоплазму, где используется. Для образования АТФ в матрикс всё время должен поступать неорганический фосфат (Ф). Для этого во внутренней мембране митохондрий есть транспортная система, которая обеспечивает перенос фосфата в матрикс сопряженно с переносом Н+. Это белок-переносчик, который имеет 2 центра связывания: для Ф и Н+. Ф и Н+ вместе переносятся из межмембранного пространства в матрикс. Известны некоторые вещества, которые способны разобщать процессы окисления и фосфорилирования, приводя тем самым к уменьшению коэффициента р/о. К ним относятся йодсодержащие гормоны щитовидной железы (тироксин, трийодтиронин), а также некоторые ксенобиотики (например, 2,4-динитрофенол). Такие вещества известны под общим названием «РАЗОБЩАЮЩИЕ ЯДЫ». Как действуют вещества-разобщители окисления и фосфорилирования? Они могут образовывать собственные протонные каналы во внутренней мембране митохондрий. Поэтому часть протонов, вместо того, чтобы идти обратно в матрикс по протонному каналу АТФ-синтетазы, уходит туда по каналам веществ-разобщителей. В результате АТФ образуется меньше, и часть энергии выделяется в виде тепла.
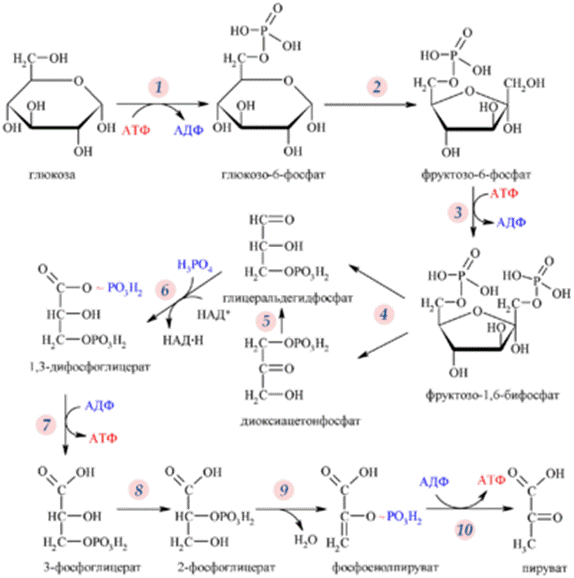
36 Регуляция гликолиза Различают местную и общую регуляцию. Местная регуляция осуществляется путём изменения активности ферментов под действием различных метаболитов внутри клетки. Регуляция гликолиза в целом, сразу для всего организма, происходит под действием гормонов, которые, влияя через молекулы вторичных посредников, изменяют внутриклеточный метаболизм. Важное значение в стимуляции гликолиза принадлежит инсулину. Глюкагон и адреналин являются наиболее значимыми гормональными ингибиторами гликолиза. Инсулин стимулирует гликолиз через: активацию гексокиназной реакции; стимуляцию фосфофруктокиназы; стимуляцию пируваткиназы. Также на гликолиз влияют и другие гормоны. Например, соматотропин ингибирует ферменты гликолиза, а тиреоидные гормоны являются стимуляторами. Регуляция гликолиза осуществляется через несколько ключевых этапов. Реакции, катализируемые гексокиназой (1), фосфофруктокиназой (3) и пируваткиназой (10) отличаются существенным уменьшением свободной энергии и являются практически необратимыми, что позволяет им быть эффективными точками регуляции гликолиза.
Значение
Гликолиз — катаболический путь исключительной важности. Он обеспечивает энергией клеточные реакции, в том числе и синтез белка. Промежуточные продукты гликолиза используются при синтезе жиров. Пируват также может быть использован для синтеза аланина, аспартата и других соединений. Благодаря гликолизу производительность митохондрий и доступность кислорода не ограничивают мощность мышц при кратковременных предельных нагрузках.
38. Окислительное декарбоксилирование пирувата, механизм и биологическая роль.
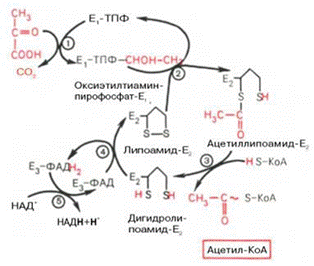
Окисление пирувата до ацетил-КоА происходит при участии ряда ферментов и коферментов, объединенных структурно в мультиферментную систему, получившую название «пируватдегидрогеназный комплекс». На I стадии этого процесса пируват теряет свою карбоксильную группу в результате взаимодействия с тиаминпирофосфатом (ТПФ) в составе активного центра фермента пируватдегидрогеназы (E1). На II стадии оксиэтильная группа комплекса E1–ТПФ–СНОН–СН3 окисляется с образованием ацетильной группы, которая одновременно переносится на амид липоевой кислоты (кофермент), связанной с ферментом дигидроли-поилацетилтрансферазой (Е2). Этот фермент катализирует III стадию – перенос ацетильной группы на коэнзим КоА (HS-KoA) с образованием конечного продукта ацетил-КоА, который является высокоэнергетическим (макроэргическим) соединением. На IV стадии регенерируется окисленная форма липоамида из восстановленного комплекса дигидролипоамид–Е2. При участии фермента дигидролипоилдегидрогеназы (Е3) осуществляется перенос атомов водорода от восстановленных сульфгидрильных групп дигидролипоамида на ФАД, который выполняет роль простетической группы данного фермента и прочно с ним связан. На V стадии восстановленный ФАДН2 дигидро-липоилдегидрогеназы передает водород на кофермент НАД с образованием НАДН + Н+. Процесс окислительного декарбоксилирования пирувата происходит в матриксе митохондрий. В нем принимают участие (в составе сложного мультиферментного комплекса) 3 фермента (пируватдегидрогеназа, ди-гидролипоилацетилтрансфераза, дигидролипоилдегидрогеназа) и 5 кофер-ментов (ТПФ, амид липоевой кислоты, коэнзим А, ФАД и НАД), из которых три относительно прочно связаны с ферментами (ТПФ-E1, ли-поамид-Е2 и ФАД-Е3), а два – легко диссоциируют (HS-KoA и НАД)
Е1 - пируватдегидрогеназа; Е2 - ди-гидролипоилацетилтрансфсраза; Е3 -дигидролипоилдегидрогеназа; цифры в кружках обозначают стадии процесса.
Суммарную реакцию, катализируемую пируватдегидрогеназным комплексом, можно представить следующим образом: Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2.
Реакция сопровождается значительным уменьшением стандартной свободной энергии и практически необратима. Образовавшийся в процессе окислительного декарбоксилирования аце-тил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбо-ксилирование пирувата, происходит в митохондриях клеток.
39. Цикл трикарбоновых кислот, химизм, энергетический эффект, внутриклеточная локализация и регуляция.
Ци́кл трикарбо́новых кисло́т (цикл Кре́бса, цитра́тный цикл) — центральная часть общего пути катаболизма, циклический биохимический аэробный процесс, в ходе которого происходит превращение двух- и трёхуглеродных соединений, образующихся как промежуточные продукты в живых организмах при распаде углеводов, жиров и белков, до CO2. При этом освобождённый водород направляется в цепь тканевого дыхания, где в дальнейшем окисляется до воды, принимая непосредственное участие в синтезе универсального источника энергии — АТФ. Цикл Кребса — это ключевой этап дыхания всех клеток, использующих кислород, центр пересечения множества метаболических путей в организме. Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций. Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. У прокариот реакции цикла протекают в цитоплазме. Цикл Кребса регулируется «по механизму отрицательной обратной связи», при наличии большого количества субстратов (ацетил-КоА, оксалоацетат), цикл активно работает, а при избытке продуктов реакции (NADH, ATP) тормозится. Регуляция осуществляется и при помощи гормонов, основным источником ацетил-КоА является глюкоза, поэтому гормоны, способствующие аэробному распаду глюкозы, способствуют работе цикла Кребса. Такими гормонами являются: инсулин и адреналин. Глюкагон стимулирует синтез глюкозы и ингибирует реакции цикла Кребса. Как правило работа цикла Кребса не прерывается за счёт анаплеротических реакций, которые пополняют цикл субстратами: Пируват + СО2 + АТФ = Оксалоацетат (субстрат Цикла Кребса) + АДФ + Фн. Общее уравнение одного оборота цикла Кребса: Ацетил-КоА → 2CO2 + КоА + 8e− Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окисления двух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим. Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
40. Распад гликогена (гликогенолиз). Химизм, энергетический эффект окисления глюкозы, связь с гликолизом
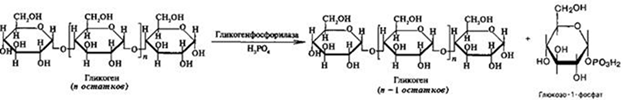
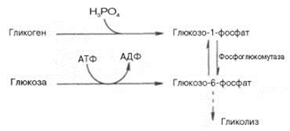
Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Гликогенолиз может осуществляться либо путем гидролиза (под действием ферментов амилаз), либо фосфоролиза. Фосфоролиз является основным путем распада гликогена, его катализирует фермент гликогенфосфорилаза, относящийся к классу трансфераз. Фосфорилазы переводят полисахариды из запасной формы в метаболически активную. Гликогенфосфорилаза отщепляет остатки глюкозы от полигликозидной цепи гликогена и переносит их на молекулу фосфорной кислоты с образованием глюкозо-1-фосфата:
Глюкозо-1-фосфат быстро изомеризуется, превращаясь в глюкозо-6-фосфат под действием фосфоглюкомутазы:
На данном этапе заканчивается распад гликогена в мышечной ткани. В печени из глюкозо-6-фосфата происходит образование свободной глюкозы под влиянием глюкозо-6-фосфатазы. Данный фермент катализирует гидролитическое отщепление фосфата. Вовлечение D-глюкозных единиц гликогена в процесс гликолиза происходит при участии 2 ферментов – фосфорилазы а и фосфо-глюкомутазы. Образовавшийся в результате фосфоглюкомутазной реакции глюкозо-6-фосфат может включаться в процесс гликолиза. После образования глюкозо-6-фосфата дальнейшие пути гликолиза и гликогенолиза полностью совпадают:
44. Холестерин и его производные: строение, свойства и функции.
ХОЛЕСТЕРИН- органическое соединение, природный жирный (липофильный) спирт, содержащийся в клеточных мембранах всех живых организмов за исключением безъядерных (прокариоты). Нерастворим в воде, растворим в жирах и органических растворителях. Около 80 % холестерина вырабатывается самим организмом (печенью, кишечником, почками, надпочечниками, половыми железами), остальные 20 % поступают с пищей[1]. В организме находится 80 % свободного и 20 % связанного холестерина. Холестерин обеспечивает стабильность клеточных мембран в широком интервале температур. СИНТЕЗ: Холестерин может образовываться в животном организме и поступать в него с пищей. В настоящее время установлена следующая цепь биосинтеза холестерина (основа биосинтеза и других стероидов), включающая в себя несколько ступеней. -Превращение трёх молекул активного ацетата в пятиуглеродный мевалонат. Происходит в ГЭПР. -Превращение мевалоната в активный изопреноид — изопентенилпирофосфат. -Образование тридцатиуглеродного изопреноида сквалена из шести молекул изопентенилдифосфата. -Циклизация сквалена в ланостерин. -Последующее превращение ланостерина в холестерин. Функции. 1) структурный компонент клеточных мембран, 2) образует в организме человека желчные кислоты, витамин Д3, выработка надпочечниками различных стероидных гормонов, включая кортизол, альдостерон, женских половых гормонов эстрогенов и прогестерона, мужского полового гормона тестостерона 3) играет важную роль в деятельности синапсов головного мозга и иммунной системы, включая защиту от рака. Свойства: -не растворим в воде -растворим в спиртах и других органических растворителях, а так же в растительных и животных жирах. - способен образовывать сложные эфиры при реакции с жирными кислотами
45. Жирные кислоты: строение, свойства и функции.
ЖИРНЫЕ КИСЛОТЫ - большая группа органических соединений, представляющих собой алифатические карбоновые кислоты, многие из которых входят в состав липидов животных и растений.
ФУНКЦИИ: -энергетическая -пластическая -строение биологических мембран - способствуют синтезу простагландинов, которые наделены достаточно сильным противовоспалительным эффектом -расширяют кровеносные сосуды, снижают риск развития тромбов в кровеносных сосудах, питают сердечную мышцу, а также препятствовуют возникновению атеросклероза..
46. Простагландины, их биологическая роль.
ПРОСТАГЛАНДИНЫ, биологически активные вещества, обнаруженные в тканях и органах большинства животных и человека, в нек-рых растениях. По химич. природе — жирные кислоты, имеющие скелет из 20 атомов углерода и содержащие циклопентановое кольцо. Важнейшее физиол. действие— способность вызывать сокращение гладких мышц, особенно мышц матки и яйцеводов, а также мышц пищеварит. и дыхат. систем, кровеносных сосудов. Кроме того, снижают способность тромбоцитов к агрегации, выделение желудочного сока и его кислотность, оказывают противозачаточный эффекты. П. действуют, в отличие от классич. гормонов, вблизи места секреции. Высокая и разнообразная физиол. активность П. осуществляется посредством регуляции синтеза цАМФ (цГМФ), к-рый влияет на синтез белков, П. участвуют в регуляции клеточного ответа на нейрогуморальные воздействия. Связь П. с циклич. нуклеотидами и гормонами указывает на принципиальную возможность посредством П. воздействовать на разл. процессы в организме. П. применяются в медицине.
|
|||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 535; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.148.144.139 (0.011 с.) |

 35 ТЕОРИЯ СОПРЯЖЕНИЯ ОКИСЛЕНИЯ И ФОСФОРИЛИРОВАНИЯ ПИТЕРА МИТЧЕЛЛА.
35 ТЕОРИЯ СОПРЯЖЕНИЯ ОКИСЛЕНИЯ И ФОСФОРИЛИРОВАНИЯ ПИТЕРА МИТЧЕЛЛА.