
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение концентрации кислорода иодометрическим способом
Растворенный в воде кислород оказывает большое влияние на физико-химический режим водоемов, их самоочищение, обуславливает жизнедеятельность водных организмов. Концентрация кислорода в водах колеблется от 0 до 14,7 мг/л в связи с давлением, температурой, содержанием примесей. У большинства рыб процессы жизнедеятельности протекают нормально при содержании кислорода не ниже 3,0-4,5 мг/л, а лососевых, осетровых, сиговых - не ниже 6,0…7,0 мг/л. По санитарным требованиям во все сезоны содержание кислорода в воде должно быть не менее 4,0 мг/л. Концентрация кислорода в воде - показатель качества воды, индикатор ее загрязнения. Уменьшение показателя свидетельствует о наличии в воде легкоокисляемых органических веществ и других загрязнителей.
Оборудование: калиброванная емкость 250-300 мл -1 шт; пипетка на 1 мл - 2- шт; пипетка на 5 мл - 1 шт; бюретка ка 15-25 мл - 1 шт; колбы конические плоскодонные на 250 мл - 2 шт; стаканы химические на 150 мл - 2 шт; стакан химический на 50 мл - 1 шт; кювета - 1 шт; резервуар для исследуемой воды -1 шт; термометр -1 шт; резиновая трубка -1 шт. Реактивы: 1.Щелочной раствор йодистого калия (75г КIрастворяют в 50 мл дистиллированной воды и смешивают с 350г КОН или 250 г NаОН, растворенными в 150-200 мл дистиллированной воды. Общий обьем воды доводят до 500 мл). 2. Раствор хлористого марганца (210 г МnС12-4Н2О растворяют в дистиллированной воде с последующим доведением объема воды до 500 мл. Вместо МnСl2 можно использовать (240 г МпSО4- 4Н2О). 3. 0,02Н раствор тиосульфата (5,0 г Na2S2О3-5Н2О растворяют в 1 л прокипяченной дистиллированной воды). 4. Раствор (2:1) соляной кислоты (2 объема химически чистой концентрированной НСl (удельный вес 1,19) и 1 объем дистиллированной воды). Вместо раствора НСl (2:1) можно Применять раствор Н2S04(1:4). 5. Раствор крахмала (0,1 г рисового или пшеничного крахмала перемешивают на холоде с 20 мл дистиллированной воды и нагревают в пробирке до кипячения. Принцип метода. 1. Фиксация кислорода солями марганца в щелочной среде
2. Выделение йода в кислой среде:
I+2SO 2I+SO 1 мл точно 1.0Н раствора тиосульфата соответствуете 8 мг кислорода. Если на титрование израсходовано n мл раствора тиосульфата, то 8n выражает содержание кислорода в данном объеме воды.
Ход определения 1. Наполнить водой колиброванную склянку так, чтобы вода переливалась через край. 2. Ввести в склянку с водой пипеткой 1 мл раствора хлористого марганца. 3. Ввести в склянку с водой с помощью другой пипетки 1 мл раствора Кl + NaОН. При этом в склянке образуется муть. 4. Закрыть склянку притертой пробкой так, чтобы в склянке не оставалось пузырьков воздуха. Содержимое перемешать и оставить на 15…20 мин для осаждения осадка. 5. После образования осадка склянку осторожно открыть и пипеткой на 5 мл внести 5 мл раствора кислоты.
6.Склянку вновь закрыть и жидкость перемешать до полного растворения осадка. При этом раствор окрасится в желтый цвет. 7. Раствор из склянки количественно перенести в коническую колбу (перелить, ополоснуть склянку 2-3 раза дистиллированной водой, которую также слить в коническую колбу). 8. Для индикации в коническую колбу добавить раствор крахмала (цвет жидкости станет синим). 9. Провести титрование раствора тиосульфата. 10. Рассчитать результаты:
K - содержание растворенного кислорода; n - количество раствора тиосульфата, израсходованного на титрование, мл; Н - нормальность раствора тиосульфата; V - объем склянки, в которой фиксировалась проба воды, мл; 2 мл - объем воды, вылившейся при введении 2 мл реактивов. Содержание кислорода, полученное при анализе, можно сравнить с его нормальной концентрацией при данной температуре и давлении 760 мм.рт.ст. по формуле: (К-100) / Кп К - содержание кислорода (мг/л) в пробе воды; Кп - нормальное количество кислорода при данной температуре и давлении 760 мм.рт.ст. 3. Очистка сточных вод производится с целью удаления из них или разрушения, нейтрализации вредных веществ. С учетом характеристики сточных вод методы очистки можно раз-, делить на три группы: очистка от суспендированных или эмульгированных примесей; очистка от растворенных примесей; устранение или уничтожение. В общем случае водоочистные сооружения состоят их установок для механической очистки, для химической очистки, для биологической очистки и обеззараживания сточных вод.
Наиболее распространены для механической очистки: решетки, песколовки, отстойники, нефте- и маслоловушки. Обработка осадков сточных вод в метантенках, на иловых площадках, в двухъярусных отстойниках и др. Для биологической очистки используют сооружения естественной биологической очистки (поля фильтрации, поля орошения, биологические пруды) и искусственной биоочистки (биофильтры, аэрофильтры, аэротенки). Обеззараживание сточных вод производится хлорированием, воздействием электротока и др. Для доочистки вод после биологической очистки используют биологические пруды, песчаные фильтры. Перед биологической очисткой воды, содержащие растворенные неорганические примеси, должны пройти хи
Таблица 6 Классификация основных методов очистки сточных вод
мическую или физико-химическую очистку. В связи с этим применяются специальные приемы локальной очистки: флотация, коагуляция, адсорбция, электролиз. Основные методы очистки сточной воды в зависимости от вида загрязнений приведены в табл. 6. Задание: по наличию в сточных водах загрязняющих веществ различных групп, задаваемых преподавателем, предложить общую схему очистных устройств и методы очистки воды. Материалы и оборудование: таблицы, схемы, реактивы. Литература 1. ГОСТ 2874. 2. Карюхина Г.Х., Чурбансва И.Н. Химия воды и микробиология. - М.: 3. Охрана окружающей среды: Учебн. для технол. спец. вузов. -М.:
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 152; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.190.207.122 (0.008 с.) |
 2Мn" + 40Н1 2Мn(ОH)2
2Мn" + 40Н1 2Мn(ОH)2 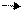
 2Мn(ОН)2 + Н2О + О 2Мn(ОН)3
2Мn(ОН)2 + Н2О + О 2Мn(ОН)3 2Мn(ОН)3 + 2KI + 6Н1 2Мn" + 2К'+ 6Н2О + I2 3.Титрование йода тиосульфатом
2Мn(ОН)3 + 2KI + 6Н1 2Мn" + 2К'+ 6Н2О + I2 3.Титрование йода тиосульфатом , мг/л
, мг/л


