Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетика химических процессов.Содержание книги
Поиск на нашем сайте
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Определите массу растворённого вещества: а)в 250 г 8%-ного раствора K2CO3,. б) в 500 мл 5%-ного раствора азотной кислоты с плотностью раствора 1,03г/мл. 2. Вычислите массовую долю растворённых веществ для растворов, содержащих: а)1 моль аммиака в 3 моль воды; б) 100г серной кислоты в 10 моль воды. 3. Вычислите массовую долю безводной соли для раствора, приготовленного из 14,3г Na2CO3· 10H2O и 120г воды. 4. Вычислите массовую долю безводной соли в растворе, полученном растворением 0,01 моль кристаллогидрата Al2(SO4)3 · 18 H2O в 1,0 моль воды. 5. Какую массу хлорида калия следует добавить к 450 г 8%-ного раствора той же соли для получения 12%-ного раствора? 6. Какую массу воды следует добавить к 1кг 40;%-ного раствора серной кислоты для получения 25%-ного раствора? 7. Из 750 кг 48%-ного раствора серной кислоты выпарили 300 кг воды. Определите массовую долю серной кислоты в полученном растворе. 8. Какую массу 32%-ного раствора азотной кислоты следует добавить к 600 г 80%-ного раствора той же кислоты для получения 64%-ного раствора? 9. Определите массу 8%-ного раствора гидроксида натрия, которая потребуется для нейтрализации 292 г 20%-ного раствора соляной кислоты. 10. Какой объём 5,5%-ного раствора азотной кислоты(плотность равна 1,03г/мл) требуется для нейтрализации 60 мл 12%-ного раствора КОН (плотность равна 1,1г/мл)? 11. К 700 мл 84,5%-ного раствора серной кислоты(плотность 1,78г/мл) добавлено 1200 мл 42%-ного раствора гидроксида натрия (плотность 1,45 г/мл). Какой объём 35%-ного раствора гидроксида калия (плотность 1,35 г/мл) потребуется добавить к раствору для достижения нейтральной реакции? 12. Определите массу растворённого вещества, содержащегося в 1л следующих растворов: а)0,1н H2SO4(фактор эквивалентности ½); б) 0,5н Na2CO3 (фактор эквивалентности ½); в) 0,3н H3PO4 (фактор эквивалентности1/3). 13. Какой объём раствора 0,1н H2SO4 (фактор эквивалентности ½) можно приготовить из 70 мл 50%-ного раствора этой кислоты (плотность 1,40 г/мл)? 14. Вычислите молярную и нормальную концентрации следующих растворов: а) 40%-ный раствор гидроксида натрия(плотность 1,43 г/мл); б)20%-ный раствор соляной кислоты(плотность 1,1 г/мл);в) 18%-ный раствор аммиака(плотность0,932 г/мл) 15. Какая масса Na2CO3 требуется для взаимодействия с 600 мл 0,5н HNO3? 16. Какая масса BaCl2 · 2H2O потребуется для взаимодействия с 750 мл 0,12н H2SO4 (фактор эквивалентности ½)? 17. Определите нормальную концентрацию 0,1 М H3PO4, используемого для получения гидрофосфатов. 18. В плазме крови содержится 152 ммоль/л ионов натрия. Считая, что ионы натрия находятся только в виде хлорида натрия, вычислите массовую долю хлорида натрия в плазме крови, Плотность плазмы крови 1,03 г/мл. 19.Для раствора сахарозы с концентрацией 0,1 моль/л рассчитайте массовую долю сахарозы (в %,мг%, мкг%), моляльность b, молярную долю χ. ρ (р-ра) = 1,04 г/мл. 20.Массовая доля железа в крови в расчёте на элемент составляет 50 мг%. Рассчитайте массу железа в расчёте на элемент, содержащегося в 5,0 кг крови.
ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ РАВНОВЕСИЕ Пример 1. Рассчитайте стандартную энтальпию реакции 2SO2(г) + O2(г) = 2SO3(г) ΔHfo (кДж/моль) -297 0 -396 Решение: Δ Нор-ции = Σ ΔНопрод - Σ ΔНоисх = 2(-396) - [2(-297) + 1(0)] = -198 кДж Пример 2. Рассчитайте стандартную энтальпию образования этанола, если стандартные энтальпии сгорания углерода, водорода и этанола соответственно равны (в кДж/моль): -393,5; -285,8; -1366,9. Решение: Уравнение реакции, соответствующей энтальпии образования этанола- 2С + 3Н2 + 0,5О2 = С2Н5ОН Δ Нор-ции = ΔHfo(С2Н5ОН) = Σ ΔНосг. исх - Σ ΔНосг.эт. = 2(-393,5) + 3(-285,8) - (-1366,9) = -277,6 кДж/моль Пример 4. Пользуясь значениями ΔGof отдельных соединений, вычислите ΔGo реакции SO2(г) + NO2(г) = SO3(г) + NO(г) и определите её направление в стандартных условиях. Решение: ΔGo р-ции = [ΔGof(SO3) + ΔGof(NO)] - [ΔGof(SO2) + ΔGof(NO2)] = (-370,4 + 86,6) - (-300,4 + 51,8) = -35,2 кДж Величина ΔGo р-ции < О, значит реакция протекает в сторону образования SO3 и NO. Пример 5. Константа равновесия системы H2(г) + I2(г) = 2HI(г) при некоторой температуре равна 40. Определите равновесные концентрации реагирующих веществ, если исходные концентрации этих веществ составляют (в моль/л): [I2] = 0,01; [H2] = 0,03. Решение: Пусть уменьшение концентрации водорода и иода к моменту равновесия будет x. Тогда равновесные концентрации составят(в моль/л): [I2] =(0,01 - x); [H2] = (0,03 – x); [HI] = 2x.
Решение этого уравнения даёт два корня:x1= 0,0349 моль/л и x2= 0,0096моль/л Так как исходная концентрация иода равна 0,01 моль/л, уменьшение концентрации не может превышать эту величину и, следовательно, решением задачи будет x2= 0,0096моль/л.Тогда равновесные концентрации реагирующих веществ будут равны(в моль/л): [[H2]р = 0,01 – 0,0096 = 0,0004; [I2]р = 0,03 – 0,0096 = 0,0204; [HI]р = 2 0,0096 = 0,0192. Пример 6. Химическое равновесие реакции СО2(г) + Н2(г) = СО(г)+Н2О(г) Установилось при следующих концентрациях реагирующих веществ(моль/л): [CO2] = 7,0; [H2] = 5,0; [CO] = 10; [H2O] = 14. Равновесие системы было нарушено вследствие уменьшения концентрации Н2О до 11 моль/л Рассчитайте равновесные концентрации реагирующих веществ после сдвига равновесия. Решение. Уменьшение концентрации Н2О показывает, что равновесие сместилось в сторону прямой реакции. Таким образом, концентрация СО2 и Н2 уменьшилась, а концентрация СО и Н2О увеличилась. Пусть изменение концентрации реагирующих веществ будет х моль/л.Тогда новые равновесные концентрации после смещения равновесия будут равны (в моль/л): [CO2] = (7-x); [H2] = (5-x); [CO] = (10 + x); [H2O] = (11 + x). Константа равновесия данной реакции равна: Кс = [CO] [H2O] / [CO2][H2] = 10 · 14 / 7 · 5 = 4,0. 4 = (10 +x) (11 +x) / (7 – x)(5 – x) = (110 + 21x + x2) / (35 – 12x + x2). x2 – 23x +10 = 0; x1 = 22,56; x2 = 0,44. Реальное значение имеет второй корень. Следовательно, х = 0,44моль/л. Новые равновесные концентрации: [CO2] = 7,0 – 0,44 = 6,56 моль/л; [H2] = 5,0 – 0,44 = 4,56 моль/л; [CO] = 10,0 + 0,44 = 10,44 моль/л; [H2O] = 11,0 + 0,44 = 11,44 моль/л. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. При образовании 1,70г аммиака выделилось 4620Дж тепла. Определите стандартную теплоту образования аммиака. 2. Рассчитайте энтальпию реакции (при стандартных условиях:): SO2(г)+ 2H2S(г)= 3S(кр).+ 2Н2О(ж),.если стандартные энтальпии образования SO2(г),H2S(г) и.H2О(ж) равны соответственно(в кДж/моль):-296,9;-21,0;-285,8. 4 Напишите выражения констант химического равновесия Кс следующих обратимых реакций (V = const. Т = const): а)N2(г) + 3H2(г) = 2NH3(г) в) 3Fe2O3(тв) + H2(г) = 2Fe3O4(тв) + H2Oг) б)C(тв)+ CO2(г) =2CO(г) г)2NO2(г) =2NO(г) +O2(г) Как повлияет повышение давления на состояние равновесия в этих системах? 5. В каком направлении смещено равновесие в реакции Н2(г)+ J2(г)= 2HJ(г), если при некоторой температуре константа равновесия Кр>1? 6. С ростом температуры равновесие в реакции N2(г) + O2(г)= 2NO(г) сдвигаетсяв сторону прямой реакции. Сделайте вывод о знаке энтальпии реакции. 7. При некоторой температуре константа равновесия реакции А=В равна 4. Как изменится константа равновесия реакции, если концентрацию вещества А увеличить в 10 раз? 8. Сформулируйте принцип смещения химического равновесия. 9. Приведите примеры параметров, которые: а)смещают положение равновесия,изменяя величину константы равновесия; б) смещают положение равновесия, не изменяя величины константы равновесия. 10. Как повлияет понижение температуры на величину константы равновесия реакции N2(г)+ ЗН2(г)=2 NH3(г),если стандартная энтальпия реакции -92,4кДж. 11. Исходные концентрации СО и Н2О соответственно равны 0,08 моль/л. Вычислите равновесные концентрации СО, Н2О и Н2 в системе СО(г)+ Н20(г)= СО2(г)+ Н2(г),если равновесная концентрация СО оказалась равной 0,05моль/л. 12. Равновесие реакции 4HCl(г) + 02(г)= 2H2O(г)+ 2Cl2(г) установилось при следующих концентрациях реагирующих веществ(в моль/л): /Н2О/ = /Cl2 / = 0.4; /HCl/ = /О2/ = 0.2. Вычислите константу равновесия Кс и исходную концентрацию кислорода в реакционной смеси. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Рассчитайте [Н3О +], [ОН -] и рН: а) 0,01 М. раствора НС1,б) раствора Н2SО4 с концентрацией С[0,5Н2SO4 ] = 0,01 моль/л; в) 0,2 М раствора КОН; г ) раствора Ва(ОН)2. с концентрацией С[0,5 Ва(ОН)2]= 1 • 10-3моль/л. 2. Рассчитайте молярную концентрацию: а) раствора HBr, если рН раствора равно 1,65. б) раствора NaOH, если рН раствора равно11,26. . 3. Рассчитайте рН раствора, содержащего в 2,5л одновременно 0,0032 моль HNO3 и 0,0083 моль H2SO4. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Напишите уравнения протолитического равновесия и укажите сопряженные кислотно-основные пары в водных растворах: а) азотистой кислоты Ко (HNO2) = 5,1×10-4;б) аммиака Кo(NH3××H2O)= 1,76×10-5; в) угольной кислоты Ко (Н2СО3 )= 4,5 • 10-7 Ко (НСО3-) = 4,8×10-11 От каких факторов зависит стандартная константа равновесия Ко ? 2. Напишите уравнения реакций автопротолиза воды и безводной уксусной кислоты. 3. Как связаны константы кислотности и основности сопряженной пары NH4 + - NH3? Приведите вывод формулы. 4. Степень диссоциации(протолиза) уксусной кислоты равна 1,32 • 10-2,Ко= 1,75 • 10-5. Определите концентрацию кислоты, концентрацию ацетат-иона и рН раствора. Коэффициенты активностей ионов принять равными 1. 5. Рассчитайте рН раствора, полученного при смешивании 10 мл 0,1 М HNO2 и 20 мл 0,05 М КОН, если плотности растворов равны 1,00 г/мл [К о(HNO2).=5,1×10-4]. Коэффициенты активностей ионов принять равными 1. БУФЕРНЫЕ РАСТВОРЫ Буферные растворы – сложные протолитические системы, способные сохранять примерное постоянство рН при добавлении в такую систему небольших количеств сильных кислот или щелочей. Буферные растворы широко распространены в химической и биохимической практике. Все буферные системы содержат минимум два вещества, кроме воды. Эти вещества - сопряженная слабая кислота и соответствующее ей сопряженное основание - образуют в водном растворе протолитическую буферную систему. Виды основных буферных водных растворов: - слабая кислота и ее соль (СH3COOH- CH3COONa) - слабое основание и его соль (NH3 – NH4Cl) -средняя и кислая соль (Na2CO3 – NaHCO3) - две кислых соли (NaH2PO4 – Na2HPO4) - аминокислотные и белковые системы (гемоглобин - оксигемоглобин) Компоненты буферной системы, представляющие собой сопряженную кислотно-основную пару, реагируют с водой, создавая буферные равновесия. В общем виде, если НА – слабая кислота, а А-- анион этой кислоты (т.е. анионное основание), то буферные равновесия запишутся в следующем виде: НА +Н2О ↔ А- + Н3О+ А- + Н2О ↔ НА + ОН-. Оба этих равновесия по принципу Ле Шателье сильно смещены влево, поэтому равновесные концентрации сопряженных кислоты и основания практически равны исходным концентрациям. Так как буферная система образована одной и той же кислотно-основной парой, то из выражения для константы кислотности можно вывести уравнения для расчета рН в буферных растворах, которое называется уравнением Гендерсона-Хассельбальха: a (А-) pH = pKa + lg----------- а (НА), где а – активности соответствующих компонентов буферной системы. Буферное действие Механизм буферного действия заключается в том, что частицы сопряженного основания реагируют с ионом H3O+, образуя сопряженную слабую кислоту. В общем виде: H3O+ + A- = H2O + HA Например, в случае аммиачной буферной системы имеем: H3O++ NH3 = NH4+ + H2O Ионы же OH- взаимодействуют с сопряженной кислотой, превращая ее в сопряженное слабое основание. В общем случае: HA + OH- = H2O + A- В случае той же аммиачной буферной системы: NH4+ + OH- = NH3 + H2O
Границы буферного действия Границы буферного действия определяются, исходя из значения рК данной буферной системы и отличаются от него в обе стороны не более чем на единицу. pH = pK ± 1 Буферная емкость Буферная емкость является количественной характеристикой буферного раствора. Определяются буферная емкость по кислоте (Вк) и буферная емкость по щелочи (Вщ). Буферная емкость определяется как количество вещества H3O + (или OH-) которое надо добавить к 1л данной буферной системы, чтобы его рН изменился на 1. Напомнить студентам, что при добавлении сильной кислоты к буферной системе рН немного уменьшается, а при добавлении щелочи немного увеличивается. n(H3O+)добавл. n(ОH-)добавл. Bк = ------------------- Вщ = ------------------- Vбуф.р-ра . |ΔpH| Vбуф.р-ра . |ΔpH|
Пример1. Рассмотреть буферные равновесия в буферной системе NH3- NH4Cl
Решение. Соль диссоциирует на ионы практически полностью: NH4Cl = NH4+ + Cl - Ион аммония является слабой катионной кислотой: NH4 + + Н2О ↔ NH3 + Н3О+ (1) Аммиак – нейтральное слабое основание, его протолиз записывается так: NH3 + Н2О ↔ NH4 + + ОН - (2) Уравнения (1) и (2) представляют собой уравнения буферных равновесий. По принципу Ле Шателье равновесие в обоих процессах сильно смещено влево. По этой причине равновесные концентрации аммиака и иона аммония практически равны их начальным концентрациям. Расчет рН в буферных системах производится с помощью уравнения Гендерсона- Хассельбальха. a (сопр.осн-я) pH = pKa + lg----------------- а (сопр. к-ты) Аммиак – нейтральная молекула и для него коэффициент активности равен 1. Тогда для данной системы уравнение приобретает вид: с0(NH3) pH = pKa + lg----------------- c0(NH4+). f(NH4+)
Пример 2 а) Рассчитайте рН ацетатной буферной системы, приготовленной смешением 200мл 0,1м СН3СООН и 200мл 0,1М СН3СООNa. рКа(СН3СООН) = 4,76. б) Рассчитайте рН данной буферной системы после добавления 10мл 1М HCl и буферную ёмкость по кислоте. в) Рассчитайте рН данной буферной системы после добавления 10 мл1М NaOH и буферную ёмкость по щёлочи. Решение: а) рН ацетатной буферной системы равна: рН= 4,76 + lg с(CH3COO-) / c(CH3COOH) Концентрации буферных кислоты и основания равны: c(CH3COO-) = с(СH3COOH) = Рассчитываем рН буферной системы: pН = 4,76 + lg 0,05 / 0,05 = 4,76 б) При добавлении соляной кислоты протекает реакция: CH3COO- + H3O+ = CH3COOH +H2O, 0,02 0,01 0,01 моль В растворе было:n(CH3COO-) = 0,05·0,4 = 0,02 моль. Добавили n(HCl) = 0,01моль. При этом сильная кислота заменяется в эквивалентных количествах на слабую (буферную) кислоту, а буферное основание в эквивалентных количествах уменьшается. (В этом заключается механизм буферного действия). В результате реакции буферного основания осталось: 0,02 –0,01 = 0,01 моль, а буферной кислоты стало: 0,02 + 0,01 = 0,03 моль. Тогда рН = 4,76 + lg n(CH3COO-) / n(CH3COOH) = 4,76 + lg 0,01 / 0,03 = 4,28. ∆pH = 4,76 - 4,28 = 0, 48 Буферная ёмкость по кислоте равна: Bк = в) При добавлении щёлочи в буферную систему протекает реакция: CH3COOH + OH- = CH3COO- + H2O 0,02 0,01 0,01 моль В растворе было: n(CH3COOH) = 0,05·0,4 = 0,02моль. Добавили n(NaOH) = 0,01моль. При этом сильное основание ОН- заменяется в эквивалентных количествах на слабое(буферное основание), а буферная кислота в эквивалентных количествах уменьшается. В результате реакции буферной кислоты осталось: 0,02 –0,01 = 0,01 моль, а буферного основания стало: 0,02 + 0,01 = 0,03 моль. Тогда рН = 4,76 + lg n(CH3COO-) / n(CH3COOH) = 4,76 + lg 0,03 / 0,01 = 5,24. ∆pH = 5,24 – 4,76 = 0,48. Буферная ёмкость по щёлочи равна: Вщ = n(OH-) / V∙ ∆pH = 0,01 / 0,41∙0,48 = 0,05 моль/л. Пример 3. Рассчитайте рН раствора, приготовленного смешением 300мл 0,05М KH2PO4 и 200мл 0,1М Na2HPO4. pKa(H2PO4 - /HPO42-)= 7,2. Решение: рН буферного раствора равно: рН = рКа + lg Определяем ионную силу раствора. KH2PO4 = K+ +H2PO4- Na2HPO4 = 2Na+ + HPO42- 0,05 0,05 0,05 (моль) 0,1 0,2 0,1 (моль) Объём буферного раствора: 300мл + 200мл = 500 мл =0,5л. Концентрации ионов в буферном растворе равны:
c(H2PO4-)= Ионная сила J= 0,5 (0,03·12 + 0,03·12 + 0,08·12 + 0,04·22)= 0,15. По таблице находим коэффициенты активности f ионов. f( H2PO4-) =0,81. f (HPO42-) = 0,41.Рассчитываем рН данного буферного раствора: pH= Пример 4. Какие объёмы 0,2М NH3·H2O и 0,1М NH4Cl необходимо взять для приготовления 200 мл буферного раствора с рН=9,54? pKb(NH3·H2O)=4,76. Ионную силу раствора точно определить заранее нельзя, так как неизвестно количество и концентрация сильного электролита в полученном растворе. Однако можно создать требуемую ионную силу введением инертного электролита типа NaCl, Na2SO4. Для определенности примем ионную силу равную I = 0,1. Решение: Коэффициент активности нейтральных молекул можно принять равными 1. Коэффициент активности иона аммония при данном значении ионной силы равен 0,81.
pН данной буферной системы равно: рН = рКа(NH4+) + lg pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л. c(NH3·H2O) = Подставляем полученные данные в уравнение для рН буферной системы: 9,54 = 9,24 + lg
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
Решение: Коэффициент активности нейтральных молекул можно принять равными 1, а f(NH4+) = 0,81 в соответствии с ионной силой. pН данной буферной системы равно: рН = рКа(NH4+) + lg pKa(NH4+) = 14 – pKb = 14 – 4,76 = 9,24. pH = 9,24 + lg Предположим, что для приготовления буферного раствора взяли x (л) раствора аммиака. Тогда раствора хлорида аммония будет (0,2 – x)л. c(NH3·H2O) = Подставляем полученные данные в уравнение для рН буферной системы: 9,54 = 9,24 + lg
V(NH3·H2O) = 90мл V(NH4Cl) = 110мл
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1. Рассчитайте рН буферного раствора, содержащего 0,01 моль CH3COOH и 0,02 моль CH3cOONa в 500 мл раствора.pKa(CH3COOH) = 4,75. Какие реакции будут протекать при добавлении к этому раствору небольшого количества КОН или HNO3? Объясните механизм буферного действия. 2. Рассчитайте молярное соотношение основания и сопряженной кислоты в буферном растворе, содержащем СН3 СООН и СН3 COONa, рН которого равен 4,86 [Ка(СН3СООН) =1,76 • 10-5 ].Какова буферная ёмкость этого раствора по кислоте ПРОИЗВЕДЕНИЕ РАСТВОРИМОСТИ Пример1. Рассчитайте растворимость фосфата бария, если ПР(Ba3(PO4)2) = 6,3·10-39. Решение: Ba3(PO4)2 = 3Ba2+ + 2PO43- Если s- растворимость фосфата бария, то: [Ba2+]= 3s, [PO43-] = 2s. ПР = (3s)3 (2s)2 = 108s5 = 6,3 ·10-39.
Отсюда s = √ 6,3 ·10-39 / 108 = 9 10-9 моль/л. ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ 1.Вычислите произведение растворимости хромата серебра, если в 500 мл воды при 25°С растворяются 0,011 г Аg2 СгО4. 2. Произведение растворимости АgС1 равно 1,8∙10-10 Вычислите растворимость соли (моль/л и г/л) в воде и 0,01М КС1. Коэффициенты активностей ионов принять равными 1. СТРОЕНИЕ АТОМА.
Атомная орбиталь (АО) определяется как область пространства вблизи атомного ядра, вероятность нахождения электрона в которой максимальна и составляет 90-95%. Данная область имеет определенную форму, размеры и энергию, которые определяются набором 3-х т.н. квантовых чисел (n, l, ml), вытекающих из решения волнового уравнения. Главное квантовое число n – определяет размеры и потенциальную энергию АО. это число принимает значения 1, 2, 3… Совокупность АО с постоянным n определяет энергетический уровень (ЭУ). Орбитальное квантовое число l - «ответственно» за форму АО. Орбитальное квантовое число при n=const последовательно принимает целочисленнеые значения от 0 до (n-1). Орбитальному числу l = 0 отвечают s–орбитали, числу l =1- р-орбитали, числу l =2 - d-орбитали. Совокупность АО с постоянным значением l при данном n образует энергетический подуровень (ЭПУ). Магнитное квантовое число ml – определяет ориентацию орбитали в пространстве. Магнитное квантовое число при n,l =const принимает целочисленные значения от (– l) от – до (+ l),включая значение 0. Так, для p - энергетического подуровня (l=1) значения ml следующие: -1, 0, +1. Таким образом, можно определить число АО на данном энергетическом подуровне, которое равно 2 l + 1. Тогда, на s–ЭПУ - 1 АО, на p–ЭПУ – 3 АО, а на d–ЭПУ -5 АО. УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
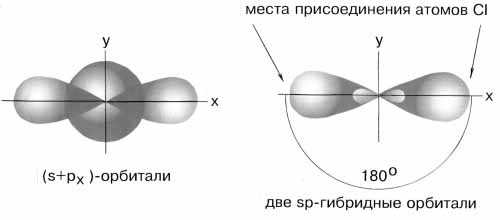
1. Напишите электронные формулы для атомов натрия, алюминия, кремния, фосфора, серы и хлора. 2. Напишите электронные формулы для атомов хрома, железа, меди, цинка. 3. Напишите электронные формулы для ионов K+, Al3+,S2-, Cl-, Cr3+,Fe2+. 4. Как изменяется с ростом порядкового номера значение первого потенциала ионизации у элементов второго периода? 5. На каком основании Cr и S,C1 и Мп расположены в одной группе периодической системы Д.И.Менделеева? Почему их помещают в разных подгруппах? ХИМИЧЕСКАЯ СВЯЗЬ. Пример 1. Каким типом гибридизации АО бериллия описывается образование молекулы хлорида бериллия? Какова конфигурация этой молекулы? Решение: Возбужденный атом бериллия имеет конфигурацию 2s12p1. Поэтому можно считать, что в образовании химических связей могут участвовать не одинаковые, а различные атомные орбитали. В молекуле BeCl2 должны быть неравноценные по прочности и направлению связи, причем σ-связи из p-орбиталей должны быть более прочными, чем связи из s-орбиталей, т.к. для p-орбиталей имеются более благоприятные условия для перекрывания. Однако опыт показывает, что в молекулах, содержащих центральные атомы с различными валентными орбиталями (s, p, d), все связи равноценны – это объясняет метод гибридизации. В данном случае имеет место sp- гибридизация При образовании молекулы одна s- и одна р-орбиталь образуют две гибридные sp-орбитали под углом 180о.
sp-гибридные орбитали Экспериментальные данные показывают, что все галогениды Be, а также Zn, Cd и Hg (II) линейны и обе связи имеют одинаковую длину. Пример 2. Определите тип гибридизации орбиталей центрального атома в молекуле BF3. Какова конфигурация этой молекулы? Решение: Возбуждённый атом бора имеет конфигурацию 2s12p2. В результате гибридизации одной s-орбитали и двух p-орбиталей образуются три гибридные sp2-орбитали, расположенные в одной плоскости под углом 120о друг к другу.
sp2-гибридизация Пример 3. Каким типом гибридизации АО азота описывается образование молекулы аммиака? Решение:
В результате гибридизации 2s и трёх 2p орбиталей азота образуются четыре гибридные орбитали sp 3 . Конфигурация молекулы представляет из себя искажённый тетраэдр, в котором три гибридных орбитали участвуют в образовании химической связи, а четвёртая с парой электронов – нет. Углы между связями N-H не равны 90 о как в пирамиде, но и не равны 109,5 о , соответствующие тетраэдру.
sp3- гибридизация в молекуле аммиака При взаимодействии аммиака с ионом водорода в результате донорно-акцепторного взаимодействия образуется ион аммония, конфигурация которого представляет собой тетраэдр. Пример 4. Объяснить с позиций метода МО возможность существования молекулярного иона Не2+ Решение: В молекулярном ионе Не2 + имеется три электрона.На связывающей орбитали размещены два электрона,а на разрыхляющей –один. Следовательно кратность связи равна 0, и он должен быть энергетически устойчивым. УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Определите тип гибридизации орбиталей центрального атома в следующих молекулах и укажите геометрическую форму этих молекул: BeF2, H2O, SiCl4, NH3, CH4, BCl3 Полярны ли эти молекулы? 2.Определите тип гибридизации орбиталей центрального атома в следующих частицах и укажите геометрическую форму этих частиц: NH4+, BF4-, SiF62-, AlF63-, SO42-, PO43-. 3.Составьте энергетическую диаграмму МО для следующих частиц и определите порядок связи в них: H2,H2+,H2-,He2, HeH, He2+, Li2, Be2, N2, N2+, O2, O2-, O2+. 4. Пользуясь таблицей относительных электроотрицательностей, определите, какая из связей является наиболее полярной: Са-Н, I-C1.C-S. 5. В каком из приведенных соединений:LiF, BeF,BF,CF связь Э-F будет больше всего приближаться к ковалентной? 7. Как изменяется прочность связи в ряду: НF-НСl-НВг-Н1? 8. Сероводород при обычной температуре - газ, а вода- жидкость. Чем можно объяснить это различие в свойствах? КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Комплексными или координационными соединениями принято называть соединения, в узлах кристаллической решётки которых находятся комплексы, способные к самостоятельному существованию в растворе. Комплексное соединение состоит из внутренней сферы и внешней сферы. Во внутреннюю сферу входят центральный атом (комплексообразователь) в некоторой степени окисления и лиганды – противоположно заряженные ионы или нейтральные молекулы. Общее число σ–связей, образуемых центральным атомом –комплексообразователем характеризует координационное число (КЧ) данного центрального атома. Например, в комплексном соединении K2[PtCl6] ионы К+ -внешняя сфера ион [PtCl6]2- -внутренняя сфера с центральным атомом PtIV и лигандами Cl-. В комплексном соединении [Fe(H2O)6]Cl3 ионы Cl- - внешняя сфера, ион [Fe(H2O)6]3+ - внутренняя сфера с центральным атомом FeIII и лигандами Н2О. В комплексе [Co(NH3)3Cl3] внешней сферы нет совсем, а во внутренней сфере центральный атом CoIII координирует лиганды NH3 и Cl- В соединении. [Ni(NH3)6][Fe(CN)6] содержатся комплексный катион [Ni(NH3)6]2+ и комплексный анион [Fe(CN)6]2-. При вычислении заряда комплексного иона заряд комплексообразователя принимается равным его степени окисления; тогда этот заряд равен алгебраической сумме зарядов комплексообразователя и лигандов. Например, заряды следующих комплексных ионов, образованных хромом(III): а)[Cr(H2O)5Cl]; б) [Cr(H2O)4Cl2]; в) [Cr(H2O)2(C2O4)2]. Равны: а) (3+) + (1-) = 2+; б) (3+) + 2(1-)= 1+; в) (3+) + 2(2-) = 1-. УПРАЖНЕНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1. Определите величину и знак заряда комплексных ионов, образуемых Cr3+ : [Cr(H2O)4Cl2], [Cr(H2O)3Cl3], [Cr(H2O)5Cl], [Cr(NH3)3(OH)3]. 2. Напишите координационные формулы соединений по заданному составу для вещества в водном растворе, если при добавлении избытка нитрата серебра: а) к 0,11 моль PtCl4 · 3NH3 образуется 0,11 моль осадка; б) к 0,07 моль CrCl3 · 5NH3 образуется 0,14 моль осадка. 3. Определите гибридные орбитали центрального атома-комплексообразователя, пространственную структуру ионов, укажите, какой из них – высокоспиновый, какой – низкоспиновый: [Fe(CN)6]3- (диамагнитный); [FeF6]3- (парамагнитный). 4. Составьте пространственные изображения цис - и транс - изомеров следующих комплексов: [Co(NCS)3(NO2)3]3-, [Pt(NH3)2(NCS)2]. 5. Напишите молекулярные и ионные уравнения реакций образования комплексных соединений: Fe(CN)2 + KCN =…; [Cr(H2O)6]3+ + OH- = …: 6. Объясните, почему соединения ионов Ca2+ и Zn2+ бесцветны. 7. Объясните, почему низкоспиновые комплексы Fe(II) и Co(III) диамагнитны. 8. Напишите уравнения протолитических реакций в водном растворе для комплексов, проявляющих кислотные свойства: [Co(H2O)(NH3)4(NO2)]2+, [Pt(H2O)2(NH3)4]4+.
ХИМИЯ ЭЛЕМЕНТОВ Р- ЭЛЕМЕНТЫ. VIIA- группа ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ Р-ЭЛЕМЕНТЫ. VIА- группа. 1. По известным температурам плавления и кипения Н2Э постройте график зависимости температур кипения и плавления от порядкового номера элемента.
Н2Э..................... H2O…………..H2S…………..H2Se……………H2Te tпл. 0C.................. 0,00………….-85,54……….- 65,72………….- 51,00 tкип. 0C............ 100,00………… -60,35……….- 41,50…………. -1,80
2. Дайте сравнительную характеристику водородных соединений, указав изменения:
3. Определите, будет ли в изолированной системе при 298 К термодинамически выгодной реакция: H2S(г) + SO2(г) = S(т) + H2O(ж)? 4. Запах SO2 в воздухе ощущается при его содержании 0,001 мл (н.у.) в 1 л воздуха. Установите, существует ли опасность экологического загрязнения атмосферы, если в пробе воздуха объёмом 100 мл (н.у.) обнаружено количество SO2, эквивалентное сжиганию 1 г природного топлива, содержащего 2,86 10-4 % серы? 5. По методу ВС предскажите полярность молекул SO2 и H2S. Р - ЭЛЕМЕНТЫ VА - группа 1. Дайте сравнительную характеристику атомов элементов подгруппы азота, указав: а) электронные конфигурации, б) валентные возможности, в) наиболее характерные степени окисления. 2. Каким типом гибридизации АО азота описывается образование молекулы NH3,иона NH4+? Какова пространственная структура этих частиц? 3. Опишите электронное строение молекулы азота по методу и МО. 4. Какая из приведенных реакций наиболее вероятна при 298К: NH4NO3(к) = N2O(г) + 2H2O(г) NH4NO3(к) = N2 (г) + 0,5 02 (г) + 2 H20(г)? Стандартные энергии Гиббса образования в кДж/ моль равны: для NH4NO3(кр.) = -183,8 для N2O(г) = +104,2 для H20(г) = -228,6. 5. Какова реакция среды в водных растворах: нитрата бария, нитрита натрия, фосфата калия? 6. Какие из перечисленных солей взаимодействуют в подкисленном серной кислотой растворе: а) с иодидом калия, б) с перманганатом калия? Напишите уравнения протекающих реакций. 7. Напишите уравнения реакций взаимодействия Na, Ag, Ca, Zn, Cu, Al, Fe, S, C,P: а) с разбавленной азотной кислотой, б) с концентрированной азотной кислотой. 8. Дайте сравнительную характеристику водородных соединений подгруппы азота, указав, как изменяются: а) температуры кипения и плавления, б) термическая устойчивость, в) окислительно- восстановительные свойства, г) кислотно- основные свойства. 9. Как изменяются кислотно-основные свойства в ряду гидроксидов мышьяка (III), сурьмы(III), висмута(III)? 10 Закончите уравнения реакций: 1)P + Cl2=… 2) P + Mg=… 3) PH3 + KMnO4 + H2SO4 =… 4) As2 03 + Zn + H2S04 =AsH3 + … 5)NaBiO3 + Mn(NO3)2 + HNO3= HMnO4 + … Р- ЭЛЕМЕНТЫ IV А- группы 1. Дайте сравнительную характеристику атомов элементов подгруппы углерода, указав: а) электронные конфигурации,б) валентные возможности, в) наиболее характерные степени окисления. 2. Какой тип гибридизации АО углерода в молекулах: CH4, C2H6, C2H4, C2H2,CO2? 3. Дайте сравнительную характеристику свойств водородных соединений элементов подгруппы углерода. 4. Опишите свойства СО, ука
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-08-06; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.70.108 (0.022 с.) |



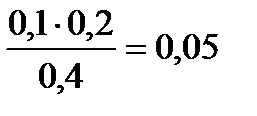 моль/л
моль/л 0,01 / 0,41∙0,48 = 0,05моль/л.
0,01 / 0,41∙0,48 = 0,05моль/л.
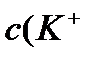 )=
)=  моль/л c(Na
моль/л c(Na  )=
)=  = 0,08моль/л
= 0,08моль/л = 0,03 моль/л c(HPO42-)=
= 0,03 моль/л c(HPO42-)=  = 0.04 моль/л
= 0.04 моль/л
 +lg
+lg  = 7,03.
= 7,03.

 =x(моль/л) c(NH4+)=
=x(моль/л) c(NH4+)=  =(0,1-0,5x) моль/л.
=(0,1-0,5x) моль/л. lg
lg 
 x= 0,0895 (л) =89,5 мл
x= 0,0895 (л) =89,5 мл  90мл.
90мл.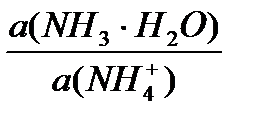

 90мл.
90мл.