
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Одеської національної академії харчових технологій
Методичні вказівки до практичних робіт з предмету “Аналітична хімія” для студентів ІІ курсу за спеціальністю 5. 05170104 "Виробництво хліба, кондитерських, макаронних виробів та харчоконцентратів"
М. Одеса - 2011 1. РОЗГЛЯНУТО: Циклова комісія хімічних дисциплін Одеського технічного коледжу одеська національна академія харчових технологій. 2. ВИКОНАВЕЦЬ: викладач аналітичної хімії, голова циклової комісії хімічних дисциплін Швець Л.І., 2. РЕЦЕНЗЕНТ: Голова циклової комісії природничо-математичних дисциплін ОТЗТ С.В. Зелінська
Методичний посібник розроблений для виконання практичних занять, з предмету: «Аналітична хімія» для студентів ІІ курсу спеціальності 5.05170104 "Виробництво хліба, кондитерських, макаронних виробів та харчоконцентратів". У даному посібнику розглядаються такі теми: 1. Розбір умов осадження та розчинення осадів. 2. Рішення задач на визначення якісного складу речовин. 3. Визначення формул аналізуємих речовин. 4. Розрахунки у гравіметричному методі аналізу. 5. Виконання розрахунків у кислотно-основному титруванні. 6. Розв’язування задач на визначення концентрації речовин. 7. Складання окисно-відновних реакцій в методі оксидиметрії. 8. Рішення задач в оксидиметрії. 9. Розв’язування задач у титриметричному методі аналізу. 10. Визначення масової частки розчинів. 11. Визначення водневого та гідроксильного показників. Перед кожною практичною роботою надаються стислі теоретичні відомості з вивчених тем, що допомагає студенту краще засвоїти матеріал для виконання практичної роботи. Також після кожної практичної роботи даються завдання для контролю знань, які допомагають закріпити краще вивчений матеріал. Виконання практичних робіт надає можливість студентам більш поглиблено вивчити даний курс предмету.
Розроблена для допомоги викладачам та студентам МІНІСТЕРСТВО ОСВІТИ І НАУКИ, МОЛОДІ ТА СПОРТУ УКРАЇНИ ОДЕСЬКИЙ ТЕХНІЧНИЙ КОЛЕДЖ ОДЕСЬКОЇ НАЦІОНАЛЬНОЇ АКАДЕМІЇ ХАРЧОВИХ ТЕХНОЛОГІЙ
ЗАТВЕРДЖУЮ заст. директора з НР ____________В. І. Уманська "___" ___________2011 р.
Методичні вказівки до практичних робіт з предмету “Аналітична хімія”
для студентів ІІ курсу за спеціальністю 5. 05170104 "Виробництво хліба, кондитерських, макаронних виробів та харчоконцентратів" Автор Швець Л. І.
РОЗГЛЯНУТО предметною комісією
2011 р.
Зміст
Вступ
Для оволодіння теоретичним матеріалом з аналітичної хімії необхідно вміти розв’язувати задачі. Вміння розв’язувати задачі дає змогу студенту глибше пізнати та зрозуміти значно більше хімічних процесів та їх закономірності. Математичний розрахунок для хіміка-аналітика – визначна та вирішальна стадія роботи. Яку б високу кваліфікацію не мав аналітик і наскільки б вірно він не працював, математична помилка, зроблена в розрахунках, зробить безглуздою всю виконану роботу, тому технік-технолог повинен пам’ятати, що помилка в розрахунках рівна помилці в аналізі і вміння вирішувати завдання з аналітичної хімії має велике значення. Цей посібник знайомить з різними типами задач та вправ, способами їх рішення. Розглянуті тут завдання повністю відповідають програмі курсу аналітичної хімії. Таблиці додатку. Розміщені в кінці методичних вказівок, вміщують матеріали, необхідні для рішення завдань відповідного типу.
ПРАКТИЧНЕ ЗАНЯТТЯ № 1. Тема: Розбір умов осадження та розчинення осадів.
Повинні знати: добуток розчинності по величині його розчинності та розчинність по добутку розчинності. Повинні вміти: розбирати умови утворення та розчинення осадів, виконувати розрахункові задачі.
Стислі теоретичні відомості
Константа розчинності називається добутком розчинності Др для насичених розчинів важко розчинених сполук, є величина постійна, рівна добутку концентрацій окремих іонів. Якщо добуток окремих іонів буде більше величини добутку розчинення, то дана речовина випаде в осад. Якщо добуток концентрацій буде менше величини добутку розчинності, то осад не утворюється. По величині добутку розчинності роблять висновок, яка речовина краще осаджується, а яка краще розчиняється. Чим менше величина добутку розчинення малорозчинних сполук, тим більш повно ця сполука випаде в осад. Визначення добутку розчинення по величині його розчинності в моль/см3 проводиться по наступному алгоритму: а) записується рівняння дисоціації молекули електроліту; б) записується математичне вираження добутку розчинності; в) розчинність електроліту в моль/см3 дорівнює концентрації окремих іонів; г) підставляється ця величина в математичне вираження добутку розчинності.
Приклад 1. Добуток розчинності сульфату кальцію дорівнює 6,1×10-5, а концентрація іона кальцію дорівнює 3×10-3 моль/см3. Визначити, чи осаджується в такому випадку сульфат кальцію?
Дано: Рішення.
осаджується СаSO4 -? СаSO4= Са2+ + SO42- 2. Записуємо математичне вираження величини добутку розчинності Др 3. Концентрація іона кальцію дорівнює концентрації сульфат іона і дорівнює розчинності [Са2+] = [SO42-] = Р де Р – розчинення, моль/см3. 4. Підставляємо величину (3×10-3 моль/см3) в математичне вираження Др Др Ця величина менше величини добутку розчинності, внаслідок чого осад сульфату кальцію не утворюється.
Приклад 2. У вигляді якої сполуки осаджується іон свинцю? Рішення. З таблиці добутку розчинності виписуємо сполуку іону свинцю. Др Др Др Порівняємо значення цих сполук. При порівняння цих величин робимо висновок, що іон свинцю краще осаджується у вигляді сульфіду свинцю, так як значення добутку розчинності має найменше значення.
Приклад 3. Визначити величину добутку розчинності хлориду срібла, якщо розчинність його дорівнює 1,25×10-5 моль/см3.
ДрAgCl -? AgCl 2. Записуємо математичне вираження добутку розчинності ДрAgCl = [Ag+] × [Cl-] 3. Концентрації іонів між собою рівні і дорівнюють розчинності [Ag+] = [Cl-] = Р = 1,25×10-5 4. Підставляємо числові дані в математичне вираження Др ДрAgCl = 1,25×10-5 × 1,25×10-5 = 1,36×10-10 Визначення розчинності по величині добутку розчинності вирішується аналогічно, а так як розчинність речовини дорівнює концентрації окремих іонів, то РAgCl = [Ag+] × [Cl-] = Х з математичного вираження ДрAgCl = [Ag+] × [Cl-] = Х2, а
Х =
Завдання для самоперевірки та закріплення матеріалу
1. Добуток розчинності сульфату барію 1×10-10. Визначити розчинність солі. 2. У вигляді якої із сполук найбільш повно осаджується іон срібла. Відповідь обґрунтуйте. 3. Добуток розчинності карбонату барію 2,4×10-9. Концентрація карбонат іона дорівнює 2×10-5 моль/см3. Чи випадає в даному випадку осад? 4. Визначте, оксалат якого металу скоріше осаджується? Відповідь обґрунтуйте. 5. Добуток розчинності сульфату цинку дорівнює 1,2×10-23 моль/см3. Концентрація іонів цинку дорівнює 2×10-14 моль/см3. Чи з'являється у цьому випадку осад сульфату цинку? 6. Найти добуток розчинності сіркокислого кальцію, якщо його розчинність дорівнює 1,4×10-8 моль/см3. 7. Визначте, гідроксид якого металу найменш повно осаджується? Відповідь обґрунтуйте.
ПРАКТИЧНЕ ЗАНЯТТЯ № 2. Тема: Рішення задач на визначення якісного складу речовин. Повинні знати: розподіл аналітичних груп та класифікацію катіонів та аніонів, якісні реакції на визначення катіонів і аніонів. Повинні вміти: знаходити з яких хімічних елементів, груп атомів, іонів або молекул складається аналізуєма речовина; складати рівняння реакції для знаходження катіонів та аніонів.
Стислі теоретичні відомості
В якісному аналізі неорганічних речовин досліджують водні розчини солей, кислот та основ. Вказані речовини у водних розчинах знаходяться в дисоціюю чому стані, тому хімічний аналіз зводять до відкриття окремих іонів (катіонів та аніонів), а не елементів або їх сполук. Для зручності відкриття іони поділяють на аналітичні групи. Класифікація катіонів та аніонів по аналітичним групам основана на розчинності деяких утворених ними солей. Згідно цієї класифікації, катіони поділяють на деякі наступні групи: І аналітична група катіонів – одновалентні катіони натрію, калію, амонію та двовалентні катіони магнію. Це катіони, які не мають загального (групового) реактиву, здібного одночасно осаджувати катіони цієї групи при спільній їх присутності. ІІ аналітична група катіонів – двовалентні катіони кальцію, барію, стронцію. Це катіони, які осаджуються у нейтральному та лужному середовищі (рН не більше 10) груповим реактивом – карбонатом амонію у присутності NH4СІ у виді не розчинних у воді сполук – карбонатів. ІІІ аналітична група катіонів – двовалентні катіони нікелю, кобальту, марганцю, цинку, заліза та трьохвалентні катіони алюмінію, хрому заліза. Це катіони, які осаджуються з нейтрального та лужного розчину сульфідом амонію у виді сульфідів (іони заліза, марганцю, цинку, нікелю та кобальту) та гідроокисі (іони алюмінію та хрому).
Класифікація аніонів основана на різній розчинності барієвих, кальцієвих, срібних та інших солей відповідних кислот. Методи аналізу аніонів можна поділити на 3 основні групи: 1) систематичні методи, основані подібно класичному сірководневому методу аналізу катіонів на розподіл аніонів на групи; при цьому аналіз ведеться із одної порції досліджує мого розчину шляхом послідуючого розподілу аніонів; 2) дрібні методи аналізу, основані на відкритті аніонів з окремих порцій досліджує мого розчину; 3) полу систематичний метод, оснований на розподілі аніонів на групи, аналіз досліджує мого розчину відбувається не з однієї порції, а з де кількох порцій. В аналізі аніонів немає потреби їх поділяти окремо, так як більш за все у залежності від попередніх дослідів, які дозволяють в деякому ступені встановити присутність або відсутність тих чи інших аніонів, багато аніонів можуть бути знайдені у присутності друг друга в окремих порціях розчину. Щоб легше було порівняти окремі реакції відкриття та розподілу іонів, рекомендуємо у додатку таблицю № 1 та № 2, в якій приводяться формули та характерні особливості сполук, які утворені реактивами з окремими іонами, розчинність, колір, запах та інше.
Приклад 1. Скласти рівняння реакції утворення дигідроантімонату натрію. Рішення. NaCl + KH2SbO4 ® NaH2SbO4↓ + KCl Na+ + Cl- + K+ + H2SbO4- ® NaH2SbO4↓ + K+ + Cl- Na+ + H2SbO4- ® NaH2SbO4↓
Приклад 2. Вкажіть, формулу осаду карбонату барію: а) ВаSO4; б) Ва2S2O3; в) ВаSO3; г) ВаS; д) ВаСО3. Складіть рівняння реакцій у молекулярному та іонному виді. Рішення. Формулу осаду карбонату барію - ВаСО3. Na2СО3 + ВаСІ2 ® ВаСО3↓ + 2NaCl 2Na+ + СО3-2 + Ва+2 + 2СІ- ® ВаСО3↓ + 2Na+ + 2Cl- Ва+2 + СО3-2 ® ВаСО3↓
Приклад 3. Вкажіть, реактив на відкриття катіону калію: а) КСІ; б) ВаСІ2; в) Са(NO3)2; г) NaOH; д) АІ(NO3)3. Складіть рівняння реакцій у молекулярному та іонному виді. Рішення. Реактив на відкриття катіону калію – КСІ. 2КСІ + Na3[Co(NO2)6] → К2Na[Co(NO2)6]↓ + 2NaСІ 2К+ + 2СІ- + 3 Na+ + [Co(NO2)6]3- → К2Na[Co(NO2)6]↓ + 2Na+ + 2СІ- 2К+ + Na+ + [Co(NO2)6]3- → К2Na[Co(NO2)6]↓
Завдання для самоперевірки та закріплення матеріалу 1. Вкажіть формули реактивів катіону заліза зі ступенем окислення (+2): а) KCNS; б) K3[Fe(CN)6]; в) K4[Fe(CN)6]; г) NaOH. Складіть рівняння реакцій у молекулярному та іонному виді. 2. Складіть рівняння реакції утворення гексанітрокобольтату калію. 3. Вкажіть, з якими аніонами хлорид барію утворює осади: а) І-; б) SO42-; в) S2O3-; г) CI-; д) CO32-. Складіть рівняння реакцій у молекулярному та іонному виді. 4. Вкажіть характерний реактив катіону барію: а) (NH4)2C2O4; б) H2SO4; в) H2CrO4; г) K2CrO4; д) Na2CrO4. Складіть рівняння реакцій у молекулярному та іонному виді. 5. Вкажіть, формули реактивів катіону алюмінію: а) KОН; б) Н2О2; в) NН4СІ; г) NаОН; д) АgNO3.
Складіть рівняння реакцій у молекулярному та іонному виді.
ПРАКТИЧНЕ ЗАНЯТТЯ № 3. Тема: Визначення формул аналізуємих речовин. Повинні знати: написання формул хімічних речовин; валентність елементів, кислотних залишків. Повинні вміти: встановлювати хімічні формули. В одному випадку потрібно тільки встановити число атомів кожного елементу у молекулі досліджуємої речовини, в другому випадку корисно уявити формулу речовини як сполуку оксидів або у виді сполук декількох молекул більш простого складу.
Стислі теоретичні відомості
Подібні задачі вирішують у два прийоми. Спочатку знаходять відношення числа часток (атомів, іонів, більш простих молекул), які входять до складу молекули аналізуємої сполуки, використовуй формулу:
де А, В, С – атомні (або молекулярні) маси часток, які входять до складу молекули; а, b, c – їх відсотковий вміст у аналізує мій речовині; x, y, z – число часток у молекулі найпростішого складу. Потім відношення знайдених дрібних чисел замінюють відношенням найближчих цілих чисел. В багатьох природних хімічних сполуках часто зустрічаються явища ізоморфного заміщення. Воно заклечається в тому, що у сполуці один хімічний елемент частково заміщений іншим, подібним з ним по валентності та іншим властивостям. Наприклад, у вапняках невизначна частина кальцію заміщується магнієм, тому вапняк, який взяли у різних місцевостях, має різний склад. Щоб вказати на явище ізоморфного заміщення, склад вапняку виражають формулою (Са, Мg)СО3. У подібному випадку формула сполуки не може бути знайдена непослідовно, так як відношення x: y: z не буде дорівнювати відношенню цілих чисел, що є признакою ізоморфного заміщення. В цих випадках, щоб отримати для усіх членів відношення цілих чисел, необхідно додати ті члени, які відносяться до ізоморфно заміщених елементів.
Приклад 1. Аналізом встановлено, що до складу речовини входить 59,19% Ві; 13,62% S; 27,19% О. Яка найпростіша формула аналізуємої речовини?
Ві = 59,19%; S = 13,62%; Прийнявши найменше число за одиницю та поділив на О = 27,19% нього два інших члени відношення, знайдемо:
Формула -? Так як число часток в молекулі не може бути виражено дрібним числом, подвоюємо величину усіх членів відношення і отримуємо: x: y: z = 2: 3: 12, тобто, до складу молекули аналізуємої речовини входять 2 атоми Ві, 3 атоми S та 12 атомів О. Формула речовини Ві2(SО4)3.
Приклад 2. Аналізом встановлений склад мінералу: 9,20% Са; 22% Мg; 13,7% С; 55,1% О. Знайти найпростішу хімічну формулу мінералу.
Мg = 22%; С = 13,7% 1,14 О = 55,1% Формула сполуки (Са, Мg)СО3.
Формула -?
Завдання для самоперевірки та закріплення матеріалу 1. Яку хімічну формулу має речовина, яка в своєму складі має 62,53% Са та 37,47% С? 2. Пиролюзід має склад 63,19% Mn; 36,81% О. Якій хімічній формулі відповідає його склад? 3. До складу речовини входить 36,23% МgО та 63,77% Р2О5. Якою хімічною формулою виражається його склад? ПРАКТИЧНЕ ЗАНЯТТЯ № 4. Тема: Розрахунки у гравіметричному методі аналізу. Повинні знати: методику розрахунків по трьох типах вагових визначень. Повинні вміти: визначати вологість, зольність, відсотковий склад речовин, фактор перерахунку.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.46.58 (0.088 с.) |
 протокол №
протокол № від “ ” 2011 р.
від “ ” 2011 р. Др
Др  = 6,1×10-5 1. Складаємо рівняння дисоціації малорозчинювального
= 6,1×10-5 1. Складаємо рівняння дисоціації малорозчинювального [Са2+]=3×10-3моль/см3 електроліту
[Са2+]=3×10-3моль/см3 електроліту = 1,7×10-5
= 1,7×10-5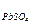 = 1,8×10-8
= 1,8×10-8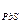 = 1,1×10-29
= 1,1×10-29 Дано: Рішення.
Дано: Рішення. РAgCl = 1,25×10-5 моль/см3. 1. Складаємо рівняння дисоціації електроліту
РAgCl = 1,25×10-5 моль/см3. 1. Складаємо рівняння дисоціації електроліту Ag+ + Cl
Ag+ + Cl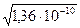 = 1,25×10-5 моль/см3.
= 1,25×10-5 моль/см3. ,
, Дано: Рішення.
Дано: Рішення.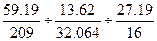 = 0,2832: 0,4248: 1, 6994 = x: y: z.
= 0,2832: 0,4248: 1, 6994 = x: y: z. x: y: z = 1: 1,5: 6.
x: y: z = 1: 1,5: 6. Дано: Рішення.
Дано: Рішення. Са = 9,20%;
Са = 9,20%;  = 0,23: 0,91: 1, 14: 3,44 = 1: 1: 3
= 0,23: 0,91: 1, 14: 3,44 = 1: 1: 3


