Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биохимические процессы переваривания белковСтр 1 из 9Следующая ⇒
Биохимические процессы переваривания белков Процессы переваривания белков решают следующие задачи: · под действием протеолитических ферментов, входящих в состав желудочно-кишечных секретов происходит гидролиз пептидных связей и образование в конечном итоге свободных АМК; · облегчается транспорт продуктов переваривания во внутреннюю среду организма; · молекулы белков в процессе гидролиза лишаются видовой специфичности, а продукты переваривания не обладают антигенными свойствами; · пищеварение белков является основным поставщиком экзогенных аминокислот в организм. Метаболизм аминокислот. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные метаболические пути, главным из которых является синтез собственных белков, а также других азот содержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются в процессах генерации энергии, включаясь в реакции катаболизма. Источники аминокислот и пути их использования представлены на рис. 2. Гидролиз тканевых белков (~ 400 г в сутки) не обеспечивает затрат аминокислот, необходимых при использовании их как исходных веществ для катаболизма или синтеза других азотсодержащих соединений. Синтез аминокислот из углеводов также не обеспечивает всех потребностей организма, так как из углеводов возможен синтез лишь углеродной части аминокислот, называемых заменимыми. Следовательно, основным источником аминокислот в организме являются белки пищи человека или корма животных. Состояние белкового обмена характеризует азотистый баланс — это разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (в основном в составе мочевины). 95% всего азота в организме приходится на долю аминокислот. Следовательно, азотистый баланс характеризует состояние белкового и аминокислотного обмена. Азотистое баланс (равновесие) – количество выводимого азота равно количеству поступающего характерно для здорового человека с нормальным ритмом питания. Положительный азотистый баланс – выводится азота меньше, чем поступает, имеет место в период роста организма или при выздоровлении после истощающих заболеваний.
Отрицательный азотистый баланс – выводится азота больше, чем поступает) наблюдается при тяжелых, истощающих заболеваниях, голодании, старении. Переваривание белков В желудочно-кишечном тракте белки подвергаются гидролитическому расщеплению до аминокислот-мономеров, которые всасываются и затем поступают в клетки.
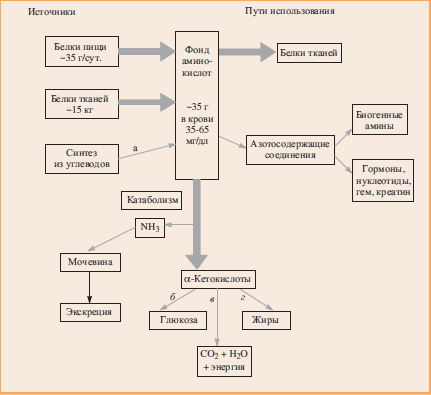
Рис. 2. Источники и пути использования аминокислот: а — синтез из углеводов (возможен только для группы заменимых аминокислот). Выбор одного из метаболических путей (б, в, г) зависит от строения аминокислоты, физического состояния организма и регуляции
Эндопептидазы: пепсин, трипсин и химотрипсин, расщепляют пептидные связи, расположенные во внутренних участках полипептидной цепи. Они синтезируются в виде неактивных предшественников – проферментов. Таким способом секретирующие клетки защищают свои собственные белки от разрушения этими ферментами. После секреции проферменты активируются в просвете желудка или кишечника путем частичного протеолиза[1] (табл.1). В норме слизистая оболочка желудка и кишечника защищена от действия протеаз слоем слизи. Кроме того, поверхностный полисахаридный слой плазматической мембраны также предохраняет клетку от действия протеаз. Таблица 1 Пепсин Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, состоящий из одной полипептидной цепи с молекулярной массой 40 кД., в котором активный центр "прикрыт" N-концевым фрагментом. При наличии соляной кислоты конформация пепсиногена изменяется таким образом, что "раскрывается" активный центр фермента, В процессе активации в результате частичного протеолиза от N-конца молекулы пепсиногена отщепляются 42 аминокислотных остатка, которые содержат почти все положительно заряженные аминокислоты, имеющиеся в пепсиногене. Таким образом, в активном пепсине преобладающими оказываются отрицательно заряженные аминокислоты, которые участвуют в конформационных перестройках молекулы и формировании активного центра. Образовавшиеся под действием НСl активные молекулы пепсина быстро активируют остальные молекулы пепсиногена (аутокатализ).
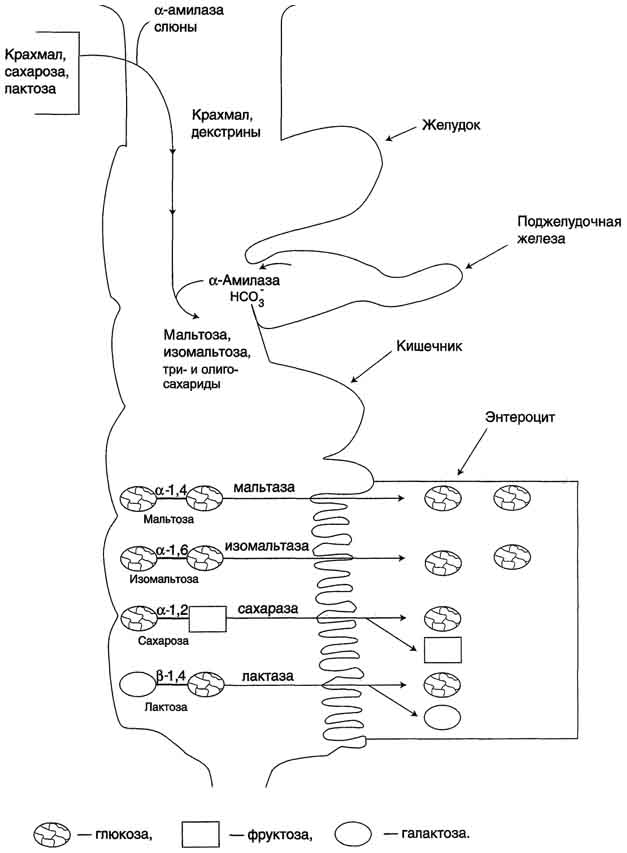
Пепсин в первую очередь гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (Phe, Trp, Tyr) и несколько медленнее - образованные Leu и дикарбоновыми аминокислотами. Пепсин - эндопептидаза, поэтому в результате его действия в желудке образуются более короткие пептиды, но не свободные аминокислоты. У детей грудного возраста в желудке, а также других животных питающихся молоком отсутствует соляная кислота. Поэтому, в такой период развития, в желудке находится фермент реннин (химозин), вызывающий свёртывание молока. Основной белок молока - казеин, представляющий смесь нескольких белков, различающихся по аминокислотному составу и электрофоретической подвижности. Реннин катализирует отщепление от казеина гликопептида, в результате чего образуется параказеин. Параказеин присоединяет ионы Са2+, образуя нерастворимый сгусток, чем предотвращает быстрый выход молока из желудка. Белки успевают расщепиться под действием пепсина. В желудке взрослых людей реннина нет, молоко у них створаживается под действием НСl и пепсина. В слизистой оболочке желудка найдена ещё одна протеаза - гастриксин. Все 3 фермента (пепсин, реннин и гастриксин) сходны по первичной структуре, что указывает на их происхождение от общего гена-предшественника. Соляная кислота, а также пепсин способны разрушать клетки эпителия желудка. В норме это не происходит благодаря наличию защитных факторов слизистой оболочки: · наличие на поверхности слизи, состоящей из гетерополисахаридов, которые не являются субстратом ферментов; · секреция эпителиальными клетками ионов НСО3-, которые создают в пристеночном слое среду с рН 5,0-6,0, при которой ферменты в желудке неактивны; · поврежденные клетки эпителия способны к быстрой регенерации; Образовавшиеся в процессе переваривания фрагменты белков в виде олигопептидов поступают в нижележащие отделы кишечника, где процесс переваривания продолжается дальше. ПЕРЕВАРИВАНИЕ УГЛЕВОДОВ С пищей в основном поступают крахмал, гликоген, целлюлоза, сахароза, лактоза, мальтоза, глюкоза и фруктоза, рибоза. Рис. 7. Действие сахаразо-изомальтазного комплекса на мальтозу и мальтотриозу.
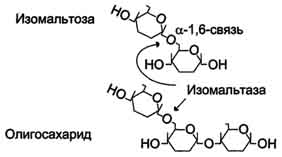
Рис. 8. Действие сахаразо-изомальтазного комплекса на изомальтозу и олигосахарид. В тощей кишке содержание сахаразо-изомальтазного ферментативного комплекса достаточно высокое, но оно снижается в проксимальной и дистальной частях кишечника. Гликоамилазный комплекс Этот ферментативный комплекс катализирует гидролиз α-1,4-связи между глюкозными остатками в олигосахаридах, действуя с восстанавливающего конца. По механизму действия этот фермент относят к экзогликозидазам. Комплекс расщепляет также связи в мальтозе, действуя как мальтаза. В гликоамилазный комплекс входят две разные каталитические субъединицы, имеющие небольшие различия в субстратной специфичности. Гликоамилазная активность комплекса наибольшая в нижних отделах тонкого кишечника.
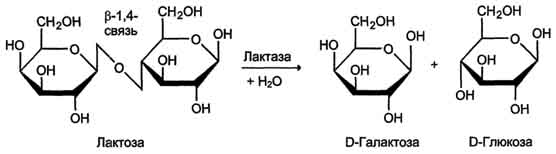
β-Гликозидазный комплекс (лактаза) Лактаза расщепляет β-1,4-гликозидные связи между галактозой и глюкозой в лактозе (рис. 9).
Рис. 9. Действие лактазы. Этот ферментативный комплекс по химической природе является гликопротеином. Лактоза, как и другие гликозидазные комплексы, связана с щёточной каемкой и распределена неравномерно по всему тонкому кишечнику. Активность лактазы колеблется в зависимости от возраста. Так, активность лактазы у плода особенно повышена в поздние сроки беременности и сохраняется на высоком уровне до 5-7-летнего возраста. Затем активность фермента снижается, составляя у взрослых 10% от уровня активности, характерного для детей. Трегалаза - также гликозидазный комплекс, гидролизующий связи между мономерами в трегалозе - дисахариде, содержащемся в грибах. Трегалоза состоит из двух глюкозных остатков, связанных гликозидной связью между первыми аномерными атомами углерода (рис. 10).
Рис. 10. Строение трегалозы.
Совместное действие всех перечисленных ферментов завершает переваривание пищевых олиго- и полисахаридов с образованием моносахаридов, основной из которых - глюкоза. Кроме глюкозы, из углеводов пищи также образуются фруктоза и галактоза, в меньшем количестве - манноза, ксилоза, арабиноза. Общая схема переваривания углеводов представлена на рис. 11.
III. МЕХАНИЗМ ТРАНСМЕМБРАННОГО ПЕРЕНОСА ГЛЮКОЗЫ И ДРУГИХ МОНОСАХАРИДОВ В КЛЕТКИ Моносахариды, образовавшиеся в результате переваривания, всасываются эпителиальными клетками тощей и подвздошной кишок с помощью специальных механизмов транспорта через мембраны этих клеток.
Рис. 11. Переваривание углеводов. Таблица 2. Распределение белков-транспортёров глюкозы (ГЛЮТ)
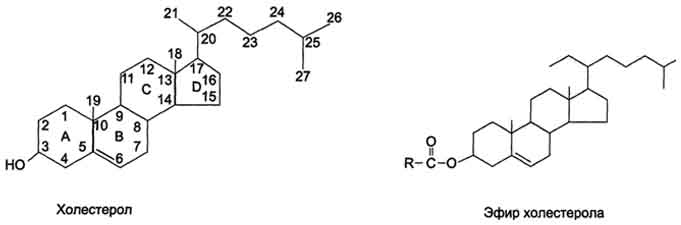
Структура белков семейства ГЛЮТ отличается от белков, транспортирующих глюкозу через мембрану в кишечнике и почках против градиента концентрации. Описанные 5 типов ГЛЮТ имеют сходные первичную структуру и доменную организацию. ГЛЮТ-1 обеспечивает стабильный поток глюкозы в мозг; ГЛЮТ-2 обнаружен в клетках органов, выделяющих глюкозу в кровь. Именно при участии ГЛЮТ-2 глюкоза переходит в кровь из энтероцитов и печени. ГЛЮТ-2 участвует в транспорте глюкозы в β-клетки поджелудочной железы; ГЛЮТ-3 обладает большим, чем ГЛЮТ-1, сродством к глюкозе. Он также обеспечивает постоянный приток глюкозы к клеткам нервной и других тканей; ГЛЮТ-4 - главный переносчик глюкозы в клетки мышц и жировой ткани; ГЛЮТ-5 встречается, главным образом, в клетках тонкого кишечника. Его функции известны недостаточно. Все типы ГЛЮТ могут находиться как в плазматической мембране, так и в цитозольных везикулах. ГЛЮТ-4 (и в меньшей мере ГЛЮТ-1) почти полностью находятся в цитоплазме клеток. Влияние инсулина на такие клетки приводит к перемещению везикул, содержащих ГЛЮТ, к плазматической мембране, слиянию с ней и встраиванию транспортёров в мембрану. После чего возможен облегчённый транспорт глюкозы в эти клетки. После снижения концентрации инсулина в крови транспортёры глюкозы снова перемещаются в цитоплазму, и поступление глюкозы в клетку прекращается. Перемещение глюкозы из первичной мочи в клетки почечных канальцев происходит вторично-активным транспортом, подобно тому, как это осуществляется при всасывании глюкозы из просвета кишечника в энтероциты. Благодаря этому глюкоза может поступать в клетки даже в том случае, если её концентрация в первичной моче меньше, чем в клетках. При этом глюкоза реабсорбируется из первичной мочи почти полностью (99%). Известны различные нарушения в работе транспортёров глюкозы. Наследственный дефект этих белков может лежать в основе инсулинонезависимого сахарного диабета. В то же время причиной нарушения работы транспортёра глюкозы может быть не только дефект самого белка. Нарушения функции ГЛЮТ-4 возможны на следующих этапах: передача сигнала инсулина о перемещении этого транспортёра к мембране; перемещение транспортёра в цитоплазме; включение в состав мембраны; отшнуровывание от мембраны и т.д. Эмульгирование жиров Жиры составляют до 90% липидов, поступающих с пищей. Переваривание жиров происходит в тонком кишечнике, однако уже в желудке небольшая часть жиров гидролизуется под действием "липазы языка". Этот фермент синтезируется железами на дорсальной поверхности языка и относительно устойчив при кислых значениях рН желудочного сока. Поэтому он действует в течение 1-2 ч на жиры пищи в желудке. Однако вклад этой липазы в переваривание жиров у взрослых людей незначителен. Основной процесс переваривания происходит в тонкой кишке. Так как жиры - нерастворимые в воде соединения, то они могут подвергаться действию ферментов, растворённых в воде только на границе раздела фаз вода/жир. Поэтому действию панкреатической липазы, гидролизующей жиры, предшествует эмульгирование жиров. Эмульгирование (смешивание жира с водой) происходит в тонком кишечнике под действием солей жёлчных кислот. Жёлчные кислоты синтезируются в печени из холестерола и секретируются в жёлчный пузырь (рис 13).
Рис. 13. Холестерол и его эфиры.
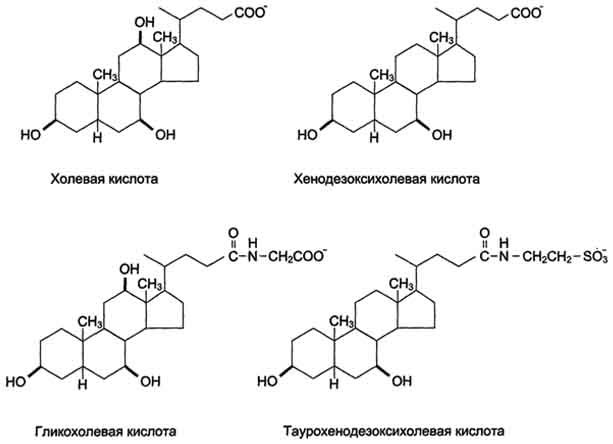
Содержимое жёлчного пузыря - жёлчь. Это вязкая жёлто-зелёная жидкость, содержащая главным образом жёлчные кислоты; в небольшом количестве имеются фосфолипиды и холестерол. Жёлчные кислоты представляют собой в основном конъюгированные жёлчные кислоты: таурохолевую, гликохолевую и другие (рис 14).
Рис. 14. Жёлчные кислоты.
После приёма жирной пищи жёлчный пузырь сокращается и жёлчь изливается в просвет двенадцатиперстной кишки. Жёлчные кислоты действуют как детергенты, располагаясь на поверхности капель жира и снижая поверхностное натяжение. В результате крупные капли жира распадаются на множество мелких, т.е. происходит эмульгирование жира. Эмульгирование приводит к увеличению площади поверхности раздела фаз жир/вода, что ускоряет гидролиз жира панкреатической липазой. Эмульгированию способствует и перистальтика кишечника. Рис. 15. Гидролиз триацилглицеролов панкреатической липазой. Молекулы 2-моноацилглицеролов также обладают детергентными свойствами и способствуют эмульгированию жира. Рис. 16. Переваривание фосфатидилхолинов. Фосфолипаза A2 секретируется в кишечник в виде профермента и активируется уже в полости кишечника путём частичного протеолиза. Для проявления активности фосфолипазы A2 необходимы ионы кальция. Жирная кислота в положении 1 отщепляется под действием лизофосфолипазы, а глицерофосфохолин гидролизуется далее до глицерола, холина и фосфорной кислоты, которые всасываются. Лизофосфолипиды - эффективные эмульгаторы жира, ускоряющие его переваривание. Рис. 17. Гидролиз эфиров холестерола в тонкой кишке. Образование смешанных мицелл и всасывание продуктов гидролиза Продукты гидролиза липидов - жирные кислоты с длинным углеводородным радикалом, 2-моноацилглицеролы, холестерол, а также соли жёлчных кислот образуют в просвете кишечника структуры, называемые смешанными мицеллами. Смешанные мицеллы построены таким образом, что гидрофобные части молекул обращены внутрь мицеллы, а гидрофильные - наружу, поэтому мицеллы хорошо растворяются в водной фазе содержимого тонкой кишки. Стабильность мицелл обеспечивается в основном солями жёлчных кислот. Мицеллы сближаются со щёточной каймой клеток слизистой оболочки тонкого кишечника, и липидные компоненты мицелл диффундируют через мембраны внутрь клеток. Вместе с продуктами гидролиза липидов всасываются жирорастворимые витамины A, D, Е, К и соли жёлчных кислот. Наиболее активно соли жёлчных кислот всасываются в подвздошной кишке. Жёлчные кислоты далее попадают через воротную вену в печень, из печени вновь секретируются в жёлчный пузырь и далее опять участвуют в эмульгировании жиров. Этот путь жёлчных кислот называют "энтерогепатическая циркуляция". Каждая молекула жёлчных кислот за сутки проходит 5- 8 циклов, и около 5% жёлчных кислот выделяется с фекалиями. Всасывание жирных кислот со средней длиной цепи, образующихся, например, при переваривании липидов молока, происходит без участия смешанных мицелл. Эти жирные кислоты из клеток слизистой оболочки тонкого кишечника попадают в кровь, связываются с белком альбумином и транспортируются в печень. Рис. 18. Ресинтез жиров в клетках слизистой оболочки тонкой кишки.
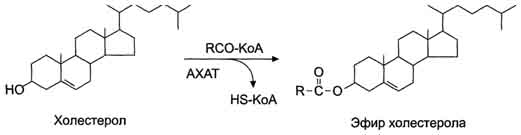
Жирные кислоты вступают в реакцию этерификации только в активной форме в виде производных коэнзима А, поэтому первая стадия ресинтеза жиров - реакция активации жирной кислоты: HS КоА + RCOOH + АТФ → R-CO ~ КоА + АМФ + Н4Р2О7. Реакция катализируется ферментом ацил-КоА-синтетазой (тиокиназой). Затем ацил~КоА участвует в реакции этерификации 2-моноацилглицерола с образованием сначала диацилглицерола, а затем триацилглицерола. Реакции ресинтеза жиров катализируют ацилтранеферазы. В реакциях ресинтеза жиров участвуют, как правило, только жирные кислоты с длинной углеводородной цепью. В ресинтезе жиров участвуют не только жирные кислоты, всосавшиеся из кишечника, но и жирные кислоты, синтезированные в организме, поэтому по составу ре-синтезированные жиры отличаются от жиров, полученных с пищей. Однако возможности "адаптировать" в процессе ресинтеза состав пищевых жиров к составу жиров организма человека ограничены, поэтому при поступлении с пищей жиров с необычными жирными кислотами, например, бараньего жира, в адипоцитах появляются жиры, содержащие кислоты, характерные для бараньего жира (насыщенные разветвлённые жирные кислоты). В клетках слизистой оболочки кишечника происходит активный синтез глицерофосфолипидов, необходимых для формирования структуры липопротеинов - транспортных форм липидов в крови. Образование эфиров холестерола В клетках слизистой оболочки тонкой кишки всосавшиеся молекулы холестерола также превращаются в эфиры путём взаимодействия с ацил-КоА (рис. 19). Эту реакцию катализирует ацилхолестеролацилтрансфераза (АХАТ). От активности этого фермента зависит скорость поступления экзогенного холестерола в организм.
Рис. 19. Реакция этерификации холестерола в клетках слизистой оболочки тонкой кишки. АХАТ - ацилхолестерол-ацилтрансфераза.
В клетках эпителия тонкой кишки из жиров, образовавшихся в результате ресинтеза, а также из эфиров холестерола, жирорастворимых витаминов, поступивших с пищей, формируются липопротеиновые комплексы - хиломикроны (ХМ). ХМ далее доставляют жиры в периферические ткани. Рис. 20. Липопротеины плазмы крови. Гидрофильный слой образован белками, которые называют апопротеинами, и амфифильными молекулами липидов - фосфолипидами и холестеролом. Гидрофильные группы этих молекул обращены к водной фазе, а гидрофобные части - к гидрофобному ядру липопротеина, в котором находятся транспортируемые липиды. Некоторые апопротеины интегральные и не могут быть отделены от липопротеина, а другие могут свободно переноситься от одного типа липопротеина к другому. Апопротеины выполняют несколько функций: формируют структуру липопротеинов; взаимодействуют с рецепторами на поверхности клеток и таким образом определяют, какими тканями будет захватываться данный тип липопротеинов; служат ферментами или активаторами ферментов, действующих на липопротеины. В организме синтезируются следующие типы липопротеинов (см. ниже приложение 2): хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП). Каждый из типов ЛП образуется в разных тканях и транспортирует определённые липиды. Например, ХМ транспортируют экзогенные (пищевые жиры) из кишечника в ткани, поэтому триацилглицеролы составляют до 85% массы этих частиц. ЛП хорошо растворимы в крови, не коалесцируют, так как имеют небольшой размер и отрицательный заряд на поверхности. Некоторые ЛП легко проходят через стенки капилляров кровеносных сосудов и доставляют липиды к клеткам. Большой размер ХМ не позволяет им проникать через стенки капилляров, поэтому из клеток кишечника они, сначала попадают в лимфатическую систему и потом через главный грудной проток вливаются в кровь вместе с лимфой. ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ Жиры, образовавшиеся в результате ресинтеза в клетках слизистой оболочки кишечника, упаковываются в ХМ. Основной апопротеин в составе ХМ - белок апоВ-48. Этот белок закодирован в том же гене, что и белок ЛПОНП - В-100, который синтезируется в печени. В кишечнике в результате посттранскрипционных превращений "считывается" последовательность мРНК, которая кодирует только 48% от длины белка В-100, поэтому этот белок называется апоВ-48. Белок апоВ-48 синтезируется в шероховатом ЭР и там же гликозилируется. Затем в аппарате Гольджи происходит формирование ХМ, называемых "незрелыми". По механизму экзоцитоза они выделяются в химус, образующийся в лимфатической системе кишечных ворсинок, и через главный грудной лимфатический проток попадают в кровь. В лимфе и крови с ЛПВП на ХМ переносятся апопротеины Е (апоЕ) и С-П (апоС-П); ХМ превращаются в "зрелые". ХМ имеют довольно большой размер, поэтому после приёма жирной пищи они придают плазме крови опалесцирующий, похожий на молоко, вид. ХМ транспортируют жир к различным тканям, где он утилизируется, поэтому концентрация ХМ в крови постепенно снижается, и плазма опять становится прозрачной. ХМ исчезают из крови в течение нескольких часов. При редком наследственном заболевании - дефекте гена апопротеина В - нарушается синтез белков апоВ-100 в печени и апоВ-48 в кишечнике. В результате в клетках слизистой оболочки кишечника не формируются ХМ, а в печени - ЛПОНП. В клетках этих органов накапливаются капельки жира. Такое заболевание называется абеталипопротеинемия, так как второе название ЛПОНП - пре-β-липопротеины. Биохимические процессы переваривания белков Процессы переваривания белков решают следующие задачи: · под действием протеолитических ферментов, входящих в состав желудочно-кишечных секретов происходит гидролиз пептидных связей и образование в конечном итоге свободных АМК; · облегчается транспорт продуктов переваривания во внутреннюю среду организма; · молекулы белков в процессе гидролиза лишаются видовой специфичности, а продукты переваривания не обладают антигенными свойствами; · пищеварение белков является основным поставщиком экзогенных аминокислот в организм. Метаболизм аминокислот. Свободные аминокислоты всасываются и после транспорта кровью включаются в клетках в различные метаболические пути, главным из которых является синтез собственных белков, а также других азот содержащих соединений, например таких, как тироксин, адреналин, гистамин, выполняющих специфические функции. Аминокислоты используются в процессах генерации энергии, включаясь в реакции катаболизма. Источники аминокислот и пути их использования представлены на рис. 2. Гидролиз тканевых белков (~ 400 г в сутки) не обеспечивает затрат аминокислот, необходимых при использовании их как исходных веществ для катаболизма или синтеза других азотсодержащих соединений. Синтез аминокислот из углеводов также не обеспечивает всех потребностей организма, так как из углеводов возможен синтез лишь углеродной части аминокислот, называемых заменимыми. Следовательно, основным источником аминокислот в организме являются белки пищи человека или корма животных. Состояние белкового обмена характеризует азотистый баланс — это разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (в основном в составе мочевины). 95% всего азота в организме приходится на долю аминокислот. Следовательно, азотистый баланс характеризует состояние белкового и аминокислотного обмена. Азотистое баланс (равновесие) – количество выводимого азота равно количеству поступающего характерно для здорового человека с нормальным ритмом питания. Положительный азотистый баланс – выводится азота меньше, чем поступает, имеет место в период роста организма или при выздоровлении после истощающих заболеваний. Отрицательный азотистый баланс – выводится азота больше, чем поступает) наблюдается при тяжелых, истощающих заболеваниях, голодании, старении. Переваривание белков В желудочно-кишечном тракте белки подвергаются гидролитическому расщеплению до аминокислот-мономеров, которые всасываются и затем поступают в клетки.
Рис. 2. Источники и пути использования аминокислот: а — синтез из углеводов (возможен только для группы заменимых аминокислот). Выбор одного из метаболических путей (б, в, г) зависит от строения аминокислоты, физического состояния организма и регуляции
Эндопептидазы: пепсин, трипсин и химотрипсин, расщепляют пептидные связи, расположенные во внутренних участках полипептидной цепи. Они синтезируются в виде неактивных предшественников – проферментов. Таким способом секретирующие клетки защищают свои собственные белки от разрушения этими ферментами. После секреции проферменты активируются в просвете желудка или кишечника путем частичного протеолиза[1] (табл.1). В норме слизистая оболочка желудка и кишечника защищена от действия протеаз слоем слизи. Кроме того, поверхностный полисахаридный слой плазматической мембраны также предохраняет клетку от действия протеаз. Таблица 1
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-20; просмотров: 75; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.218.215 (0.084 с.) |