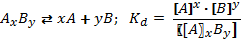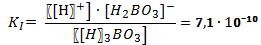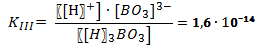Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные способы получения кислотСтр 1 из 2Следующая ⇒
Урок: Кислоты Классификация кислот Кислоты – это вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными связями. Чем больше поляризована связь между атомом водорода, способным отщепляться, и электроотрицательным атомом (кислорода, серы или атомом галогена), то тем более эта связь склонна диссоциировать по гетеролитическому пути. А значит, тем больше в растворе будет катионов водорода и тем кислее будет среда. Большое значение имеет не только полярность, но и поляризуемость связи. Поляризуемость – это способность связи поляризоваться под действием определенных реагентов. Например, молекул воды. Классификация кислот Классификация кислот по содержанию атомов кислорода, по количеству атомов водорода, по растворимости и другим признакам. См. Табл. 1.
Табл. 1. Химические свойства кислот 1. Реакция с металлами. Металлы, расположенные в ряду напряжений металлов (Рис. 1.) до водорода, вытесняют водород из кислот. Mg + 2HCl = MgCl2 + H2↑
Рис. 1. С концентрированной азотной и серной кислотой реакции идут за счет анионного остатка. Водород не выделяется. Рис. 2. Cu + 4HNO3(конц) = Cu (NO3)2 + 2NO2↑ + H2O Cu + 2H2SO4(конц) = Cu SO4 + SO2↑ + H2O
Рис. 2 2. Реакция с основными и амфотерными оксидами с образованием соли и воды. K2O+ HNO3 = KNO3 + H2O Al2O3 + 6HCl = 2AlCl3 + 3H2O 3. Реакция с солями. Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок, поскольку образование нерастворимых соединений смещает равновесие вправо и делает её практически необратимой. Н2SO4 + BaCl2 = BaSO4↓ +2 HCl H2CO3 + BaCl2 = BaCO3↓ +2 HCl 4. Реагируют с основаниями и амфотерными гидроксидами. KOН+ HNO3 = KNO3 + H2O Al(OН)3 + 3HCl = AlCl3 + 3H2O
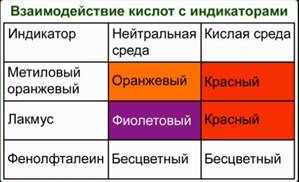
NaOH + HNO3 = NaNO3 + H2O 5. Обнаружение кислот при помощи кислотно-основных индикаторов. В кислой среде лакмус приобретает красную окраску. Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный.
Рис. 3 Получение кислот Подведение итога урока В ходе урока были изучены такие неорганические соединения, как кислоты. Вы узнали о классификации кислот, их химических свойствах и методах получения. ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ 1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный. Диссоциирует в водном растворе практически нацело: HNO3 → H+ + NO3- Изменение цветов индикаторов в кислотах Реагирует с основаниями HNO3 + NaOH → NaNO3 + H2O H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O H+ + OH- → H2O Реагирует с неметаллами. Азотная кислота превращается в NO (или в NO2); неметаллы окисляются до соответствующих кислот: Видео "Взаимодействие азотной кислоты с углем" S0 + 6HNO3(конц) → H2S+6O4 + 6NO2 + 2H2O B0 + 3HNO3 → H3B+3O3 + 3NO2 3P0 + 5HNO3 + 2H2O → 5NO + 3H3P+5O4 HNO 3 (конц.) + неметалл = окисление неметалла до кислоты в высшей степени окисления + NO 2 + вода HNO 3 (разбав.) + неметалл + вода = окисление неметалла до кислоты в высшей степени окисления + NO
ВИДЕО - ЭКСПЕРИМЕНТЫ Видео - Эксперимент " Индикаторы в азотной кислоте" Видео - Эксперимент "Действие азотной кислоты на белки" Видео - Эксперимент "Действие азотной кислоты на бумагу и солому" Видео - Эксперимент "Взаимодействие меди с азотной кислотой" Видео - Эксперимент "Свойства азотной кислоты" Видео - Эксперимент "Взаимодействие азотной кислоты с металлами" Видео - Эксперимент "Взаимодействие безводной азотной кислоты с белым фосфором" Видео - Эксперимент "Взаимодействие безводной азотной кислоты с углем" Видео - Эксперимент "Взаимодействие безводной азотной кислоты со скипидаром" Видео - Эксперимент "Окислительные свойства азотной кислоты"
Урок: Кислоты Классификация кислот Кислоты – это вещества молекулярного строения. Атомы в молекулах кислот связаны ковалентными полярными связями. Чем больше поляризована связь между атомом водорода, способным отщепляться, и электроотрицательным атомом (кислорода, серы или атомом галогена), то тем более эта связь склонна диссоциировать по гетеролитическому пути. А значит, тем больше в растворе будет катионов водорода и тем кислее будет среда. Большое значение имеет не только полярность, но и поляризуемость связи. Поляризуемость – это способность связи поляризоваться под действием определенных реагентов. Например, молекул воды.
Классификация кислот Классификация кислот по содержанию атомов кислорода, по количеству атомов водорода, по растворимости и другим признакам. См. Табл. 1.
Табл. 1. Химические свойства кислот 1. Реакция с металлами. Металлы, расположенные в ряду напряжений металлов (Рис. 1.) до водорода, вытесняют водород из кислот. Mg + 2HCl = MgCl2 + H2↑
Рис. 1. С концентрированной азотной и серной кислотой реакции идут за счет анионного остатка. Водород не выделяется. Рис. 2. Cu + 4HNO3(конц) = Cu (NO3)2 + 2NO2↑ + H2O Cu + 2H2SO4(конц) = Cu SO4 + SO2↑ + H2O
Рис. 2 2. Реакция с основными и амфотерными оксидами с образованием соли и воды. K2O+ HNO3 = KNO3 + H2O Al2O3 + 6HCl = 2AlCl3 + 3H2O 3. Реакция с солями. Кислоты реагируют с растворами солей, если в результате реакции один из продуктов выпадает в осадок, поскольку образование нерастворимых соединений смещает равновесие вправо и делает её практически необратимой. Н2SO4 + BaCl2 = BaSO4↓ +2 HCl H2CO3 + BaCl2 = BaCO3↓ +2 HCl 4. Реагируют с основаниями и амфотерными гидроксидами. KOН+ HNO3 = KNO3 + H2O Al(OН)3 + 3HCl = AlCl3 + 3H2O NaOH + HNO3 = NaNO3 + H2O 5. Обнаружение кислот при помощи кислотно-основных индикаторов. В кислой среде лакмус приобретает красную окраску. Метиловый оранжевый – красную, а фенолфталеиновый – бесцветный.
Рис. 3 Получение кислот Основные способы получения кислот 1. Бескислородные кислоты можно получить из простых веществ. H2 + Cl2 H2 + S 2. Кислородсодержащие кислоты можно получить гидратацией соответствующих кислотных оксидов. N2O5 + H2O → 2HNO3 SO3 + H2O → H2SO4 3. Получение кислот вытеснением слабых кислот сильными, летучих – нелетучими, растворимых – нерастворимыми. Например, сильная соляная кислота вытесняет слабую уксусную из растворов их солей. СH3COONa + HCl = CH3COOH + NaCl NaСl (тв.) + H2SO4= NaНSO4 + HCl↑ 4. Кислоты можно получить при гидролизе некоторых солей или галогенидов. Al2 S3 +6 H2O → 2Al (OH)3↓+ 3H2S↑ PCl5 + H2O → H3PO4 + 5HCl Теории кислот и оснований
Рис. 4. Существует большое количество теорий кислот и оснований. Одна из первых – это появившаяся в конце XVIII века благодаря Антуану Лавуазье (рис. 4), согласно которой кислотные свойства связывались с наличием в веществе кислорода. Именно благодаря этой теории появилось название элемента №8 (кислород – рождающий кислоты). Но эта гипотеза очень быстро доказала свою несостоятельность, когда стал известен целый ряд кислот, не содержащих кислород, например галогеноводородные кислоты.
Рис. 5. Теория кислот и оснований Сванте Аррениуса (рис. 5). Она базируется на теории электролитической диссоциации. Согласно ей, кислоты – это вещества, образующие в водном растворе гидратированные ионы водорода и анионы кислотного остатка. А соответственно, основания – это вещества, диссоциирующие в водном растворе на катионы металла и анионы гидроксогруппы. Теория Брёнстеда и Лоури. Согласно этой теории, кислоты – это молекулы или ионы, которые в данной реакции являются донорами протонов, а основания – это молекулы или ионы, которые принимают протоны, т. е. акцепторы. В органической химии существует теория Льюиса (рис. 6). Кислота – это молекула или ион, имеющая вакантные валентные орбитали, вследствие чего они способны принимать электронные пары, например, ионы водорода, ионы металлов, некоторые оксиды, а также ряд солей. Кислоты Льюиса, не содержащие ионов водорода, называются апротонными. Протонсодержащие кислоты рассматриваются, как частный случай класса кислот.
Рис. 6. Основание по теории Льюиса – это молекула или ион, способные быть донорами электронных пар: все анионы, аммиак, амины, вода, спирты, галогены. Пример реакции между кислотами и основаниями Льюиса. AlCl3+ Cl- → Cl4- Это взаимодействие лежит в основе галогенирования ароматических соединений. Теория Усановича (Рис. 7). В этой теории кислота – это частица, которая способна отщеплять катионы или присоединять анионы. Соответственно, основание наоборот. Этой теорией пользуются очень редко, потому что она получилась слишком общей. Согласно ей, любые взаимодействия с участием ионов можно свести к кислотно-основным. А это не очень удобно.
Рис. 7. Константа диссоциации Для количественной характеристики того, как кислота диссоциирует на ионы, кроме понятия степени электролитической диссоциации используют понятие константа диссоциации. Константа диссоциации – это вид константы равновесия, которая показывает склонность некоторого большого объекта (кислоты, соли или комплексного соединения) обратимо диссоциировать с образованием более маленьких объектов. Константа диссоциации определяется как произведение концентраций ионов в степени их стехиометрических коэффициентов, делённое на недиссоциированную форму.
В случае диссоциации вещества с многовалентными ионами, диссоциация происходит ступенчато. Для каждой ступени существует собственное значение константы диссоциации. Пример диссоциации трехосновной борной кислоты H 3 BO 3. I ступень: Н3ВО3 ↔ Н+ + Н2ВО3- I ступень: Н2ВО3- ↔ Н+ + НВО32- I ступень: НВО32- ↔ Н+ + ВО33- Выражение констант диссоциации по каждой из этих ступеней будет выглядеть так:
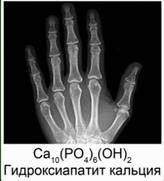
Из значения констант диссоциации делаем вывод, что многоосновные вещества в основном диссоциируют по первой ступени. Неорганические кислоты в организме человека В организме человека большую роль играют три неорганических кислоты. Это – фосфорная кислота, угольная и соляная. Фосфорная кислота входит в состав буферных систем крови. Буферными называются такие растворы, которые при добавлении небольших количеств кислот или оснований изменяют свой водородный показатель рН. Эти системы нужны для того, чтобы поддерживать кислотность крови в определенном и довольно узком интервале. Остатки фосфорной кислоты входят в остатки многих биологически активных веществ, например нуклеиновых кислот и многих ферментов. Наши кости состоят из гидроксида фосфата кальция Сa10(PO4)6(OH)2 или гидроксиапатита кальция, а зубы включают в себя фторапатит кальция Сa10(PO4)6F2. Рис. 8.
Рис. 8. Угольная кислота также входит в состав буферных систем крови. За счёт действия легких такие системы можно быстро и легко регулировать и можно варьировать количество углекислого газа в крови. Соляная кислота содержится в желудочном соке. Она способствует денатурации и набуханию белков, что облегчает их последующее расщепление ферментами. Она создает кислую среду, необходимую для действия ферментов. Она ответственна за антибактериальную среду желудочного сока. Подведение итога урока В ходе урока были изучены такие неорганические соединения, как кислоты. Вы узнали о классификации кислот, их химических свойствах и методах получения. ХИМИЧЕСКИЕ СВОЙСТВА ОБЩИЕ С ДРУГИМИ КИСЛОТАМИ 1. Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный. Диссоциирует в водном растворе практически нацело: HNO3 → H+ + NO3- Изменение цветов индикаторов в кислотах
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-12; просмотров: 48; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.32.86 (0.073 с.) |


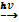 2HCl
2HCl H2S
H2S