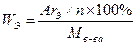Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вывод формулы вещества на основе общей формулы гомологического ряда органических соединений.
Задача 1. Массовая доля хлора в составе монохлорпроизводного алкана 55,04%. Определить его молекулярную формулу. Решение: Формула монохлорпроизводного алкана СnН2n+1Cl
Подставляем все численные данные в эту формулу: 55,04% (Cl)=(35,5×1×100%)/(12n+2n+1+35,5) 0,5504×(14n+36,5)=355 7,7056n+ 20,0896=35,5 n=2 Ответ: С2Н5Cl. Задача 2. Массовая доля водорода в смеси двух предельных углеводородов, отличающихся на один атом водорода, равна 0,1683. Определите углеводороды, входящие в состав смеси. Решение. Общая формулу предельного углеводорода СnН2n+2, его молярная масса M=14n+2. Массовая доля водорода рассчитывается по формуле:
w (Н)=(2n+2)×Аr(Н)/М(в-ва) w (Н)=(2n+2)/14n+2 0,1683(14n+2)=2n+2 n=4,67 n-дробное, поскольку относится к смеси двух соседних гомологов. Очевидно, что это бутан и пентан, так как (n) находится в промежутке от 4 до 5. Ответ: С4Н10 и С5Н12. Задача 3. Определите молекулярную формулу алкена, если в продукте его гидробромирования массовая доля водорода в 2,51 раза меньше, чем в исходном алкене. Решение: Напишем уравнение реакции в общем виде: СnH2n +HBr→CnН2n+1Вr Рассчитываем массовые доли водорода: в алкене: w1(Н) =(Аr(Н) ×n(Н))/M(CnН2n) w1(Н)=1×2n/14n=0,143 в бромалкане: w2(Н)=(Аr(Н) ×n(Н))/M(CnН2n+1Вr) w2(Н)=1(2n+1)/(14n+81) Для нахождения n составляем алгебраическое уравнение: w1(Н)/ w2(Н)=2,51 0,143(14n+81)/(2n+1)=2,51 n=3 Ответ: С3Н6. Задача 4. Массовая доля кислорода в одноатомном спирте равна 26,67%. Определите формулу спирта. Решение: Общая формула гомологического ряда предельных спиртов СnН2n+1ОН
Подставляем данные в эту формулу: 0,2667 (О)=16×1/(12n+2n+1+17) 0,2667(14n+18)=16 3,7338n+4,8006=16 n=3 Ответ: С3Н7ОН. Задача 5. Массовая доля водорода у одного из гомологов щавеливой кислоты равна 3,85%. Определить формулу кислоты. Решение: Щавеливая кислота и ее гомологи содержат две карбоксильные группы и поэтому общая формула их: СnН2n(СООН)2 или СnН2n-2О4. Для решения этой задачи легче работать со второй формулой.
0,0385=1(2n-2)/(12n+2n-2+16×4) 0,0385(14n+62)=2n-2 n=3 Ответ: СООН-СН2-СООН Задача 6. Массовая доля кислорода в сложном эфире, образованном 2-аминопропановой кислотой, равна 0,2735. Определить формулу эфира. Решение: Сложные эфиры- продукты реакции взаимодействия кислот со спиртами (р-я этерификации). Общая формула такого эфира для данной задачи имеет вид:
СН3СН(NН2)СООСnН2n+1
Подставляем в это уравнение численные данные: 0,2735=16×2/(12×3+6+14+32+12n+2n+1) 0,2735(14n+89)=32 n=2 Ответ: СН3СН(NН2)СООС2Н5. Задача 7. Определите структурную формулу кетона, полученного пиролизом кальциевой соли предельной одноосновной карбоновой кислоты с массовой долей кальция 21,5%. Решение: Общая формула кальциевой соли карбоновой кислоты имеет вид: (СnН2n+1СОО)2Са
Из этой формулы можно выразить молярную массу вещества: M(в-ва)= Аr(Са) ×1×100%/21,5% M(в-ва)= 40×1/0,215=186 2(12n+2n+1+44)+40=186 n =2, следовательно, формула соли (С2Н5СОО)2Са. Пиролиз соли- это разложение соли при температуре без доступа кислорода воздуха: (С2Н5СОО)2Са (t)→СН3-СН2-СО-СН2-СН3 + СаСО3 Ответ: диэтилкетон. Задача 8. Относительная плотность паров ароматического амина по метану равна 6,6875. Выведите его молекулярную формулу. Решение: Общая формула ароматических аминов СnН2n-5N. Относительная плотность данного соединения: D(СН4)=M(СnН2n-5N)/M(СН4) M(СnН2n-5N)= D(СН4) ×M(СН4) M(СnН2n-5N)=6,6875×16 г/моль=107 г/моль Составляем уравнение: 12n+2n-5+14=107 n=7 Ответ: С7Н9N. Задача 9. Массовая доля серы в составе соли, полученной при взаимодействии ароматического первичного амина с избытком серной кислоты, равна 15,60%. Определите молекулярную формулу амина. Решение. Выведем общую формулу ароматических аминов и напишем уравнение реакции с образованием кислой соли (в условии задачи отмечен избыток кислоты): СnН2n-5N +Н2SО4→ СnН2n-5NН×НSО4
Из этой формулы можно выразить молярную массу вещества: M(в-ва)= Аr(S) ×1×100%/15,6% M(в-ва)= 32×1/0,156=205 г/моль Составляем уравнение и найдем n: 12n+2n-5+14+1+32+1+16×4=205 14n=98 n=7 Ответ: С7Н9N. Задача 10. В водном растворе с массовой долей предельного одноатомного спирта 40% соотношение между числом молекул воды и спирта равно соответственно 8:3. Установить формулу спирта. Решение. Пусть масса раствора спирта равна 100 г. Тогда масса спирта в этом растворе равна 100×0,4=40 г, а масса воды составляет 100-40=60 г. Найдем количество вещества спирта и воды: ν(СnН2n+1ОН)=m/M=40/(14n+18) моль, ν(Н2О)=m/M=60/18 =3,33 моль, Отношение числа молекул равно отношению их количеств:
N(Н2О):N(СnН2n+1ОН)= ν(Н2О): ν(СnН2n+1ОН). По условию задачи ν(Н2О): ν(СnН2n+1ОН)=8:3 3,33: 40/(14n+18)=8:3, n=1, СН3ОН. Ответ: СН3ОН- метанол.
Задачи для самостоятельного решения. 1. Масса неизвестного объема воздуха равна 0,123 г, а масса такого же объема газообразного алкана 0,246 г (при одинаковых условиях). Определить молекулярную формулу алкана. 2. Пары одного из дибромалканов в 101 раз тяжелее водорода. Определите молекулярную формулу этого дибромалкана. 3. Вывести формулу бромалкана, если содержание брома в нем 73,4%. 4. Вывести формулу дихлоралкана, если содержание хлора с соединении 55,9%. 5. Вывести формулу иодалкана, если содержание йода в нем 81,4%. 6. Определите молекулярную формулу фторпроизводного алкана, в 34,27 г которого содержится 17,44 г фтора. 7. Массовая доля хлорав составе дихлорпроизводногоалкана равна 0,7171. Какова его формула? 8. Определить формулу хлорпроизводного пропана, в 32 г которого содержится 20,1 г хлора. 9. Установите молекулярную формулу трихлоралкана, массовая доля хлора в котором составляет 72,2%. Составить структурные формулы изомеров. 10. Определите молекулярную формулу хлорпроизводного алкана, в 35,24 г которого содержится 23,83 г хлора. 11. Плотность алкана составляет 1,96 г/л (н.у.). Определите молекулярную формулу углеводорода. 12. Плотность паров циклоалкана по водороду равна 42. Молекула циклоалкана не имеет боковых ответвлений от главной углеродной цепи. Определить формулу циклоалкана. 13. Пары некоторого монохлоралкена в 2,155 раз тяжелее воздуха. Установите молекулярную формулу этого соединения. 14. Относительная молекулярная масса продукта взаимодействия алкена с бромоводородом в 2,45 раза больше, чем молекулярная масса алкена. Установите формулу алкена. 15. Плотность паров по кислороду продукта взаимодействия избытка бромной воды с алкеном 6,75. Какова формула алкена? 16. Вывести формулу дихлоралкена, если содержание углерода в соединении 32,4%. 17. Определите молекулярную формулу алкена, если известно, что массовая доля водорода в продукте его окисления (в условиях реакции Вагнера) равна массовой доле водорода в воде. 18. Плотность паров по кислороду продукта взаимодействия избытка бромной воды с алкеном 6,75. Какова формула алкена? 19. Вывести формулу алкина, если при его галогенировании образуется дихлоралкен с содержанием хлора в нем 64,6%. 20. При гидробромировании неизвестного диена получили монобромпроизводное с массовой долей брома в 1,57 раз меньше, чем массовая доля брома в бромметане. Определите формулу диена. Составьте структурные формулы изомерных диенов такого состава с кумулированными двойными связями.
21. Определите молекулярную формулу диенового углеводорода, если после полного гидрохлорирования его относительная молекулярная масса увеличилась в 2,35 раза по сравнению с исходным диеном. 22. Определите молекулярную формулу одноосновной ароматической кислоты, если плотность паров ее по воздуху равна 5,17. Напишите структурные формулы изомерных ароматических кислот, дайте им названия. 23. Установите молекулярную формулу предельного одноатомного спирта, если известно, что плотность его паров по воздуху равна 2,55 и он не окисляется оксидом меди (II) при нагревании. 24. Установите молекулярную формулу предельного одноатомного спирта, содержащего 26,67% кислорода. Приведите названия возможных изомеров этого спирта. 25. При взаимодействии алканола с избытком натрия образовался алкоголят с массовой долей натрия в нем 0,2805.Какова формула спирта? 26. Установите молекулярную формулу предельного трехатомного спирта, массовая доля кислорода в котором равна 45,28%. 27. Установите молекулярную формулу предельного двухатомного спирта, массовая доля кислорода в котором равна 42,11%. 28. Установите молекулярную формулу предельного двухатомного спирта, массовая доля углерода в котором равна 53,33%. 29. Определите молекулярную формулу двухатомного спирта, если его неполный эфир с уксусной кислотой содержит 32,87% кислорода. Приведите структурную формулу спирта, если при полной дегидратации его образуется диен, фрагмент которого является структурным звеном натурального каучука. Напишите уравнения реакций и дайте названия органическим веществам. 30. Установите молекулярную формулу предельного трехатомного спирта, массовая доля водорода в котором в 5 раз меньше, чем массовая доля углерода. 31. Определите молекулярную формулу предельного трехатомного спирта, в 31,25 г которого содержится 14,15 г кислорода. 32. Определите молекулярную формулу двухатомного фенола, содержащего 7,25% водорода. Сколько изомерных двухатомных фенолов соответствует найденной формуле?
33. Установите формулу предельного альдегида, в котором суммарная масса углерода и водорода в 3,5 раза больше массы кислорода. 34. Определите молекулярную формулу альдегида, плотность паров которого по водороду равна 36. Составьте структурные формулы его возможных изомеров. 35. Выведите молекулярную формулу альдегида, если продукт взаимодействия его с синильной кислотой (НCN) содержит 16,47% азота. Составить соответствующее уравнение реакции. 36. Установите молекулярную формулу альдегида, если при взаимодействии его с избытком этилового спирта образуется соединение, в котором массовая доля углерода равна 61,02%. Написать уравнение реакции. 37. Установить молекулярную формулу предельного насыщенного альдегида, в котором массовая доля кислорода равна 27,59%. 38. Предельную монокарбоновую кислоту массой 14,56 г растворили в 80 г воды и получили раствор, 1 л которого содержит 2,61 моль кислоты (пл.1,02 г/мл). Установите формулу кислоты. 39. Выведите молекулярную формулу предельной одноосновной кислоты, пары которой в 3,03 раза тяжелее воздуха. 40. Массовая доля углерода в предельной одноосновной карбоновой кислоте составляет 54,6%. Установите формулу кислоты. 41. Установите молекулярную формулу одноосновной предельной карбоновой кислоты, если массовая доля углерода в ней составляет 58,82%. Составьте структурные формулы всех возможных изомеров и дайте им названия. 42. Установите молекулярную формулу одноосновной карбоновой кислоты, если она вступает в реакцию Кучерова, а массовая доля кислорода в ней составляет 45,71%. Напишите структурную формулу кислоты, дайте ей название, составьте уравнение реакции. 43. Массовая доля кислорода в двухосновной насыщенной карбоновой кислоте равна 54,23%. Что это за кислота и какая масса ее нужна для полной нейтрализации 2 г едкого натра с образованием средней соли? 44. Определите состав сложного эфира, относительная плотность паров которого по водороду равна 37. Дайте ему название, если известно, что он вступает в реакцию «серебряного зеркала». 45. Установите молекулярную формулу спирта, входящего в состав сложного эфира пропионовой кислоты, если массовая доля водорода в эфире составляет 10,77%.
46. Молярные массы алканола и предельной монокарбоновой кислоты, в которой на один атом углерода больше, относятся как 7,5:11. Установите формулы веществ. 47. Относительная плотность паров предельного амина по кислороду равна 1,844. Выведите молекулярную формулу амина. 48. Массовая доля углерода в диамине равна 48,65%, массовая доля азота равна 37,84%. Выведите молекулярную формулу диамина. 49. Массовая доля углерода в моноамине равна 63,16%, массовая доля азота равна 24,56%. Выведите молекулярную формулу амина. 50. Установите молекулярную формулу предельного амина, содержащего 23,73% азота по массе. Приведите названия возможных изомеров такого состава. 51. Определите формулу вторичного амина, если продукт его взаимодействия с НСI содержит 43,55% хлора по массе. 52. Первичный амин образует с бромоводородом соль, в которой массовая доля брома равна 71,4%. Выведите молекулярную формулу амина. 53. Определите формулу предельного вторичного амина, если известно, что его хлороводородная соль содержит 43,55% хлора. 54. Массовая доля кислорода в предельном эфире аминоуксусной кислоты составляет 27,35%. Найти возможные структурные формулы этого эфира 55. Определите строение сложного эфира, образованного предельным одноатомным спиртом и аминокислотой, в котором массовая доля азота 15,73%.Дать название. 56. Определите относительную молекулярную массу и возможное строение предельного сложного эфира моноаминокарбоновой кислоты, если известно, что он содержит 13,6% азота. Сколько изомерных сложных эфиров могут соответствовать найденной молекулярной формуле? 57. Выведите молекулярную формулу моноаминокарбоновой кислоты, массовая доля азота в которой составляет 11,97%. 58. Предельный одноатомный спирт вступил в реакцию этерификации с аминоуксусной кислотой. В полученном эфире массовая доля азота 15,7%. Определить формулу эфира. 59. Определите формулу сложного эфира аминоуксусной кислоты, массовая доля кислорода в котором составляет 36%. 60. Массовая доля кислорода в молекуле предельной монокарбоновой моноаминокислоты составляет 24,43%. Выведите молекулярную формулу аминокислоты, составьте структурные формулы 4-х ее изомеров и дайте им названия. 61. Двухосновная кислота имеет следующий состав: углерода-45,4%, водорода- 6,1%, кислорода- 48,5%. Найдите по этим данным молекулярную формулу кислоты, определите число возможных изомеров этого класса. Ответы: 1. С4Н10 2. С3Н6Вr2 3. С2Н5Вr 4. С4Н8Сl2 5. С2Н5I 6. С4Н7F3 7. С2Н4Cl2 8. С3Н6Сl2 9. С3Н5Сl3 10. C5H8Cl4 11. С3Н8 12. С6Н12 13. С2Н3СI 14. С4Н8 15. С4Н8 16. С3Н4Сl2 17. С4Н8 18. С4Н8 19. С3Н4 20. С5Н8 21. С4Н6 22. С9Н10О2 23. (СН3)3СОН 24. С3Н8О 25. С3Н7ОН 26. С4Н10О3 27. С3Н8О2 28. С4Н10О2 29. С5Н12О2, 2-метилбутандиол-1,4. 30. С5Н12О3 31. С4Н7(ОН)3 32. С8Н10О2, 15 изомеров 33. С4Н8О 34. С4Н8О 35. С3Н6О 36. С2Н4О 37. С3Н6О 38. СН3СООН 39. С4Н8О2 40. C4H8O2 41. С5Н10О2 42. С3Н2О2 43. Бутандиовая к-та, 2,95 г 44. Этилформиат 45. С4Н9ОН 46. С3Н8О и С4Н8О2 47. С3Н9N 48. С3Н10N2 49. С3Н7N 50. С3Н9N 51. Диметиламин 52. СН3NН2 53. (СН3)2NН 54. С5Н11О2N 55. Метилглицинат 56. С4Н7NН2О2, 3 изомера 57. С4Н6(NН2)СООН 58. Метилглицинат 59. Метилглицинат 60. С5Н13О2N 61. С5Н8О4.
Раздел VII. Задачи с использованием числа Авогадро. Задача 1. Для сжигания порции алкана, содержащей 1×1023молекул, требуется порция кислорода, содержащая 1,6×1024 атомов. Установите состав и возможное строение (все изомеры) алкана. Решение: Составим уравнение реакции горения алкана через общую формулу: СnН2n+2 + (1,5n+05)О2→nСО2 + (n+1)Н2О Используя формулу N=Nа×n найдем количество алкана и количество атомов кислорода: ν (СnН2n+2)=N/Nа=1×1023/6,02×1023=0, 166 моль ν (О)= N/Nа=1,6×1024/6,02×1023=2,658 моль- это число атомов кислорода, а в реакцию вступает вещество (О2) кислород, следовательно, необходимо сделать перерасчет: 1 моль вещества (О2) содержит 2 моль атомов кислорода х моль вещества (О2) содержит 2,658 моль атомов кислорода ν (О2)=1,329 моль Составляем соотношение между количеством вещества кислорода и алканом: ν (СnН2n+2): ν (О2)=1:(1,5n+05) (по уравнению), а на самом деле как 0,166: 1,329 0,166(1,5n+0,5)=1,329 n=5 Ответ: С5Н12, 3 изомера. Задача 2. В состав 3 моль углеводорода входит 7,2×1024 атомов углерода и 1,8×1025 атомов водорода. Определить молекулярную формулу углеводорода. Решение. Найдем число атомов углерода и водорода: ν(С)=N/Nа=7,2×1024/6,02×1023=12 ν(Н)=N/Nа=1,8×1025/6,02×1023=30 Составляем уравнение: 3 моль СхНy содержат 12 моль атомов (С) 1 моль СхНy содержат ν(моль) атомов (С) ν(С)=4; 3 моль СхНy содержат 30 моль атомов (Н) 1 моль СхНy содержат ν(моль) атомов (Н) ν(Н)=10. Ответ: С4Н10.
Задачи для самостоятельного решения. 1. На сжигание порции алкена, содержащей 2×1023 молекул, требуется 1,8×1024 атомов кислорода. Какую формулу имеет алкен? 2. При сгорании органического вещества массой 3,1 г образовалось 2,24 л углекислого газа, 1,12 л азота, 4,5 г воды. Масса молекулы вещества равна 5,15×10-23г. Найти молекулярную формулу вещества. 3. При сжигании органического вещества массой 1,78 г в избытке кислорода получили 0,28 г азота, 1,344 л (н.у.) углекислого газа и 1,26 г воды. Определите молекулярную формулу этого вещества, зная, что в навеске массой 1,78 г содержится 1,204×1022молекул. 4. Масса молекулы вещества, в котором массовая доля углерода составляет 62,06%, водорода 10,32%, кислорода 27,58%, равна 9,6346×10-23г. Установить молекулярную формулу вещества. 5. При сжигании 3,6 г органического соединения образовалось 5,28 г оксида углерода (IV) и 2,16 г воды. Масса молекулы этого вещества равна 29,90×10-23г. Найдите молекулярную формулу вещества и составьте структурные формулы двух его изомеров. 6. В состав углеводорода количеством вещества 5 моль входит 2,7×1025 атомов углерода и 6×1025 атомов водорода. Определите молекулярную формулу углеводорода. 7. В состав углеводорода количеством вещества 1,5 моль входит 3,6×1024 атомов углерода и 5,4×1024 атомов водорода. Определить молекулярную формулу углеводорода.
Ответы. 1. С3Н6 2. СН3NН2 3. С3Н7NО2 4. С3Н6О 5. С6Н12О6 6. С9Н20 7. С4Н6
Раздел VIII.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 498; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.172.252 (0.083 с.) |