Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетические ресурсы Земли.Стр 1 из 13Следующая ⇒
Общие сведения. Энергетика - совокупность больших естественных и искусственных систем, предназначенных для получения, преобразования, распределения и использования энергетических ресурсов всех типов. Энергетическими ресурсами называют материальные объекты, в которых сосредоточена возможная для использования человеком энергия. Различают возобновляемые и невозобновляемые энергоресурсы. Возобновляемые энергоресурсы -те, которые природа непрерывно восстанавливает (вода, ветер и др.). Невозобновляемые - ранее накопленные в природе (каменный уголь, нефть и др.). Получение энергии необходимого вида и снабжение этой энергией потребителей происходят в процессе энергетического производства. Выделяют пять стадий | энергопроизводства: 1) получение и концентрация энергоресурсов; 2) передача; энергоресурсов к установкам, преобразующим энергию; 3) преобразование первичной энергии во вторичную; 4) передача и распределение вторичной энергии; 5) потребление энергии. Энергетические ресурсы Земли. Органическое топливо (ископаемое горючее). Топливо - любое вещество или смесь веществ для получения теплоты. По принципу высвобождения энергии различают органическое и ядерное топливо. Органическое топливо выделяет теплоту при окислении (горении) входящих в его состав горючих элементов. Ядерное топливо выделяет теплоту в результате ядерных преобразований. Основным источником используемой человеком энергии остается ископаемое органическое топливо. Всякое пополнение его запасов по мере использования исключено по двум причинам: 1) условия на Земле изменились так, что значительного накопления органического вещества уже не происходит; 2) горючие ископаемые потребляются со скоростью, намного превышающей необходимую для их образования. Нефть и ее использование. Добыча нефти. Разработка нефтяного месторождения начинается с бурения скважин. Буровая скважина использует ряд вращающихся стальных труб высокого давления, называемых установкой. Установка поддерживается буровой вышкой и управляется вращательным столом на платформе. Сначала из скважины бьет нефтяной фонтан, затем переходят на механизированные способы добычи: компрессорную, глубинно-насосную и др. После добычи нефть отделяется от сопутствующих воды и газов и перекачивается в нефтехранилища.
Переработка нефти. Переработка включает три основных процесса: перегонку, риформинг и ректификацию. В результате перегонки нефть разделяется на части - фракции, согласно молекулярному весу. Все фракции получают дальнейшую обработку для производства конечных продуктов. Наиболее ценные горючие продукты получают при химической переработке нефти: крекинге, пиролизе и ароматизации. Крекинг - это разложение высших углеводородов на простые. При сильном нагревании с катализатором (ок.500°С) происходит каталитический крекинг, без катализатора - термический крекинг. При пиролизе нефти (700 - 900°С) образуются этилен, бензол, толуол. Транспорт нефти. Основными видами транспорта являются: трубопроводы, танкеры и железнодорожный транспорт. Расход нефти равен
где μ- вязкость передаваемой нефти; L - длина трубопровода; D -диаметр трубопровода; p1 и p2 – разность давлений в трубе. Уголь и его использование. Уголь образовался из осадков органических веществ в пресной воде доисторических болот; обнаруживается в пластах всех геологических эпох. Последовательность возникновения: Торф Лигнит Бурый уголь Битуминозный уголь Антрацит. Примерное содержание элементов в каменном угле: Cг +Hг2 + Sгл + Ог2 + Nг2 % = 84% + 5% + 2% + 8% + 1%= 100%. Высокая теплота сгорания угля определяется высоким содержанием в нем водорода и углерода. Чем старее уголь, тем выше его качество. Добыча угля ведется как открытым (карьерами), так и подземным (шахтами и штольнями) способами. Выбор способа добычи угля зависит от расположения угольного пласта относительно земной поверхности. Транспорт угля. Во всех странах основными видами транспорта угля является железнодорожный, а между континентами - морской. Разрабатываются варианты транспортировки угольной пульпы по трубопроводам. На большие расстояния (свыше 600 км) перевозят, как правило, только высококачественные угли. Синтетическое топливо. Общий принцип получения синтетического газа показан на рис.1.1.
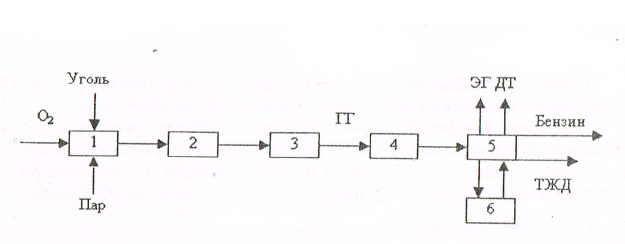
Рис 1.1 1 - подготовка угля к газификации; 2 - дистилляция без доступа воздуха; 3 - дистилляция в присутствии воздуха; 4 - дистилляция в присутствии Н2О и О2; 5 - конверсия водяного газа (СО + Н2О = СО2 + Н2); 6 - очистка газа; 7 - каталитическая метанизация (ЗН2 + СО = СН4 + Н2О); КГ - каменноугольный газ; ЭГ - энергетический газ; СГТ - синтетическое газообразное топливо. Процессы основаны на том, что уголь подвергается перегонке в присутствии либо воздуха, либо водяного пара и кислорода. При газификации угля на воздушном дутье образуется энергетический газ (ЭГ), обладающий относительно низкой теплотой сгорания, который целесообразно использовать только на электростанциях, расположенных на месте его производства. В процессе с парокислородным дутьем (О2 + Н2О) образуется газ более высокого качества, который можно подвергать дальнейшей переработке для получения метана с высокой теплотой сгорания. Этот генераторный газ содержит высокий процент окиси углерода СО и азота N2, поэтому он подвергается очистке в реакторе. Диоксид углерода СО2 и примеси серы H2S удаляются, а оставшийся газ, состоящий в основном из Н2, СО, СН4 и Н20, проходит стадию каталитической метанизации, на которой СО и Н2, вступая в реакцию, образуют метан СН4. Современные газогенераторы имеют производительность от 8,5 до 48,1 тыс. м3/ч. Для производства СЖТ применяется принцип ожижения угля по методу Фишера-Тропша (рис.1.2). Сущность метода состоит в том, что после газификации угля осуществляется каталитическая конверсия получаемого продукта. Используя соответствующий катализатор, можно получить из синтетического газа различные виды углеводородных соединений.
Рис. 1.2. Стадии процесса ожижения угля: 1 - газификация угля; 2 - очистка газа; 3 - конверсия водяного газа; 4 - каталитическая конверсия; 5 - перегонка продуктов сжижения; 6 - полимеризация; ЭГ - энергетический газ: ГГ - генераторный газ; ДТ - дизельное топливо; ТЖТ - тяжелое жидкое топливо
Ядерное топливо (ЯТ). Ядерное топливо (ЯТ) выделяет теплоту в результате ядерных преобразований: деления тяжелых ядер или синтеза легких ядер. Ядерное деление. Цепная ядерная реакция представляет собой деление ядра на две части (осколки деления) с одновременным выделением 2-3 нейтронов, вызывающих деление следующих ядер. Осколки деления обладают большой кинетической энергией. Торможение осколков деления в веществе сопровождается выделением большого количества тепла. Осколки деления и продукты их радиоактивного распада называют продуктами деления, а вещества, претерпевающие деление, - ядерным топливом. В природе встречаются два изотопа урана: 235U и 238U. Ядро 235U неустойчиво и делится при попадании в него нейтронов любых энергий. Ядро 238U устойчиво и делится только при попадании быстрых нейтронов, но вызвать цепную реакцию 238U невозможно. Единственный встречающийся в природе делящийся изотоп 235U относится к не возобновляемым ЭР. Классификация. По происхождению ЯТ делится на два вида: 1) природное урановое (ядра 235U, сырьё 238U, способное при захвате нейтрона образовывать плутоний 239Pu); 2) искусственное топливо (239Pu, изотопы 233U, образующиеся при захвате нейтронов ядрами тория 232Th). По химическому составу различают ЯТ: 1) металлическое; 2) оксидное (UO2); 3) карбидное (РuСх); 5) нитридное; 6) смешанное (PuO2 + UO2).
Добыча урановой руды в зависимости от глубины залегания пластов осуществляется шахтным или карьерным способом. Переработка заключается в отделении полезных минералов от пустой породы и получении химических концентратов урана путем измельчения исходной руды, выщелачивания (перевод урана из руды в раствор). На стадии аффинажа завершается очистка соединений урана от примесей и элементов, обладающих большим сечением захвата нейтронов (гафний, бор и т.д.). Обогащение урана. В реакторе на быстрых нейтронах используется уран с содержанием 235U до 93%. Прежде чем изготавливать топливо, природный уран, содержащий только 0,72% 235U, необходимо обогатить - разделить изотопы 235U и 238U. Используются физические методы разделения изотопов. Изготовление топлива. Обогащенный уран служит исходным сырьем для изготовления ЯТ. Конструкционной основой ЯТ в реакторе является тепловыделяющий элемент (твэл), состоящий из топлива в виде спеченных таблеток и трубчатой оболочки. Твэлы объединяют в тепловыделяющие сборки (ТВС). Изотоп 238U может быть преобразован в элемент, поддерживающий цепную реакцию: 238U + n 239U 239 239Np + β- + γ- 239Рu + β- + γ-. (1.7) Ядра 238U поглощают быстрые нейтроны, обладающие большой энергией. В Образующихся ядрах 239И начинается β распад, имеющий период полураспада 23,5 мин, после чего получается элемент нептуний 239Np. Этот изотоп распадается, испуская β - частицы, и превращается в плутоний 239Рu. Период полураспада равен 2,35 сут. Процесс представляет собой расширенное воспроизводство ЯТ. Хранение отработавшего топлива. Выгоревшие твэлы, извлеченные из реакции, содержат высокоактивные изотопы. Их направляют в бассейн выдержки (хранилище), имеющийся при АЭС. Термоядерный синтез. Изотопы водорода могут воспроизводить ядерные реакции, при которых суммарная масса конечных продуктов меньше, чем суммарная масса веществ, вступивших в реакцию. Разница в массах составляет кинетическую энергию продуктов реакции синтеза. Ядерная реакция, при которой, по крайней мере, одно из образующихся ядер имеет массу, большую, чем масса любого из первоначальных ядер, называется реакцией термоядерного синтеза. Геофизическая энергия. К геофизической энергии относят энергию солнца, воды, ветра и геотермальную энергию. Эти энергоресурсы являются возобновляемыми, экологически чистыми и дешевыми.
Солнечная энергия Солнечная энергия запасена в виде химической энергии органического топлива и превращается в кинетическую энергию движения воды в реках и ветра. Поток солнечного излучения представлен всем спектром электромагнитных волн, но основная масса приходится на ультрафиолетовую, видимую и инфракрасную части спектра. Гидроэнергия. Гидравлическая энергия — одна из форм солнечной энергии: под лучами солнца испаряется вода из озер, рек и морей. Образуются тучи, идет дождь, и вода, в конце концов, возвращается в водные бассейны. С таким круговоротом воды в природе связаны колоссальные количества энергии. В последнее время значительный интерес проявляется к использованию энергии приливов и отливов. Энергия ветра. Энергия ветра также является одной из форм солнечной энергии: ветер возникнет на Земле при неравномерном нагреве ее поверхности Солнцем. На циркуляцию воздушных масс влияет и вращение Земли. Геотермальная энергия. Источником геотермальной энергии является горячая магма, которая проникает из недр Земли и подходит близко к ее поверхности. Источники глубинной теплоты расположены, как правило, вблизи районов геологической активности. Геотермальные месторождения разделяются на следующие виды: 1) гидротермальные системы, залегающие на глубине до 3 км (с преобладанием пара или горячей воды); 2) системы аномально высокого давления (на глубине до 10 км); 3) сухие горячие горные породы (на глубине до 10 км).
Основы теплотехники. На рис 1.3 показаны основные стадии преобразования энергии органического и ядерного топлива в электрическую энергию, присутствующие в различных типам энергетических установок.
Рис.1.3. Стадии преобразования энергии топлива: 1 - химическая энергия топлива; 2 - ядерная энергия топлива; 3 -внутренняя энергия рабочего тела; 4 - кинетическая энергия; 5 -электрическая энергия; СТ - сжигание топлива; РЯТ - распад ядерного топлива; Р - расширение рабочего тела; ВРТ - вращение ротора турбогенератора 1.3.1. Основные положения технической термодинамики. Объектом исследования является термодинамическая система - совокупность макроскопических тел, обменивающихся энергией друг с другом и окружающей средой. Количественное состояние системы характеризуется физическими величинами, называемыми параметрами состояния. К основным параметрам состояния относят: удельный объем v, абсолютное давление Р, температуру Т. Параметрами состояния являются также внутренняя энергия U, энтальпия h, энтропия S. Удельный объем [м3/кг] - величина, определяемая отношением объема вещества (К) к его массе (m): v = V / m. Величину, обратную удельному объему, называют плотностью: ρ = т / V. Абсолютное давление - давление, отсчитываемое от абсолютного нуля давления или от абсолютного вакуума. При давлении сосуда больше атмосферного: Р = Р и + Р 0; при давлении сосуда меньше атмосферного: Р = Р0 - РВ, где Р0 - атмосферное давление; РВ - давление вакуума; Р и - избыточное давление. За единицу давления принят 1Па= 1 н/м2.
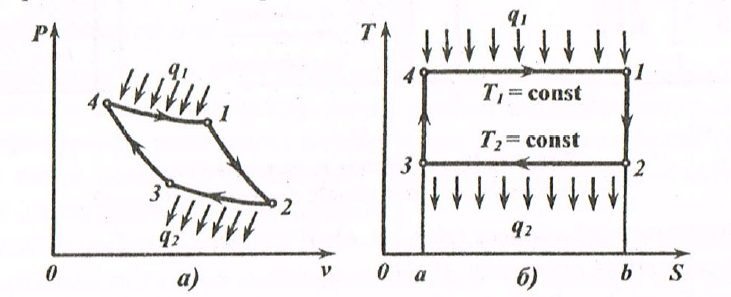
Температура пропорциональна кинетической энергии частиц рабочего тела. Единицей измерения температуры является Кельвин (К). Температуру, измеренную в Кельвинах, обозначают Т, в градусах Цельсия (°С) - t: T = t + 273,15. Состояние тела, при котором во всех точках его объема Р, v, Т и все другие физические свойства одинаковы, является равновесным состоянием. Совокупность изменений состояния термодинамической системы при переходе из одного состояния в другое называется термодинамическим процессом. Первый закон термодинамики. Теплота и работа. Тела, участвующие в термодинамическом процессе обмениваются энергией. Передача энергии от одного тела к другому происходит двумя способами: 1) в форме теплоты 2) в форме работы. Количество энергии, полученное телом в форме работы, называют работой, совершенной над телом, а отданную энергию — затраченной телом работой. Количество теплоты, полученное (отданное) телом, и работа, совершенная (затраченная) над телом, зависят от характера термодинамического процесса, т.е от условий перехода тела из начального состояния в конечное. Внутренняя энергия. В общем случае внутренней энергией называется совокупность всех видов энергий, заключенных в теле или системе тел. В технической термодинамике рассматриваются только такие процессы, в которых изменяются кинетическая и потенциальная составляющие внутренней энергии. Внутренняя энергия (U) является функцией двух основных параметров состояния газа, т.е. U = f (Р, Т); U = f (V, Т); U = f (Р, V). Первый закон термодинамики является законом сохранения и превращения энергии: «Энергия не исчезает и не возникает вновь, она лишь переходит из одного вида в другой в различных физических процессах». Для термодинамических процессов закон устанавливает взаимосвязь между теплотой, работой и изменением внутренней энергии системы: «Теплота, подведенная к системе, расходуется на изменение энергии системы и совершение работы». Уравнение первого закона термодинамики имеет вид: Q = (U 2 - U 1) + A, (1.8) где Q - количество теплоты, подведенное (отведенное) к системе; A - работа, совершенная системой (над системой); (U 2 – U 1) - изменение внутренней энергии в данном процессе. Если: Q > 0 — теплота подводится к системе; Q < 0 - теплота отводится от системы; A > 0 - работа совершается системой; A < 0 - работа совершается над системой. Для элементарного изменения системы выражение (1.8) имеет вид: δ ʹ Q = δU + δ ʹ A. Первый закон термодинамики указывает, что для получения полезной работы в непрерывно действующем тепловом двигателе необходимо подводить (затрачивать) теплоту. Двигатель, постоянно производящий работу и не потребляющий никакой энергии, называется вечным двигателем первого рода. Из этого следует: «Вечный двигатель первого рода невозможен». Количество подведенной (отведенной) к телу теплоты можно определить по выражению: Q = C Δ T, (1.9) где С - теплоемкость тела, Дж /К; Δ T - изменение температуры тела, К. В технических расчетах пользуются понятиями удельной массовой с [Дж/(кг·К)], объемной c ʹ [Дж/(м3·К)] и молярной сμ [Дж/(кмоль·К)] теплоемкости. Связь между с, сʹ и c μ определяется выражением: с = c ʹ ·v = c μ / μ, где v- удельный объем вещества, м3/кг; μ - мольная масса, кг/моль. Количество теплоты определяется соответственно: Q = c · m ·(T 2 - Т1) = c ' VH (T 2 - T 1) = c μ n (T 2 - Tl), где т — масса газа, кг; V Н — объем газа, приведенный к нормальным физическим условиям, м3; п — число молей газа, кмоль. В зависимости от способа подвода теплоты различают теплоемкости при постоянном давлении ср (изобарную) и при постоянном объеме cv (изохорную): ср - μ cv = μ R или cp - cv = R (уравнение Майера). Отношение к = cp / cv называют показателем адиабаты. Уравнение состояния идеального газа выведено в 1834 г. французским физиком Клапейроном имеет вид: P · V = m · RT, (1.10) где R - газовая постоянная, представляет работу газа в процессе при постоянном давлении и при изменении температуры, Дж/(кг·К). Второй закон термодинамики. Основные положения второго закона термодинамики. Превращение работы в теплоту происходит полностью и безусловно. Обратный процесс превращения теплоты в работу возможен только при определенных условиях и не полностью. Теплота сама собой может переходить от более нагретых тел к холодным. Для перехода теплоты от холодных тел к нагретым нужно затратить дополнительную энергию. Формулировки второго закона термодинамики. Для существования теплового двигателя необходимы два источника: горячий и холодный. Если тепловой двигатель работает только от одного источника, то он называется вечным двигателем второго рода. Вечный двигатель второго рода можно осуществить, если теплоту Q передать от холодного источника к горячему. Но для этого теплота самопроизвольно должна перейти от холодного тела к горячему, что невозможно. Отсюда следует вторая формулировка Клаузиуса: «Теплота не может самопроизвольно переходить от более холодного тела к более нагретому». Третья формулировка Карно: «Там где есть разница температур, возможно совершение работы». Энтропия. Это одна из функций состояния термодинамической системы, устанавливающая связь между количеством теплоты и температурой [Дж/К]: δS = δQ / T. Выражение для удельной энтропии [Дж/(кг·К)]: δs = δq / Т. Энтропия является экстенсивным параметром состояния (зависит от массы вещества): S =f,(P, V); S =f2(P, Т); S =f3(V, Т). Для удельной энтропии: s = f 1 (P, v); s = f 2 (P, T); s = f 3 (v, T). Так как энтропия не зависит от вида процесса и определяется начальными и конечными состояниями рабочего тела, то находят только ее изменение в данном процессе Δs: Δs = cv · ln(T2/ Т 1)+R · ln(v2/ v 1); Δs = ср · ln(Т 2 / Т 1) – R · ln(P2/P1): (1.11) Δs = cv · ln(P2/P1)+Cp · ln(v2/ v1). Если Δs > 0 - к системе подводится тепло; Δs < 0 - от системы отводится тепло; Δs = 0 (s = const) - к системе не подводится и не отводится тепло (адиабатный процесс). Цикл и теоремы Карно. Циклом Карно называется круговой цикл, состоящий из двух изотермических и двух адиабатных процессов. Обратимый цикл Карно в Р, v - и Т, s - диаграммах показан на рис. 1.4.
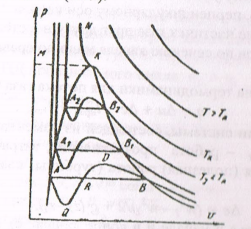
Рис 1.4. Обратимый цикл Карно в P, V – (a) и T, S – (б) диаграммах Участок 1-2 характеризует обратимое адиабатное расширение при S 1 =const (температура уменьшается от T 1 до Т2); 2-3 - изотермическое сжатие (отвод теплоты Q2 к холодному источнику от рабочего тела); 3-4 - обратимое адиабатное сжатие при S 2= const (температура повышается от T 3 до T 4); 4-1 - изотермическое расширение (подвод теплоты Q 1 от горячего источника к рабочему телу). Основной характеристикой любого термодинамического цикла является термический коэффициент полезного действия (термический КПД): η = Q 1 – Q 2 / Q 1 Для обратимого цикла Карно термический КПД: η = (T 1 – T 2)/ T 1. (1.12) Из (3.15) следует первая теорема Карно: Термический КПД обратимого цикла Карно не зависит от свойств рабочего тела и определяется только температурами источников. Из сравнения произвольного обратимого цикла и цикла Карно вытекает вторая теорема Карно: обратимый цикл Карно является выгоднейшим циклом в заданном интервале температур, т.е. термический КПД цикла Карно всегда больше термического КПД произвольного цикла: η tк > η t. Термодинамические процессы К основным термодинамическим процессам относятся изохорный, изотермический, изобарный и адиабатный процессы. Для идеального газа: Изохорный процесс (рис.1.5, a): V = const, V 2 = V 1. Уравнение состояния процесса: Р2/Р1 = Т2/ T 1. Так как V 2 = V 1,то работа процесса A = 0. Уравнение первого закона термодинамики: Q = Δ U = cv · (T 2 – T 1). Изобарный процесс (рис.1.5, б): Р = const, Р2 = Р1. Уравнение состояния процесса: V 2 / V 1 = Т2/Т1). Работа процесса: A = Р (V 2 – V 1). Уравнение первого закона термодинамики: Q = Δ U + A = с p · (Т2 – T 1). Изотермический процесс (рис.1.5, в): Т= const, Т2 = T 1. Уравнение состояния процесса: Р1 /Р2 = V 2 / V 1. Так как Т2 = T 1, то Δ U = 0. Уравнение первого закона термодинамики: Q = A = R · T · ln (V 1 / V 2) или Q = A = R · T · ln (P 1 / P 2), где R - газовая постоянная, Дж/(кг· К). Адиабатный процесс. В данном процессе не подводится и не отводится тепло, т.е. Q =0. Уравнение состояния процесса: Р· V γ = const, где γ = с p / cv - показатель адиабаты. Уравнение первого закона термодинамики: A = -ΔU = - с v ∙ (T 2 – T 1) = cv ∙ (T 1 – T 2), Первый закон термодинамики для потока. уравнение первого закона термодинамики для потока газа будет иметь вид: Q = Δ U + Δ E + A прот. + A техн , (1.13) где Δ E - изменение энергии системы, состоящей из изменения кинетической и потенциальной энергий; A прот - работа проталкивания, затрачиваемая на движение потока; A техн - техническая (полезная) работа (турбины, компрессора, насоса, вентилятора и т.д.); Введём понятие энтальпии H, скорости потока вначале и в конце канала w 2 и w 1 ,высоту положения начала и конца канала z 2 и z 1, то уравнение первого закона термодинамики для потока газа будет иметь вид: Q = H 2 - H 1 + (w 2 2 - w 2 1)/2 + g ∙ (z 2 – z 1) + A техн. (1.14) Реальные газы. Водяной пар При практических расчетах свойств реальных газов наряду с уравнением состояния применяется отношение (P ∙ V)/(R ∙ T)= c, где с - коэффициент сжимаемости. Для идеальных газов с = 1, так как Р ∙ V = R ∙ T. Тогда величина с выражает отклонение свойств реального газа от свойств идеального. Уравнения состояния реального газа. Поведение реального газа отражает уравнение Ван-дер-Ваальса: (P + a / V 2) ∙ (V - b)= R ∙ T, (1.15) где a, b постоянные величины (а учитывает силы взаимодействия, b - размер молекул); a / V 2 - внутренние давление (добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами). Уравнение (1.15) качественно верно отображает поведение жидкостей и газов, но для двухфазных состояний оно неприменимо. На рис.1.5 показаны изотермы, построенные по уравнению (1.15).
Рис.1.5. Изотермы, построенные по уравнению Ван-дер-Ваальса
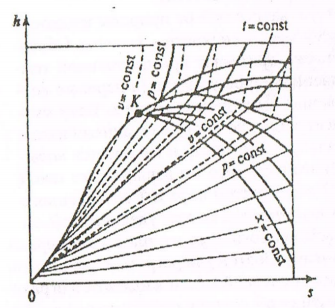
. Чем выше Т, тем короче участки. Волнообразные кривые указывают на непрерывный переход от жидкого в парообразное состояние при данной Т. Точка А соответствует состоянию жидкости, точка B пара. Переход из жидкого в парообразное состояние показано прямой АВ. При определенной Т изотерма не будет иметь волнообразного участка (точка К). Эту Т называют критической. Кривая АК соответствует состоянию кипения жидкости. Кривая КВ соответствует состоянию сухого насыщенного пара. Таким образом, для реального вещества PV — диаграмму можно разбить на три области: 1) область жидкого состояния, левее кривой АК 2) область двухфазных состояний (влажный пар), между кривыми АК и КВ 3) область перегретого пара, правее кривой КВ и выше критической точки. Условно область жидкости ограничивают сверху линией КМ (критическая изобара). Понятие о водяном паре. Рабочим телом в паровых турбинах, атомных установках, теплоносителем в теплообменниках является водяной пар. Пар - газообразное тело в состоянии, близком к кипящей жидкости. Процесс превращения вещества из жидкого в парообразное состояние называют парообразованием. Испарение - парообразование, происходящее с поверхности жидкости. При некоторой определенной температуре, зависящей от природы жидкости и давления, начинается парообразование во всей массе жидкости — кипение. Обратный процесс называется конденсацией. Она также протекает при постоянной температуре. При испарении жидкости в ограниченном пространстве (в паровых котлах) одновременно происходит обратное явление - конденсация пара. Если скорость конденсации станет равной скорости испарения, то наступает динамическое равновесие. Пар в этом случае имеет максимальную плотность и называется насыщенным паром. Если Т пара выше Т насыщенного пара того же давления, то такой пар называется перегретым. Разность между Т перегретого пара и Т насыщенного пара того же давления называется степенью перегрева. Так как удельный объем перегретого пара больше удельного объема насыщенного пара, то плотность перегретого пара меньше плотности насыщенного пара. Поэтому перегретый пар является ненасыщенным паром. В момент испарения последней капли жидкости в ограниченном пространстве без изменения Т и давления образуется сухой насыщенный пар. Состояние такого пара определяется давлением. Механическая смесь сухого пара и мельчайших капелек жидкости называется влажным паром. Массовая доля сухого пара во влажном паре называется степенью сухости х: х = тсп / твп, где тсп, - масса сухого пара во влажном; твп - масса влажного пара. Массовая доля жидкости во влажном паре называется степенью влажности у: y = 1 —х. Для кипящей жидкости при Т насыщения х = 0, для сухого пара х = 1. Основные термодинамические процессы водяного пара в h, s - диаграмме. В практических расчетах количество участвующей в процессе теплоты проще, определять по h, s - диаграмме водяного пара (рис. 1.6). Это график, построенный в системе координат h - s, на котором нанесены изобары, изохоры, изотермы, пограничные кривые и линии постоянной степени сухости пара. На графике нанесены также линии постоянного паросодержания (х = const) и постоянного удельного объема (v = const). Изохоры идут круче,.чем изобары. Семейство изобар в области насыщения представляет собой пучок расходящихся прямых. Они начинаются на нижней и оканчиваются на верхней пограничной кривой. Чем больше давление, тем выше лежит соответствующая изобара. Переход изобар из области влажного насыщенного в область перегретого пара происходит без перелома на верхней пограничной кривой. Состояние перегретого пара определяется в технике давлением P и температурой t. Точка, изображающая это состояние, находится на пересечении соответствующей изобары и изотермы. Состояние влажного насыщенного пара определяется давлением P и паросодержанием х. Точка, изображающая это состояние, находится на переселении изобары и линии х = const.
Рис 1.6 h, s –диаграмма для воды и водяного пара. Термодинамические циклы. Циклы паротурбинных установок. Паротурбинная установка (ПТУ) - основа тепловых и атомных электростанций. Рабочим телом в ПТУ является водяной пар, а основным циклом - цикл Ренкина. Цикл Ренкина - теоретический термодинамический цикл паровой машины, состоящий из четырех основных процессов: 1) испарения жидкости при высоком давлении; 2) расширения пара; 3) конденсации пара; 4) увеличения давления жидкости до начального значения. Принципиальная схема ПТУ показана на рис.1.7, а.
а) б) в) Рис. 1.17 Циклы паротурбинных установок: схема ПТУ (а); я насыщенном (б) и перегретом (в) паре
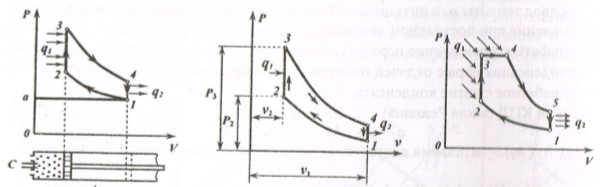
В паровом котле 1 и в перегревателе 2 теплота горения топлива передается воде. Полученный пар поступает в турбину 3, где происходит преобразование теплоты в механическую работу, а затем в электрическую энергию в электрогенераторе 4. Отработанный пар поступает в конденсатор 5, где отдает теплоту охлаждающей воде. Полученный конденсат конденсатным насосом 6 отправляется в питательный бак 7, откуда питательным насосом 8 сжимается до давления, равного в котле, и подается через подогреватель 9 в паровой котел 1. Цикл Ренкина на насыщенном паре. В данном случае перегреватель отсутствует, поэтому на турбину будет поступать насыщенный пар. Процессы (рис.1.7,6): · 3-0 -подвод теплоты Q 1 к питательной воде (3-4 - кипение воды в котле; 4-0 - парообразование при постоянном давлении); · 0-1- адиабатное расширение пара в турбине; · 1-2 - конденсация пара с отдачей теплоты Q 2 охлаждающей воде; · 2-3 - адиабатное сжатие конденсата. Термический КПД цикла Ренкина: η = (Q 1 - Q 2)/ Q 1 Q 1 = h 0 – h 3; Q 2 = h 1 – h 2 Теоретическая мощность турбины, Вт: N τ = (h 0 – h 1) - D /3600 (1.16) где D = 3600-т - часовой расход пара, кг/ч; т - секундный расход пара, кг/с. Цикл Ренкина на перегретом паре применяется для увеличения термического КПД цикла ПТУ. Циклы двигателей внутреннего сгорания. Двигатели внутреннего сгорания (ДВС) выполняются в виде поршневых газовых двигателей, в которых рабочим телом являются продукты сгорания топлива. Циклы поршневых ДВС подразделяют на три группы: • цикл Отто (1876 г.) — с подводом теплоты при постоянном объеме (карбюраторные ДВС); • цикл Дизеля (1892 г.) - с подводом теплоты при постоянном давлении (компрессорные дизели); • цикл Тринклера (1901 г.) - со смешанным подводом теплоты при постоянном объеме (бескомпрессорные дизели); Основные характеристики любого цикла теплового двигателя: • степень сжатия (отношение удельных объемов рабочего тела в начале и конце сжатия): ε = V 1 / V 2; • степень повышения давления (отношение давлений в конце и в начале изо- хорного процесса подвода теплоты): λ = Р3 / Р2; • степень предварительного расширения или степень изобарного расширения (отношение удельных объемов в конце и в начале изохорного процесса подвода теплоты): ρ = V 3 / V 2. Рассмотрим цикл ДВС с подводом теплоты при постоянном объеме на примере четырехтактного двигателя (рис.1.8, а).
а) б) в) Рис. 1.8. Циклы ДВС с подводом теплоты при постоянном объёме (а); идеальный процесс (б); со смешанным подводом теплоты (в) На рис. 1.8, а: · а-1 (1 такт) - в цилиндр через всасывающий клапан поступает смесь воздуха и паров горючего (нетермодинамический процесс); · 1-2 (2 такт) - адиабатное сжатие (повышается температура); · 2-3 - сгорание горючей смеси, давление быстро возрастает при постоянном объеме (подвод теплоты Q1); · 3-4 (3 такт) - адиабатное расширение (рабочий процесс, совершается полезная работа); · 4-а - открывается выхлопной клапан, и отработанные газы покидают цилиндр, давление цилиндра падает (отводится тепло q 2); · 1-а (4 такт) - происходит выталкивание оставшихся в цилиндре газов. Затем процесс повторяется. Описанный процесс является необратимым (наличие трения, химической реакции в рабочем теле, конечные скорости поршня, теплообмен при конечной разности температур и т.п.). Диаграмма идеального процесса ДВС показана на рис.1.8, б. Из диаграммы выводится формула для термического КПД цикла Дизеля: η = 1-1/ ε γ, (1.17) где ε - степень сжатия (чем выше е, тем выше экономичнос
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-10; просмотров: 158; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.171.121 (0.143 с.) |