
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механические колебания. Свободные и вынужденные колебания. Резонанс. Превращение энергии при механических колебаниях.
Механические колебания - это движения, которые точно или приблизительно повторяются через определенные интервалы времени (например, колебание ветки на дереве, маятника часов, автомобиля на рессорах) Колебания бывают свободными и вынужденными. Колебания, возникающие в системе под действием внутренних сил после того, как система выведена из положения равновесия, называются свободными (например: качели). Колебания, совершаемые телами под действием внешних периодически изменяющихся сил, называются вынужденными (например: игла швейной машинки). Условия возникновения свободных колебаний: 1) При выведении тела из положения равновесия в системе должна возникать сила, стремящаяся вернуть его в положение равновесия; 2) Силы трения в системе должны быть очень малы (т.е. стремиться к нулю). В реальных колебательных системах всегда происходят потери энергии при свободных колебаниях. Механическая энергия расходуется на совершение работы по преодолению сил сопротивления воздуха. Под влиянием силы трения происходит уменьшение амплитуды колебаний, затем колебания прекращаются. Колебания, энергия которых уменьшается с течением времени за счет действия сил сопротивления, называются затухающими. Вынужденные колебания являются незатухающими. Поэтому необходимо восполнять потери энергии за каждый период колебаний. Вынужденные колебания совершаются с частотой, равной частоте изменения внешней силы. Резонанс - резкое возрастание амплитуды вынужденных колебаний при совпадении частоты изменения внешней силы, действующей на систему, с частотой свободных колебаний Явление резонанса учитывается в акустике, радиотехнике и технике. В строительстве, например, при сооружении мостов и других сооружений, которые подвержены механическим колебаниям и действию внешней силы. На примере колебаний тела на нити можно наблюдать превращение энергии: кинетическая энергия превращается в потенциальную и наоборот. Закон сохранения механической энергии: сумма кинетической и потенциальной энергий остается неизменной: Екин = Ер = const №9 Возникновение атомистической гипотезы строения вещества и её экспериментальные доказательства. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа. Абсолютная температура как мера средней кинетической энергии теплового движения частиц вещества.
Атомистическая теория - современная теория строения вещества - зародилась ещё в Древней Греции. Демокрит считал, что материя состоит из мельчайших неделимых частиц. Он называл их атомами, что значит «неделимые». То, что вещество состоит из мельчайших частиц - молекул и атомов экспериментально доказывают броуновское движение и явление диффузия. Идеальный газ - это физическая модель реального газа, взаимодействие между молекулами которого пренебрежимо мало. Реальные разрежённые газы ведут себя как идеальный газ.
Это основное уравнение МКТ, где р - давление газа (Па); n - концентрация молекул, (м-3) m0 - масса молекулы (кг); ʋ - средняя квадратичная скорость движения молекул (м/с) Температура характеризует степень нагретости тела. Измеряют температуру термометром. В процессе измерения температура тела и термометра приходят в состояние теплового равновесия. Абсолютная шкала температур называется так, потому что мера нижнего предела температуры - абсолютный ноль, то есть наиболее низкая возможная температура, при которой молекулы вещества перестают двигаться. Единица абсолютной температуры в СИ: [T]=1K (Кельвин). Нулевая температура абсолютной шкалы - это абсолютный ноль 00К = −273.15 °C. В формулах абсолютная температура обозначается буквой «Т», а температура по шкале Цельсия буквой «t». T = t+273 (K). №10 Давление газа. Уравнение состояния идеального газа (уравнение Менделеева - Клапейрона). Изопроцессы. Давление газа возникает в результате столкновений молекул газа со стенками сосуда. Чем чаше удары, тем они сильнее - тем выше давление. Единица измерения давления - паскаль ([ p ]= Па). Измеряют давление газа манометром (жидкостным, металлическим и электрическим).
Уравнение состояния идеального газа - формула, устанавливающая зависимость между давлением, объёмом и абсолютной температурой идеального газа, R = 8,31 Дж/моль·К - универсальная газовая постоянная Часто необходимо исследовать ситуацию, когда меняется состояние газа при его неизменном количестве (m=const) и в отсутствие химических реакций (M=const Для постоянной массы идеального газа отношение произведения давления на объем к абсолютной температуре в данном состоянии есть величина постоянная: Особый интерес представляют изопроцессы - термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. 1) Изотермический процесс: Т = const p1 V1 = p2 V2, закон Бойля-Мариотта
2) Изобарный процесс: р = const V1/Т1 = V2/Т2, закон Гей-Люссака
3) Изохорный процесс: V = const р1/Т1 = р2/Т2, закон Шарля
11 Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха Испарение - процесс парообразования с поверхности жидкости или твердого тела. Заключается он в вылетании частиц (молекул, атомов), кинетическая энергия которых превышает потенциальную энергию их связи с остальными частицами вещества. При испарении тепло отбирается. Скорость испарения зависит от: 1. площади поверхности жидкости; 2. температуры; 3. рода вещества. Может случиться, что через некоторое время молекула пара вернётся обратно в жидкость. Процесс перехода вещества из газообразного состояния в жидкое состояние называется конденсацией. При конденсации тепло выделяется. В закрытом сосуде жидкость и её пар могут находиться в состоянии динамического равновесия, когда число молекул, вылетающих из жидкости, равно числу молекул, возвращающихся в жидкость из пара. Пар, находящийся в равновесии со своей жидкостью, называют насыщенным. Вследствие постоянного испарения воды с поверхностей водоемов, почвы и растительного покрова, а также дыхания человека и животных в атмосфере всегда содержится водяной пар. Под влажностью воздуха понимается содержание водяных паров в воздухе. Относительная влажность характеризует степень насыщения воздуха водяным паром. Относительная влажность показывает, сколько процентов составляет абсолютная влажность от необходимой для насыщения воздуха при данной температуре: Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами. Относительная влажность воздуха - важный экологический показатель среды. При слишком низкой или слишком высокой влажности наблюдается быстрая утомляемость человека, ухудшение восприятия и памяти. Оптимальная влажность в квартире должна быть равной 30 - 45%, не превышая отметки в 60%.
12
|
||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 342; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.224.197 (0.008 с.) |

 - уравнение Менделеева – Клапейрона
- уравнение Менделеева – Клапейрона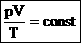 - уравнение Клапейрона.
- уравнение Клапейрона.





