
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Известковый метод (декарбонизация).
Применяется для частичного устранения из воды карбонатной жесткости. Иногда этот метод сочетают с содовым методом или ионообменным (катионитовых). Химизм процесса: Известь Са(ОН)2 в виде известкового молока Са(ОН)2+СО2 = СаСО3↓+Н2О (1) По реакции 1 идет связывание свободной углекислоты СО2 растворенной в воде. Са(НСО3)2+Са(ОН)2=2СаСО3↓+2Н2О (2) присутствует в воде в большом кол-ве Mg(НСО3)2+Са(ОН)2=МgСО3+Н2О+СаСО3↓ (3) По 2 реакции образуется СаСО3. MgСО3+Са(ОН)2=Мg(ОН)2+СаСО3↓ (4) По реакциям 3 и 4 происходит связывание Са2+и Mg2+. Доза вводимой извести (Ди) зависит от соотношения концентрации в воде ионов Са2+и жесткости карбонатной (согласно п.5 СНиП 2.04.02-84, приложение 7 стр108). При соотношении: а)
б)
[CO2] – содержание в воде свободной углекислоты,мгл; [Ca2+] – концентрация ионовСа2+ в исходной воде, мг/л; Дк – доза коагулянта, мг/л (в качестве коагулянта используется FeCl3 или FeSO4). ек – эквивалентная масса, мг/мг-экв, для FeCl3 – 54 мг/мг-экв, для FeSO4 – 76 мг/мг-экв; 0,3;0,5 – избыток извести для полноты реакции.
С – количество образующейся при реагентном умягчении воды взвеси, мг/л (с пересчете на сухое вещево). Для случая а) б) m – содержание СаО в технической извести (в товарном продукте), % Ди=25-35 мг/л (принимаем ориентировочно).
Известково-содовый метод. Основан на введении в воду извести (Са(ОН)2) и соды (Na2CO3). Принимается для карбонатной и некарбонатной жесткости. Механизм процесса: 1. По реакции (1-4) предыдущего метода при введении извести удаляется карбонатная жесткость и одновременно карбонатная магниевая жесткость переходит в карбонатную кальциевую жесткость.
2. По следующим уравнениям (5) и (6) удаляется кальциевая некарбонатная жесткость. СаCl2 + Na2CO3 = CaCO3↓ + 2NaCl (5) СаSO4 + Na2CO3 = CaCO3↓ + Na2SO4 (6) Доза извести и соды определяется По СНиП 2.04.02-84, стр.108, п.6, приложение 7. Остаточная жесткость после умягчения (т.е. после применения извести и соды) должна быть: Жобщ = 0,5-1,0 мг-экв/л, а щелочность - Щ = 0,8-1,2 мг-экв/л. Процесс умягчения этим методом проводят в две стадии: 1) Удаляют из воды органические примеси и большую часть карбонатной жесткости, применяя соли алюминия или железа и извести, тем самым создавая оптимальные условия для протекания процесса коагуляции; 2) Затем вводят в оду соду и остальную часть извести при рН >10,2 (эта среда необходима для удаления магниевой жесткости). Соли алюминия в качестве коагулянта не применяют, т.к. эта соль (Al2(SO4)3) образует растворимые алюминаты, не обеспечивая выделение из воды солей жесткости в виде осадка. Если органические примеси удаляют из воды совместно с умягчением, то в качестве коагулянтов применяют исключительно соли железа (FeSO4, FeCl2).Соль алюминия применяют, если устраняется жесткость только карбонатная при условии [Ca2+] > [HCO3-]. Доза коагулянта определяется по формуле:
|
|||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.193.158 (0.007 с.) |

 , мг/л
, мг/л
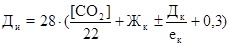 , мг/л
, мг/л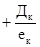 - если коагулянт вводят в воду после извести или одновременно с ней;
- если коагулянт вводят в воду после извести или одновременно с ней;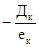 - если коагулянт вводят в воду до извести;
- если коагулянт вводят в воду до извести; , мг/л
, мг/л








