Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы безэлектролитного электрода сравнения
Идея создания безэлектролитного электрода сравнения основана на том, что после введения в грунт электролит, необходимый для нормальной работы электрода формируется путем насыщения прилегающей влаги и самого электрода водородом при пропускании через него электрического тока. Отсутствие собственного (стандартного) электролита и мембранной перегородки между электролитом и внешней средой (грунт, вода) приводит к тому, что величина стационарного потенциала безэлектролитного электрода становится зависимой от ряда специфических условий. Это, прежде всего влажность и кислотность грунта, материал рабочей поверхности электрода, его пористость и степень наводороживания пор электрода. Эта нестабильность собственного потенциала электрода устраняется конструктивными и методическими решениями. При этом суммарная нестабильность потенциала составляет ±0.050 в и соизмерима с нестабильностью типового электрода типа ЭНЕС-1. Кроме того, эта нестабильность применительно к условиям долговременной эксплуатации в условиях конкретного КИП трубопровода становиться постоянной и при необходимости снижается в несколько раз путем калибровки с помощью образцового электролитного электрода. Техническими и программными средствами шкала измерений с помощью безэлектролитного электрода легко приводится к принятой на магистральных трубопроводах шкале по медно-сульфатному электроду. Электрохимические основы безэлектролитных (сухих) электродов сравнения (СЭС) Водородный электрод После введения в грунт электрода сравнения СЭС, необходимый для его нормальной работы электролит формируется из прилегающей влаги путем ее насыщения водородом [17]. То есть, электроды СЭС по ряду факторов (неравновесность, область применения, рабочий диапазон значений рН, стабильность, точность, время выхода на рабочий режим) не соответствуют известному водородному, в то же время, учитывая использование водорода, предлагаемый электрод можно назвать псевдоводородным. Рассмотрим основные закономерности поведения водородного электрода при его поляризации в гальваностатическом режиме при включении и выключении тока. Обширные экспериментальные данные различных научных школ как отечественных, так и зарубежных убедительно подтверждают справедливость уравнение Тафеля в стационарных условиях для широкого диапазона плотности токов и практически всех металлов в водных электролитах с различной кислотностью:
Е = а + b·lg(i) (3.1), где: E - поляризационный потенциал электрода; i – плотность тока поляризации; а и b – константы, причём b=0,118 для всех металлов и электролитов, а величина а – зависит от величины тока обмена. Следует отметить, что потенциал электрода по уравнению Тафеля устанавливается не сразу, а по истечении определённого времени [18-22]. На рис.3.1 представлена зависимость потенциала палладиевого электрода в гальваностатических условиях при включении тока (плотность тока -20 мкА/см2) в течение от 0 до 60 сек и выключенном токе после 60 секунд в 2Н растворе серной кислоты и пропускании водорода при 1 атмосфере [18-22]. Эти экспериментальные данные относятся к поляризации обычного водородного электрода, который использовался в качестве образцового при разработке электрода СЭС. На рис. 3.1 хорошо видны три характерные точки А, Б и С. В точке А устанавливается нестационарный поляризационный потенциал (ЕН) после быстрого перезаряда двойного электрического слоя. В точке С потенциал электрода достигает стационарного значения (ЕСт.) с омической составляющей.
Рисунок 3.1. Гальваностатические процессы включения и выключения тока наводороживания
После выключения постоянного тока в точке Впотенциал электрода принимает значение стационарного поляризационного потенциала (ЕПСт), после чего медленно изменяется до равновесного. В работе [21] показано, что потенциал после точки В меняется линейно в зависимости от количества выделенного водорода. Однако при стационарной установке электрода на конкретном контрольно-измерительном пункте (КИП) трубопровода влияние этих закономерностей приобретает систематический характер. Это позволяет при необходимости исключить возникающую при этом систематическую составляющую ошибки измерения путем калибровки электрода СЭС после его установки в грунт с помощью образцового электролитного электрода.
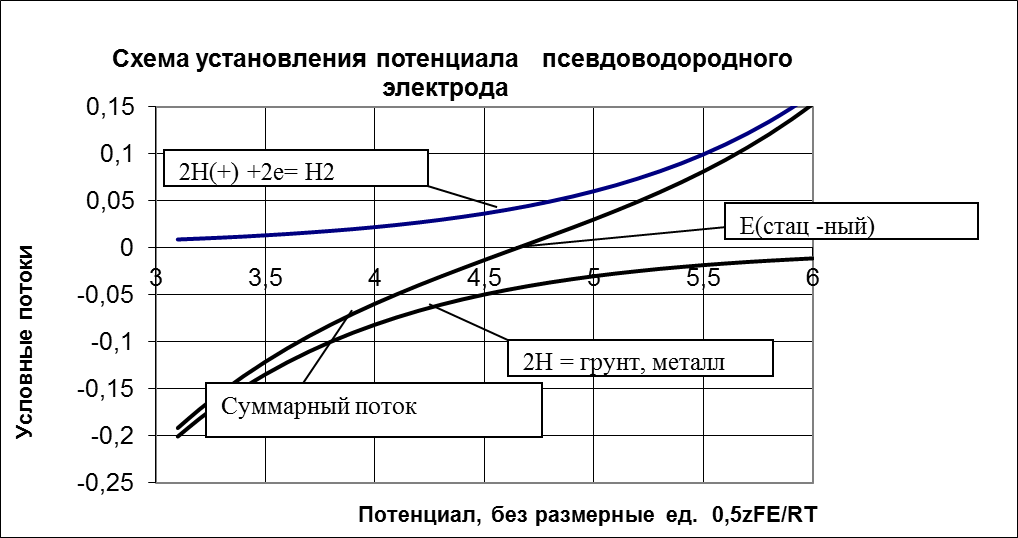
Формирование электрода СЭС Процесс формирования электрода сравнения можно представить в виде следующей упрощенной схемы: O2(в порах электрода) → O2(раствор) (3.2) 0,5O2(раствор) + 2e +2H+ = H2O (3.3) 2H2O +2e = 2H2 +2OH- (3.4) 2OH-(поры электрода) → диффузия в глубь грунта (3.5) H2 → частичная диффузия водорода в глубь грунта и металла (3.6) Стадии (2) и (3) характеризуют процесс электровосстановления кислорода воздуха, находящегося в порах электрода и электролите (влага грунта), а также окислов на поверхности металла. Стадии (5) и (6) указывает на удаление продуктов электрохимической реакции гидроксила и водорода вглубь грунта и металла. Стадии (2) и (3) существенно влияет на потенциал электрода только ограниченное время (сутки и меньше) из-за ограниченного объёма пор электрода. Но в первоначальный момент времени при малых плотностях тока на восстановление кислорода может расходоваться большая часть тока. Стадии (5) и (6) играют существенную роль в процессе установления стационарного состояния и тем самым и в стабилизации потенциала СЭС.
Рисунок 3.2. Формирование потенциала электрода СЭС
Отметим, что водород, получающийся в процессе наводораживания на стадии (4) частично адсорбируется на поверхности пор электрода довольно прочно. Так, после разрыва цепи наводораживания потенциал электрода с пористостью 20% через три часа принимает постоянное значение в глинистом грунте, равное –0.730 В и практически не изменяется в течение трёх суток. На рисунке 3.2 изображена схема завершения формирования стационарного потенциала псевдоводородного электрода за счет протекания двух потенциалопределяющих реакций в координатах: ток – безразмерный потенциал 0,5zFE/RT (z – число электронов, F – число Фарадея, R- универсальная газовая постоянная, джоуль/(моль Кельвин), T – температура, Кельвин, E – потенциал, вольт). По мере насыщения пор электрода водородом, который выделяется за счёт катодной поляризации, скорости прямой реакции восстановления водорода из влаги грунта (положительный поток) и обратной реакции отвода продуктов реакции от поверхности (отрицательный поток) становятся равными. При этом изменение потенциала электрода прекращается, и он достигает своего стационарного значения, которое сохраняется за счет равенства потоков.
|
||||||||||
|
Последнее изменение этой страницы: 2017-01-20; просмотров: 137; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.169.94 (0.006 с.) |