
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Точка перехода и интервал перехода окраски индикатораСодержание книги
Поиск на нашем сайте Каждый индикатор характеризуется собственной величиной константы диссоциации
Величины На основании выражения для Для удобства расчетов обычно используют логарифмическую форму этого выражения:
Действительно, Значение рН раствора, численно равное показателю константы диссоциации индикатора, называют точкой перехода окраски индикатора. Интервалом перехода окраски индикатора называют интервал значений рН раствора, равный Если индикатор находится в растворе с рН < Правила выбора индикатора Поскольку целью применения индикатора является фиксирование точки эквивалентности, необходимо, чтобы индикатор изменил свою окраску в момент окончания реакции, т. е. чтобы рН раствора в точке эквивалентности совпал с интервалом перехода окраски выбранного индикатора. В этой связи для правильного выбора индикатора следует: 1) написать уравнение реакции, протекающей между анализируемым веществом и титрантом; 2) качественно (без точного расчета) определить реакцию среды в анализируемом растворе в точке эквивалентности; 3) выбрать индикатор, у которого область применения совпадает с рН анализируемого раствора в точке эквивалентности. Для более точного фиксирования точки эквивалентности строят так называемые кривые титрования - графики, показывающие изменение рН в процессе титрования в зависимости от объема добавленного титранта. Характер наиболее типичных кривых титрования приведен на рис. 1 - 3. Участок на кривых титрования, характеризующий резкое изменение pH вблизи от точки эквивалентности, называется скачком pH. Любой индикатор, интервал изменения окраски которого полностью или частично входит в скачок pH, пригоден для фиксирования точки эквивалентности. Рассмотрим некоторые примеры кривых титрования.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 428; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

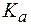 :
: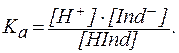
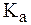 можно заключить, что если
можно заключить, что если 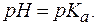
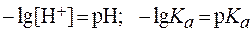 .
.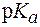 ± 1, в котором происходит заметное глазу изменение окраски индикатора. Этот интервал определяет область применения индикатора. У некоторых индикаторов интервал перехода окраскиможет быть шире или уже обозначенного.
± 1, в котором происходит заметное глазу изменение окраски индикатора. Этот интервал определяет область применения индикатора. У некоторых индикаторов интервал перехода окраскиможет быть шире или уже обозначенного. – 1, то преобладает молекулярная форма индикатора, в растворе с рН >
– 1, то преобладает молекулярная форма индикатора, в растворе с рН > 


