
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
комплексного иона триоксалата марганца
Химические реакции, в результате которых происходит изменение цвета, могут быть изучены фотометрическим методом. Одним из примеров таких реакций может служить распад комплексного иона триоксалата марганца, окрашенного в коричневый цвет, до смеси продуктов, которые бесцветны.
Изучаемая реакция является реакцией первого порядка. Константа скорости реакции может быть вычислена по уравнению, которое легко преобразовать к виду:
где С помощью спектрофотометра ПЭ-5400ви измеряют процент пропускания света – N, из которого может быть рассчитан коэффициент пропускания -
Выполнение работы
Убедитесь в том, что в кюветном отделении спектрофотометра на пути светового пучка ничего не установлено, и крышка кюветного отделения закрыта. Включите спектрофотометр с помощью сетевого выключателя, расположенного на задней панели прибора. Раздастся звуковой сигнал и на дисплее начинает отображаться ход процедуры самодиагностики. По ее завершении начинается прогрев прибора, который длится 20 минут. В кюветное отделение поместить кювету с дистиллированной водой и нажать кнопку «Ноль». На дисплее должно высветиться значение «100». Реакционная смесь готовится в следующей последовательности: в фарфоровый стакан емкостью 20 мл налить 1 мл 0.1М раствора MnSO4, Полученной реакционной смесью заполнить кювету и поместить в кюветное отделение спектрофотометра. Сменить кювету с дистиллированной водой на такую же кювету с реакционной смесью и снимать показания прибора во времени Измерения рекомендуется производить через 1, 2, 4, 6, 10 минут от начала реакции и прекращать при После окончания измерений строится график зависимости Кроме того, экспериментально измеренные и расчетные данные следует занести в таблицу 6, предварив ее следующими данными.
Температура опытаºC Логарифм оптической плотности в начале реакции
Таблица 6. Изменение коэффициента пропускания во времени и расчет константы скорости реакции разложения триоксалата марганца
В выводах сравнить величины Литература
1. Герасимов Я.И. и др. Курс физической химии: В 2 томах. М.: Химия, 1969. 2. Горбачев С.В. и др. Практикум по физической химии. М.: Высшая школа, 1974. 3. Воробьев Н.К. и др. Практикум по физической химии. М.: Химия, 1975. 4. Байрамов В.М. Основы химической кинетики и катализа. М.: Академия, 2003. 5. Химическая энциклопедия / под ред. И.Л.Кнунянца: В 5 томах. М.: Советская энциклопедия, 1990.
Содержание
1. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ 3 1.1 Скорость химической реакции 3 1.2 Зависимость скорости от концентрации реагирующих веществ 5 1.3 Расчет константы скорости для необратимых реакций 8 1.4 Время полупревращения 10 1.5 Методы определения порядка реакции 11 1.6 Методы определения концентрации 13 1.7 Зависимость скорости реакции от температуры 14 1.8 Влияние катализатора на скорость химической реакции 16 2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 17 Работа 1. Изучение скорости инверсии тростникового сахара 17 Работа 2. Изучение кинетики реакции разложения мочевины в водных растворах методом измерения электропроводности…………………………………………….. 23 Работа 3. Изучение скорости омыления сложных эфиров щелочью 27 Работа 4. Изучение кинетики реакции омыления уксусноэтилового эфира щелочью методом потенциометрии……………………..31 Работа 5. Определение константы скорости реакции окисления йодоводородной кислоты пероксидом водорода 35 Работа 6. Фотометрическое изучение скорости разложения комплексного иона триоксалата марганца 37 Литература 39
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 718; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.200.139 (0.006 с.) |

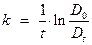 ,
, и
и  - оптические плотности раствора в начальный момент времени и в момент времени
- оптические плотности раствора в начальный момент времени и в момент времени  Оптическая плотность раствора пропорциональна концентрации комплексного иона триоксалата марганца.
Оптическая плотность раствора пропорциональна концентрации комплексного иона триоксалата марганца. и оптическая плотность раствора:
и оптическая плотность раствора: ;
; 
 .
. -
-  . По этому графику следует определить константу скорости реакции (графическим способом) а также, экстраполировав полученную линейную зависимость на ось ординат, - значение
. По этому графику следует определить константу скорости реакции (графическим способом) а также, экстраполировав полученную линейную зависимость на ось ординат, - значение  .
.


 , мин-1
, мин-1
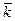 =
= полученные графическим и аналитическим способами.
полученные графическим и аналитическим способами.


