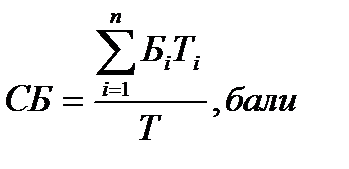Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
До проведення модульного контролюСодержание книги Поиск на нашем сайте
З дисципліни ЧИГВІНЦЕВА О.П., ГОЛОВ’ЯТИНСЬКА В.В.
Методичні рекомендації до проведення модульного контрою з дисципліни «Неорганічна хімія» / Дніпропетровський державний аграрний університет. – Дніпропетровськ, 2012. – 32 с.
Друкується за рішенням науково-методичної ради агрономічного факультету Дніпропетровського державного аграрного університету (протокол № 9 від 26.04. 2012 р.)
РЕЦЕЗЕНТИ: Н.Г. Черкасова, кандидат технічних наук, доцент кафедри хімії ДДАУ С.В. Кравченко, кандидат хімічних наук, доцент кафедри хімії ДДАУ
У методичних рекомендаціях включено програми першого та другого модулів дисципліни «Неорганічна хімія». Наведено приклади білетів, критерії оціню-вання знань та відповіді на питання білетів по двох модульних контрольних роботам. Методичні рекомендації призначені для студентів очної форми навчання за напрямком підготовки 6.090101, «Агрономія». Вступ Загальні положення Соціально-економічні й політичні зміни в суспільстві, зміцнення державності України, входження її в цивілізоване світове співтовариство неможливі без структурної реформи національної системи вищої освіти, що має бути спрямована на зміцнення інтелектуального, культурного, соціального та науково-технічного потенціалу. Практична реалізація створення умов для входження України до єдиного європейського та світового наукового та освітнього простору передбачає впровадження в систему вищої освіти України основних ідей, що підкреслюються поняттям Болонського процесу. Кількість країн, що приєднувалися до Болонського процесу поступово збільшувалася і зараз складає 45 учасників, в тому числі і Україна. Дніпропетровський державний аграрний університет з 1 вересня 2006 року (наказ № 544 від 30.03.2006р.) впроваджує КМС ОНП на кожному факультеті як ефективний засіб суттєвого поліпшення якості навчального процесу, дійсного наближення змісту освіти до рівня провідних Європейських ВНЗ. Метою впровадження є інтенсифікація навчального процесу, підвищення мотивації учасників навчально-виховного процесу, підвищення якості підготовки фахівців і забезпечення на цій основі конкурентоспро-можності випускників університету на ринку праці. Курс дисципліни «Неорганічна хімія» розрахований на 108 годин (64 години аудиторних та 44 години на самостійну роботу студентів) і поділений на три змістовних модулі (табл. 1). Кожний модуль включає лекційний матеріал, лабораторно-практичні роботи та модульну контрольну роботу. Лабораторно-практичні заняття є обов’язковими. На них студенти засвоюють методику проведення досліджень та математичний аналіз результатів експерименту.
Таблиця 1. Структура залікового кредиту курсу
Оцінювання знань студентів при вивченні дисципліни проводяться за результатами модульних контрольних робіт і виконання лабораторного практикуму. Кожна модульна контрольна робота включає завдання теоретичного та практичного характеру, виконується в окремому зошиті для контрольних робіт, який зберігається на кафедрі. Варіанти модульних контрольних робіт однотипні і розраховані на виконання середнім студентом на протязі двох академічних годин. Перелік розділів програми та практичних завдань, що виносяться на модульну контрольну роботу, зразок варіанту такої роботи та приклад відповіді на нього доводяться до відома студентів. Зарахування модуля проводиться за умови отримання позитивної оцінки та виконання і захисту відповідних робіт лабораторного практикуму. Рівень знань, вмінь та навичок студента оцінюється за національною чотирибальною шкалою та шкалою оцінок ЕСТS. Таблиця 2. Критерії та шкала оцінювання знань і умінь студентів.
Підсумкову оцінку визначають комплексно середньовиваженим балом (СБ) результатів усіх модульних контролів за формулою:
де п – загальна кількість модулів; Бі – бал за і -модуль за національною шкалою; Ті – час засвоєння і-го модуля; Т – загальний обсяг дисципліни за навчальним планом.
При відсутності під час написання модульної контрольної роботи або отриманні незадовільної оцінки, студент повинен здати або перездати модуль під час проведення підсумкових контрольних заходів. При оцінці «2» з будь якого модуля незалежно від інших оцінок автоматично виставляється підсумкова оцінка «незадовільно».
Змістовий модуль № 1
На самостійне опрацювання виносяться такі теми: 1. Основні класи неорганічних сполук. 2. Періодична система елементів Д.І. Менделєєва 3. Ступінь і константа дисоціації. Іонно-молекулярні рівняння До першого модуля включені лабораторні роботи: 1. Основні класи неорганічних сполук 2. Швидкість хімічних реакцій. Хімічна рівновага. 3. Приготування розчинів заданої концентрації 4. Гідроліз солей. Визначення водневого показника розчинів.
5. Література:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.11.13 (0.006 с.) |