
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Програма навчальної дисципліни «Неорганічна хімія»Содержание книги
Поиск на нашем сайте Програма
Державного екзамену з хімії
підготовки бакалавра галузі знань 0401 Природничі науки напряму підготовки 6.040101 Хімія* природничо-географічного факультету
В і н н и ц я – 2013 р. Програма державного екзамену з хімії для студентів занапрямом підготовки 6.040101 Хімія* освітньо-кваліфікаційного рівня «бакалавр»
Розробник: Блажко О.А., кандидат педагогічних наук, доцент кафедри хімії Крикливий Д.І., доктор технічних наук, професор кафедри хімії
Програма розглянута і схвалена на засіданні кафедри хімії Протокол від «06» березня 2013р. № 11 Завідувач кафедри ________________________ Д.І. Крикливий «____» ___________20 ___р.
Програма розглянута і схвалена на засіданні навчально-методичної комісії природничо-географічного факультету Протокол від «___» _____________20___р. № ________ Голова ______________________ Н.В. Бірюкова «____» ___________20 ___р. В С Т У П Державна підсумкова атестація студентів освітньо-кваліфікаційного рівня «бакалавр», напряму підготовки 6.040101 Хімія*, галузі знань 0401 Природничі науки відповідно до освітньо-кваліфікаційної характеристики, освітньо-професійної програми та визначених у них засобів діагностики, проводиться у формі державного екзамену з хімії, комплексного державного екзамену з методики навчання хімії та педагогіки, а для студентів, які мають нахил до науково-дослідної роботи, одна із форм засобу діагностики може бути замінена на захист дипломної роботи. Програма державного екзамену з хімії укладена відповідно до освітньо-професійної програми, освітньо-кваліфікаційної характеристики підготовки бакалавра, напряму підготовки 6.040101 Хімія*. 1. Мета та завдання державного екзамену з хімії: 1.1. Мета: встановлення фактичної відповідності теоретичних знань випускників та їх практичної підготовки вимогам освітньо-кваліфікаційної характеристики підготовки бакалавра з напряму підготовки 6.040101 Хімія* галузі знань 0401 Природничі науки 1.2. Завдання: перевірка та оцінка рівня фахової підготовки студентів ОКР «бакалавр», їх здатність використовувати набуті фундаментальні знання, уміння та навички в ході виконання ними своїх функціональних обов’язків. 1.3. Знати і вміти: знати: - основні поняття та закони хімії; - термінологію та номенклатуру хімічних сполук; - закономірності перебігу хімічних процесів; - основи сучасних теорій будови атома та хімічного зв’язку; - загальні відомості про хімічні елементи та про їх найважливіші хімічні сполуки, закономірність змінюваності атомних характеристик в групах та періодах; - основи хімічної термодинаміки; - основи хімічної кінетики; - основні методи дослідження будови речовини; - сучасні уявлення про кислоти та основи; - основні типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні, диспропорціонування, комутації; - методи синтезу неорганічних матеріалів; - хімізм процесів, що відбуваються на поверхні металу у воді і водних розчинах солей; - основнi поняття теоретичної органічної хімії; - класи органічних сполук, правила номенклатури та основні методи одержання, взаємозв'язок мiж класами; - основні фізичні закономірності, хімічні перетворення та механiзми органiчних реакцiй; - окремих представників певного класу органічних сполук, практичне застосування найважливiших органічних сполук; - основні поняття, терміни і закони фізичної хімії; - методи теоретичного та експериментального дослідження у фізичній хімії; - кінетичний опис процесів, що перебігають; - методи розрахунку теплових ефектів хімічних процесів; - методи розрахунку електрорушійної сили гальванічних елементів; - методи визначення електропровідності розчинів електролітів; - методи розрахунку хімічної рівноваги; - основні типи процесів хімічної технології; - фізико-хімічні основи процесів, з метою правильного застосування їх на практиці; - будову і принцип дії апаратів та установок; - технологічні схеми вибраних хімічних виробництв; - методи промислового одержання хімічних сполук та виявлення шкідливих відходів. - характеристика основних груп біоактивних речовин (ферменти, вітаміни, гормони) та їх роль у біохімічних процесах, що проходять у живих організмах; - механізми регуляції біохімічних реакцій у живих організмах. вміти: - використовувати фундаментальні знання та елементарні навички для рішення практичних задач хімії, пояснити властивості речовин та характер їх зміни зі зміною умов на підставі квантово-механічних уявлень про електронну будову речовини; - проводити розрахунки за законами Авогадро, еквівалентів; обчислювати величини атомних (молекулярних) мас речовин за експериментальними даними; виводити формули речовин за даними про їх склад; - оцінювати тип зв'язку в бінарних сполуках; прогнозувати можливу гібридизацію орбіта лей, геометрію молекул; - обчислювати за експериментальними даними швидкості реакцій та константи швидкості, обчислювати склад рівноважних сумішей, константи рівноваги реакцій; оцінювати напрям зсуву хімічної рівноваги при зміні зовнішніх умов; - обчислювати ентальпії утворення речовин, зміну ентропії і вільної енергії реакції, прогнозувати можливість проходження процесу, враховуючи термодинамічні й кінетичні його параметри; - робити обчислення концентрацій розчинів; - визначати pH розчину, записувати молекулярні та скорочені іонні рівняння процесів гідролізу солей; - обчислювати можливість проходження ОВР; записувати рівняння анодного і катодного процесів при електролізі розчинів й розплавів солей; - визначати заряд комплексного іона, ступінь окислення комплексоутворювача, координаційне число; - володіти основними прийомами та методами роботи в лабораторії органічної хімії; - пояснити природу хімічного зв’язку у молекулі, описати структурну, просторову будову кожної органічної сполуки; - надавати характеристику як окремій органічній сполуці, так і класу сполук: гомологічний ряд, номенклатура, методи синтезу, хімічні властивості; - виконувати взаємоперетворення окремих сполук, визначати закономірності у взаємоперетвореннях гомологічного ряду, класу сполук; - провести літературний і раціональний пошук методiв синтезу органiчної сполуки заданої будови; - проводити ідентифікацію органічної речовини хiмiчними та фiзичними методами; - проводити експерименти з вивчення фізико-хімічних властивостей індивідуальних речовин, багатокомпонентних систем і параметрів фізико-хімічних процесів; - аналізувати процеси: що відбуваються при фазових перетвореннях в системах з різним числом компонентів; електрохімічні рівноваги; кінетичні закономірності хімічних процесів; - проводити розрахунки: термодинамічних характеристик речовин; констант рівно-ваги і рівноважного складу хімічних реакцій; характеристик фазової рівноваги (включаючи побудову і аналіз фазових діаграм); констант і швидкостей хімічних процесів; електри-чної провідності розчинів електролітів; ЕРС гальванічних елементів; - оволодіти навичками: застосування основних експериментальних методів дослідження фізико-хімічних властивостей речовин, а також теоретичних законів фізичної хімії до вирішення практичних питань; - визначати специфіку перебігу різних хіміко-технологічних процесів; - виконувати розрахунки матеріального та теплового балансів; - давати характеристику складу і властивостей хімічних сполук, що входять до складу живих організмів; - проводити найпростіші біохімічні аналізи для демонстрації властивостей речовин, що входять до складу живих організмів. 2. Програми навчальних дисциплін, які виносяться на державний екзамен з хімії: «Неорганічна хімія», «Органічна хімія», «Фізична і колоїдна хімія», «Аналітична хімія», «Загальна хімічна технологія», «Хімія високомолекулярних сполук», «Біологічна хімія». Програма навчальної дисципліни «Неорганічна хімія» Методичне забезпечення 1. Крикливий Р.Д., Макодай Н.М, Крикливий Р.Д., Тести, вправи та задачі з курсу «Неорганічна хімія».-Частина І. Модуль І.- Вінниця: ВДПУ, 2008.-32с. 2. Макодай Н.М., Крикливий Р.Д., Крикливий Д.І. Тести, вправи та задачі з курсу «Неорганічна хімія» Частина І. Модуль ІІ.- Вінниця: ВДПУ, 2008. - 40 с. 3. Крикливий Р.Д., Макодай Н.М, Крикливий Р.Д., Тести, вправи та задачі з курсу «Неорганічна хімія».-Частина І. Модуль ІІІ.- Вінниця: ВДПУ, 2008.-16с. 4. Крикливий Д.І., Макодай Н.М., Крикливий Р.Д. Методичні вказівки до виконання лабораторних робіт з курсу «Неорганічна хімія» – Вінниця: ВДПУ, 2009. – 88с. 5. Ковальчук О.В., Крикливий Р.Д., Шинкарук Н.О. Загальна хімія. Навчально-методичний посібник. − Вінниця: ВДПУ, 2010. − 60 с. 6. Ковальчук О.В., Крикливий Р.Д., Шинкарук Н.О. Неорганічна хімія. Навчально-методичний посібник. − Вінниця: ВДПУ, 2010. − 66 с.
2.1.2. Рекомендована література: Основна: 1. Загальна та неорганічна хімія. Ч. 1 / Степаненко О. М., Рейтер Л. Г., Ледовських В. М., Іванов С. І. – К.: Пед. преса, 2002. – 520 с. 2. Основи загальної хімії: Підручник / В. С. Телегус, О. І. Бодак, О. С. Заречнюк, В. В. Кінжибало; під ред. В. С. Телегуса. – Львів: Світ, 2000. – 424 с. 3. Кириченко В.І. Загальна хімія [Текст]: навчальний посібник / В.І. Кириченко. – К.: Вища школа, 2005. – 639 с. 4. Романова Н.В. Загальна та неорганічна хімія: підручник для студентів вищ. навч. закладів / Н.В. Романова. – Київ; Ірпінь: ВТФ "Перун", 1998. – 480с. 5. Яворський В.Т. Основи теоретичної хімії: підручник для студентів вищ. навч. закладів / В.Т Яворський.- Л.: Видавництво НУ “Львівська політехніка”, 2004.- 256 с. 6. Кириченко В. І. Загальна хімія / В. І. Кириченко. – К.: Вища шк., 2005. – 639 с. 7. Григор’єва В. В. Загальна хімія / В. В. Григор’єва, В. М. Самійленко, А. М. Сич. – К.: Вища шк., 1991. – 431с. 8. Ахметов Н.С. Общая и неорганическая химия / Н.С. Ахметов– М.: Высш. шк, 1998.– 743 с. 9. Глинка Н.Л. Общая химия / Н.Л. Глинка. –Л.: Химия, 1987. – 704с. Додаткова: 1. Зайцев О.С. Общая химия: Состояние веществ и химические реакции / О.С. Зайцев.- М.: Химия, 1990.- 352 с. 2. Голуб О.А. Вступ до хімічної номенклатури / О.А.Голуб, М.Ю.Корнілов, В.В.Скопенко та ін.– К., 1997.– 48 с. 3. Корнілов М.Ю. Термінологічний посібник з хімії/ М.Ю. Корнілов, О.І. Білодід, О.А. Голуб.– К., 1996. – 256 с. 4. Яцимирський К.Д. Хімічний зв’язок/ К.Д. Яцимирський, В.К. Яцимирський. – К., 1993. – 309 с. 5. Глинка Н.Л. Задания и упражнения по общей химии / Н.Л. Глинка. – Л.: Химия, 1988. – 271с.
Рекомендована література Основна: 1. Домбровський А.В. Органічна хімія / Домбровський А.В., Найдан В.М. – К.: Вища школа, 1992. – 503 с. 2. Нейланд О.Я. Органическая химия /Нейланд О.Я. – М.:Высшая школа,1990. – 752с. 3. Кононський О. І. Органічна хімія / Кононський О.І. – К.: Дакор, 2003. – 568 с. 4. Ластухін Ю. О. Органічна хімія / Ластухін Ю.О., Воронов С. А.– Львів: Центр Європи, 2001. – 864 с. 5. Степаненко Б. Н. Курс органической химии: в 2-х ч./Степаненко Б.Н. – М.: Высшая школа, 1981.− Ч. І – 464 с., ч. 2 – 302с. 6. Тейлор Г. Основы органической химии для студентов нехимических спеціальностей / Тейлор Г. – М.: Мир, 1989. –384 с. 7. Черних В. П. Органічна хімія / Черних В.П. Зименковський Б. С., Гриценко І. С.: У 3 кн. – Х.: Основа,1993.−Кн. 1.: Основи будови органічних сполук. – Х.: Основа, 1993. – 144 с. 8. Черних В. П. Органічна хімія / Черних В.П. Зименковський Б. С., Гриценко І. С.: У 3 кн. – Х.: Основа, 1996. – Кн.2:Вуглеводні та їх функціональні похідні, 1996.-480 с. 9. Черних В. П. Органічна хімія / Черних В.П. Зименковський Б. С., Гриценко І. С.: У 3 кн. − Х.: Основа, 1997.−Кн.3. Гетероциклічні -а природні сполуки, 1997. −254 с. Додаткова: 1. Ким А. М. Органическая химия / Ким А.М. – Новосибирск: Сиб. унив. изд-во, 2001. – 814 с. 2. Вопросы и задачи по органической химии / [Веселовская Т.К., Мачинская И.В., Прижилголовская Н.М., Горбунова В.М., Сушкевич Ю.И.].– М.: Высшая школа,1988. – 256 с. 3. Сайкс П. Механизмы реакций в органической химии / Сайкс П. – М.: Химия, 1991. – 448с.
5. Штеменко Н. І. Органічна хімія та основи статичної біохімії / Штеменко Н.І., Соломко З. П., Авраменко В. І.–Дніпропетровськ: Вид–во Дніпропетр. ун–ту, 2003. – 644 с. Методичне забезпечення 1. Худоярова О.С. Методичні вказівки до виконання лабораторних робіт та самостійної роботи з курсу «Аналітична хімія» (Кількісний аналіз) вип.2. Вінниця: ВДПУ, 2008.-46с. 2. Худоярова О.С., Шинкарук Н.О. Кількісний аналіз. Навчально – методичний посібник до виконання самостійної роботи студентів денної та заочної форм навчання з курсу “Аналітична хімія” Вінниця: ВДПУ, 2009. – 184 с.
2.3.2. Рекомендована література: Основна 1. Золотов Ю.А. Основы аналитической химии: [в 2 кн. учебник для вузов]/под. ред. Академика Ю.А.Золотова. 3-е изд., перераб. и доп. Кн. 1. Общие вопросы. Методы разделения. М.: Высшая школа, 2004.– 351 с. 2. Золотов Ю.А Основы аналитической химии: [в 2 кн. учебник для вузов]/под. ред. Академика Ю.А.Золотова. 3-е изд., перераб. и доп. Кн. 2. Методы химического анализа. М.: Высша яшкола, 2004.– 494 с. 3. Васильев В.П. Аналитическая химия. В 2-х книгах. 4-е изд. стер. М.: "Высш.шк..", 2004. –Ч.1.–32ос,;Ч.2.–384с. 4. Сегеда А.С. Аналітична хімія. Якісний аналіз:[навчально-методичний посібник.]/ А.С.Сегеда –К.:ЦУЛ.– 2002.–524с. 5. Сегеда А.С. Аналітична хімія. Кількісний аналіз:[навчально-методичний посібник.]/ А.С.Сегеда, Р.Л Галаган.–К.:ЦУЛ.– 2002.–604с. 6. Сегеда А.С. Аналітична хімія. Якісний аналіз:[ збірник задач і вправ з аналітичної хімії]/ А.С.Сегеда.– К.: ЦУЛ.,Фітосоціоцентр,2002.– 429с. 7. Сегеда А.С. Збірник задач і вправ з аналітичної хімії. Кількісний аналіз/ А.С.Сегеда–. К.: ЦУЛ.,Фітосоціоцентр,2002.– 491с. Додаткова 1..Луцевич Д.Д. Аналітична хімія:[підручник]/Д.Д.Луцевич, А.С.Мороз, О.В.Грибальська.–2-е вид., перероб. і доп.–К.:Медицина.–Ч.1.–2009.–416с. 2. Власова Е.Г. Аналитическая химия. Химические методы анализа/ Власова Е.Г., Жукова А.Ф., Колосова И.Ф.– М.: ООО "Альянс" 2006.– 400 с. 3. Калинкин И.П. Новый справочник химика и технолога. Аналитическая химия. Ч. 1.; под общ. ред. проф. Калинкина И.П.; СПб. АЛО НПО "Мир и семья". 2002. 964 с. 4. Дорохова Е.Н/. Задачи и вопросы по аналитической химии/ Е.Н Дорохова, Г.В.Прохорова.– М.: Мир, 2001.–267 с. 5. Золотов Ю.А. Основы аналитической химии. Практическое руководство]/под. ред. Академика Ю.А.Золотова.– М.: Высшая школа, 2003.– 463 с. 6. Крылова Г.С. Гравиметрический анализ (ч. 1)/ Г.С. Крылова; [учебное пособие].– СПб. "Синтез", 2000.– 39с. 7. Р. Кельнер.Аналитическая химия: проблемы и подходы. В 2-х томах. [под ред. Р. Кельнера, Ж.-М. Мерме]; [перевод с англ. под ред. академика Ю.А.Золотова]. – М.: Мир. Т. 1. 2004. – 608 с., Т.2. 2004. –727с. Змістовий модуль 3. Розчини Тема 1. Розчини неелектролітів. Загальна характеристика розчинів. Способи вираження концентрації розчинів. Осмотичний тиск. Тиск пари над розчинами. Закон Рауля. Температура кипіння і замерзання розведених розчинів. Кріоскопія і ебуліоскопія. Розчини газів в рідинах. Вплив тиску і температури на розчинність газів в рідинах. Розчини рідина-рідина. Обмежена взаємна розчинність рідин. Тиск пари над ідеальними розчинами. Закони Коновалова. Тема 2. Розчини електролітів. Основні положення теорії електролітичної дисоціації Арреніуса і її розвиток. Ізотонічний коефіцієнт і його зв’язок із ступенем дисоціації. Іонні рівноваги, зв’язок між концентрацією, константою і ступенем дисоціації. Тема 3. Електрична провідність розчинів електролітів. Питома і молярна електропровідність. Рухливість іонів і числа перенесення. Закон Кольрауша. Класифікація електролітів. Активність і коефіцієнт активності. Іонна сила розчину. Гідроліз, константа гідролізу і константа дисоціації кислоти (основи). Роль рН і гідролізу в біологічних процесах. Буферні суміші і їх фізіологічна роль. Методичне забезпечення 1. Худоярова О.С. Курс лекцій з колоїдної хімії.-Вінниця, 2008.- 166с. 2. Василінич Т.М. Методичні вказівки до проведення тестового контролю з дисципліни «Фізична хімія». Вінниця: ВДПУ, 2009. – 60 с. 3. Худоярова О.С. Методичні вказівки до виконання самостійної роботи студентів з курсу «Колоїдна хімія». – Вінниця: ВДПУ, 2010. – 48 с. 4. Василінич Т.М. Задачі і вправи з фізичної хімії. – Вінниця: Гіпаніс, 2010.– 64с. 2.4.2. Рекомендована література: Основна: 1. Костржицький А.І. Фізична і колоїдна хімія/ А.І. Костржицький, В.М.Тіщенко. – К.: Центр учбової літератури, 2008. – 282с. 2. Гомонай В.І. Фізична і колоїдна хімія:Підручник/В.І.Гомонай. – Вінниця: Нова книга, 2007. – 496с. 3. Білий О.В. Фізична хімія/ О.В. Білий. – К.: Вища школа, 2006. – 254с. 4. Кабачний В.І. Фізична і колоїдна хімія:Підручник/ В.І. Кабачний, Л.К.Осіпенко, Л.Д.Грицан.–Харків:Прапор,199.–368с. 5. Мороз А.С. Фізична і колоїдна хімія / А.С. Мороз. – Л.: Світ, 1994.– 362с. 6. Білий О.В. Фізична і колоїдна хімія (задачі і вправи)/ О.В. Білий, Л.М. Біла.– К.: Вища школа, 1981. – 84с.
Додаткова: 1. Стрельцов О.А. Фізична і колоїдна хімія / О.А. Стрельцов. – Л.: Ліга-Прес, 2002. – 362с. 2. Каданер Л.І. Фізична і колоїдна хімія/ Л.І. Каданер. – К.: Вища школа, 1983. – 286с. 3. Стромберг А.Г. Физическая химия.-М.:Высш.шк.,1988. – 484с. 4. Яцимирський В.К. Фізична хімія рівноважних систем/ В.К. Яцимирський. – К.: НМКВО, 1992. – 456с. 5. Фридрисберг Д.А. Курс коллоидной химии/ Д.А.Фридрисберг. – Л.: Химия, 1984. – 368 с. Методичне забезпечення 1. Петрук Г.Д. Збірник задач з курсу «Загальна хімічна технологія».- Вінниця, 2006. – 20с. 2. Петрук Г.Д. Методичний посібник для самопідготовки і проведення практичних та лабораторних занять з загальної хімічної технології. - Вінниця, 2010. – 80 с 2.5.2. Рекомендована література: Основна 1.Яворський В.Т. Загальна хімічна технологія: підручник/В.Т.Яворський, Т.В.Перекупко, З.О.Знак, Л.В,Савчук.– Львів:Видавництво Національного університету "Львівська політехніка", 2005.–552с. 2.Соколов Р.С. Химическая технология/ Р.С. Соколов; [учеб. пособие для студ. высш. учеб. заведений].–М.:Гуманит. изд. центр ВЛАДОС, 2003.–Т.1.– 368с. 3.Соколов Р.С. Химическая технология/ Р.С. Соколов; [учеб. пособие для студ. высш. учеб. заведений].–М.: Гуманит. изд. центр ВЛАДОС, 2003.– Т.2.– 448с. 4.. МухлёновИ.П.– Основы химической технологи/ И.П. Мухлёнов.– М.: Высш.шк., 1991.– 463с. 5. Мухлёнов И.П. Общая химическая технология. Теоретические основы химической технологии/ И.П. Мухлёнов.– М.: Высш.шк., 1984.– 256с. Додаткова 1. Белоцветов Л.В. Химическая технология / Л.В.Белоцветов, О.Д.Бесков, А.Г.Ключников.– М.:Просвещение.– 1985.–360с. 2. Ключников Н.Г.– Практические занятия по химической технологи/ Н.Г.Ключников.– М.:Просвещение.– 1990.–296с. 3..Гончаров А.І Хімічна технологія/ А.І.Гончаров, І.П. Середа.– К.:Вища школа.–1981.–280с. 4. Мухленов И.П.– Расчеты химико-технологических процессов/ И.П. Мухленов.– Л.: Химия.– 1986.–425с 5. Кардашев Г.А. Физические методы интенсификации процессов химической технологии/ Г.А Кардашев.– М.:Химия,1990.–208с. Методичне забезпечення Худоярова О.С. Методичні вказівки до виконання самостійної роботи студентів та інструкції до лабораторних робіт з курсу «Хімія високомолекулярних сполук». – Вінниця, 2012. – 60 с. 2.6.2. Рекомендована література: Основна 1. Щур А.М. Высокомолекулярные соединения. 3-е изд., перераб. и доп./ А.М. Щур. - М.:Высшая школа, 1981. - 650с. 2. Стрепихеев А.А. Основы химии высокомолекулярних соединений. 3-е изд. перераб. и доп./ А.А. Стрепихеев, В.А. Деревицкая. - М.:Химия, 1986. - 440с. 3. Тагер А.А. Физико-химия полимеров. 3-е изд., перераб. и доп./ А.А. Тагер. - М.:Химия, 1988. - 370с. 4. Іщенко І.К. Хімія високомолекулярних сполук: Навчальний посібник/ І.К.Іщенко, Н.І.Гуляєва, Л.В. Мірошник, В.Д.Калугін, В.Д.Орлов. - Харків: ХНУ, 1998. - 213с. 5. Гетьманчук Ю.П. Хімія та технологія полімерів./ Ю.П. Гетьманчук, М.М. Братчак. - Львів: Бескид Біт, 2006.- 496 с. 6. Мигалина Ю.В. Основи хімії та фізико-хімії полімерів./ Ю.В. Мигалина, О.П. Козар. - К.: Кондор, 2010.- 325 с. Додаткова
Методичне забезпечення 1. Дабіжук Т.М. Практикум для лабораторних робіт з біохімії для студентів природничо-географічного факультету (спеціальність хімія і біологія). – Вінниця, «Гіпаніс», 2002. – 68с. 2. Дабіжук Т.М. Практикум для лабораторних робіт з біохімії для студентів природничо-географічного факультету (спеціальність хімія і біологія). – Вінниця, «Гіпаніс», 2006. – 54с. 3. Дабіжук Т.М. Практикум для лабораторних робіт з біохімії. – Вінниця, «Гіпаніс», 2001. – 88с. 4. Дабіжук Т.М. Біохімія спорту. Навчальний посібник для самостійної роботи студентів. – Вінниця, «Гіпаніс», 2007. – 142 с. 2.7.2. Рекомендована література: Основна 1. Кучеренко М.Є., Виноградова Р.П., Бабенюк Ю.Д. та ін. Біохімія.- К.: Либідь, 1995. – 464 с. 2. Боєчко Ф.Ф. Біологічна хімія. – К.: Вища школа, 1995.- 298 с. 3. Губcький Ю.І. Біологічна хімія. – Київ-Тернопіль: Укрмедкнига, 2000. –508с. 4. Біологічна хімія:[Підручник / Л.В.Вороніна, В.Ф.Десенко, Н.М. Мадієвська та ін.]; За ред.проф.Л.М. Вороніної. –Х.: Основа; Видавництво НФАУ,2000. – 608 с. 5. Кучеренко М.Є., Пащенко О.Ю., Туряниця І.М. та ін. Біохімія: Тестовий контроль знань. – К.:Либідь,1995. – 344 с. 6. Кучеренко М.Є., Виноградова Р.П., Бабенюк Ю.Д. Біохімія: збірник задач і вправ. – К.: Либідь, 1995. – 136 с. 7. Ємельяненко С.М., Каданер Л.І., Комарова О.А. Хімія і біологічна хімія: Практикум. – К.: Вища школа. Головне вид-во, 1988. – 206 с. 8. Шевряков М.В., Яковенко Б.В., Явоненко О.Ф. Практикум з біологічної хімії. – Суми: ВДТ “Університетська книга”, 2003. –204 с. Додаткова
Критерії оцінювання Оцінювання відповіді студентів на державному екзамені проводиться, за 100-бальною шкалою, з наступним переведенням до оцінки за національною шкалою та шкалою ЕСТS (див. табл.1). Таблиця 1. Критерії оцінювання знань студентів на державному екзамені
Рейтингові оцінки за виконання кожного завдання виставляються в балах з урахуванням відповідних критеріїв (див. табл. 2) Таблиця 2 Рейтингові оцінки за виконання окремих завдань державного екзамену
Мінімальні та максимальні величини оцінок у балах за виконання кожного завдання, які відповідають певним оцінкам за національною шкалою, розраховуються за критеріями ЕСТS відповідно до рекомендованих вагових коефіцієнтів (див. табл. 3 та табл. 4). Оцінки за виконання кожного завдання визначаються в балах та за національною шкалою відповідно до табл.4 та табл.5. Таблиця 3 Вагові коефіцієнти для розрахунку рейтингових оцінок
Таблиця 4 Відповідність рейтингових оцінок за виконання окремих завдань у балах оцінкам за національною шкалою
Таблиця 5 Відповідність рейтингових оцінок оцінкам за національною шкалою
Підсумкова рейтингова оцінка в балах, за національною шкалою та за калою ЕСТS заноситься до протоколу засідання державної екзаменаційної комісії, навчальної картки та залікової книжки студента, наприклад, так: 96/Відм./А, 85/Добре/В, 77/Добре/С, 69/Задов.D), 61/Задов./Е тощо. Задача Обчислити осмотичний тиск гідрозолю, якщо масова концентрація дорівнює 1 г/л при 293К, а дисперсність 100 мкм-1, густина дисперсної фази 19,3 г/см3 (форма частинок сферична). Розв’язання:
Знаходимо масу однієї частинки. Для сферичних частинок
Отже,
Обчислюємо осмотичний тиск за рівнянням
Програма
Державного екзамену з хімії
підготовки бакалавра галузі знань 0401 Природничі науки напряму підготовки 6.040101 Хімія* природничо-географічного факультету
В і н н и ц я – 2013 р. Програма державного екзамену з хімії для студентів занапрямом підготовки 6.040101 Хімія* освітньо-кваліфікаційного рівня «бакалавр»
Розробник: Блажко О.А., кандидат педагогічних наук, доцент кафедри хімії Крикливий Д.І., доктор технічних наук, професор кафедри хімії
Програма розглянута і схвалена на засіданні кафедри хімії Протокол від «06» березня 2013р. № 11 Завідувач кафедри ________________________ Д.І. Крикливий «____» ___________20 ___р.
Програма розглянута і схвалена на засіданні навчально-методичної комісії природничо-географічного факультету Протокол від «___» _____________20___р. № ________ Голова ______________________ Н.В. Бірюкова «____» ___________20 ___р. В С Т У П Державна підсумкова атестація студентів освітньо-кваліфікаційного рівня «бакалавр», напряму підготовки 6.040101 Хімія*, галузі знань 0401 Природничі науки відповідно до освітньо-кваліфікаційної характеристики, освітньо-професійної програми та визначених у них засобів діагностики, проводиться у формі державного екзамену з хімії, комплексного державного екзамену з методики навчання хімії та педагогіки, а для студентів, які мають нахил до науково-дослідної роботи, одна із форм засобу діагностики може бути замінена на захист дипломної роботи. Програма державного екзамену з хімії укладена відповідно до освітньо-професійної програми, освітньо-кваліфікаційної характеристики підготовки бакалавра, напряму підготовки 6.040101 Хімія*. 1. Мета та завдання державного екзамену з хімії: 1.1. Мета: встановлення фактичної відповідності теоретичних знань випускників та їх практичної підготовки вимогам освітньо-кваліфікаційної характеристики підготовки бакалавра з напряму підготовки 6.040101 Хімія* галузі знань 0401 Природничі науки 1.2. Завдання: перевірка та оцінка рівня фахової підготовки студентів ОКР «бакалавр», їх здатність використовувати набуті фундаментальні знання, уміння та навички в ході виконання ними своїх функціональних обов’язків. 1.3. Знати і вміти: знати: - основні поняття та закони хімії; - термінологію та номенклатуру хімічних сполук; - закономірності перебігу хімічних процесів; - основи сучасних теорій будови атома та хімічного зв’язку; - загальні відомості про хімічні елементи та про їх найважливіші хімічні сполуки, закономірність змінюваності атомних характеристик в групах та періодах; - основи хімічної термодинаміки; - основи хімічної кінетики; - основні методи дослідження будови речовини; - сучасні уявлення про кислоти та основи; - основні типи окисно-відновних реакцій: міжмолекулярні, внутрішньомолекулярні, диспропорціонування, комутації; - методи синтезу неорганічних матеріалів; - хімізм процесів, що відбуваються на поверхні металу у воді і водних розчинах солей; - основнi поняття теоретичної органічної хімії; - класи органічних сполук, правила номенклатури та основні методи одержання, взаємозв'язок мiж класами; - основні фізичні закономірності, хімічні перетворення та механiзми органiчних реакцiй; - окремих представників певного класу органічних сполук, практичне застосування найважливiших органічних сполук; - основні поняття, терміни і закони фізичної хімії; - методи теоретичного та експериментального дослідження у фізичній хімії; - кінетичний опис процесів, що перебігають; - методи розрахунку теплових ефектів хімічних процесів; - методи розрахунку електрорушійної сили гальванічних елементів; - методи визначення електропровідності розчинів електролітів; - методи розрахунку хімічної рівноваги; - основні типи процесів хімічної технології; - фізико-хімічні основи процесів, з метою правильного застосування їх на практиці; - будову і принцип дії апаратів та установок; - технологічні схеми вибраних хімічних виробництв; - методи промислового одержання хімічних сполук та виявлення шкідливих відходів. - характеристика основних груп біоактивних речовин (ферменти, вітаміни, гормони) та їх роль у біохімічних процесах, що проходять у живих організмах; - механізми регуляції біохімічних реакцій у живих організмах. вміти: - використовувати фундаментальні знання та елементарні навички для рішення практичних задач хімії, пояснити властивості речовин та характер їх зміни зі зміною умов на підставі квантово-механічних уявлень про електронну будову речовини; - проводити розрахунки за законами Авогадро, еквівалентів; обчислювати величини атомних (молекулярних) мас речовин за експериментальними даними; виводити формули речовин за даними про їх склад; - оцінювати тип зв'язку в бінарних сполуках; прогнозувати можливу гібридизацію орбіта лей, геометрію молекул; - обчислювати за експериментальними даними швидкості реакцій та константи швидкості, обчислювати склад рівноважних сумішей, константи рівноваги реакцій; оцінювати напрям зсуву хімічної рівноваги при зміні зовнішніх умов; - обчислювати ентальпії утворення речовин, зміну ентропії і вільної енергії реакції, прогнозувати можливість проходження процесу, враховуючи термодинамічні й кінетичні його параметри; - робити обчислення концентрацій розчинів; - визначати pH розчину, записувати молекулярні та скорочені іонні рівняння процесів гідролізу солей; - обчислювати можливість проходження ОВР; записувати рівняння анодного і катодного процесів при електролізі розчинів й розплавів солей; - визначати заряд комплексного іона, ступінь окислення комплексоутворювача, координаційне число; - володіти основними прийомами та методами роботи в лабораторії органічної хімії; - пояснити природу хімічного зв’язку у молекулі, описати структурну, просторову будову кожної органічної сполуки; - надавати характеристику як окремій органічній сполуці, так і класу сполук: гомологічний ряд, номенклатура, методи синтезу, хімічні властивості; - виконувати взаємоперетворення окремих сполук, визначати закономірності у взаємоперетвореннях гомологічного ряду, класу сполук; - провести літературний і раціональний пошук методiв синтезу органiчної сполуки заданої будови; | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |

 Обчислюємо радіус частинок:
Обчислюємо радіус частинок: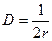 ;
;  м
м  нм.
нм.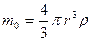 .
.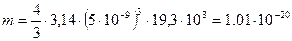 кг.
кг. :
: .№3 c.128
.№3 c.128


